核心蛋白多糖抑制翼状胬肉成纤维细胞增生的实验研究
张海江 霍鸣 董洁玉 宋庆磊
翼状胬肉为眼科常见病、多发病,是角结膜边缘区纤维血管组织增生而主动侵犯角膜的一种慢性眼表疾病,其组织学特点主要表现为成纤维细胞异常增生、胶原大量合成、炎症细胞浸润和细胞外基质过度沉积等。近年研究表明,翼状胬肉组织中有多种细胞因子异常表达,而转化生长因子-β(transforming growth factor β,TGF-β)与翼状胬肉的发病机理密切相关[1-2]。核心蛋白多糖(Decorin)是一种小分子的硫酸软骨素类蛋白多糖,由富含亮氨酸的核心蛋白和一条糖胺聚糖链组成,存在于几乎所有细胞外基质中,其核心蛋白区域能够与TGF-β高亲和性地结合以阻止TGF-β与其受体相结合,使其活性下降,是TGF-β的拮抗剂[3-4]。在眼科,目前文献报道Decorin已用于结膜下注射防治青光眼术后滤过泡瘢痕化的实验研究中[5]。本研究拟通过体外培养人翼状胬肉成纤维细胞(human pterygium fibroblasts,HPF),观察不同浓度Decorin对其增生的影响,为 Decorin应用于辅助治疗翼状胬肉或降低其术后复发率奠定理论基础。
1 材料与方法
1.1 实验试剂 新生小牛血清(杭州四季青生物工程材料有限公司),DMEM培养基(武汉谷歌生物科技有限公司),胰蛋白酶、四氮唑盐(MTT,美国 Amresco公司),免疫组织化学试剂盒(武汉博士德公司),Decorin(上海肯强实业有限公司)。
1.2 HPF的体外培养 取原发性翼状胬肉手术中切除的组织,用组织块贴壁法培养HPF。根据培养基的颜色及细胞生长状况,大约每3~4 d换液一次。待细胞单层融合生长后用2.5 g·L-1的胰蛋白酶消化,传代培养。取第3~4代对数生长期细胞用于实验,每次实验均取自同一批传代细胞。实验设4组,分别为空白对照组,0.1 mg·L-1、1.0 mg·L-1、10.0 mg·L-1Decorin组。
1.3 MTT比色法测定细胞生长抑制率 用含体积分数10%新生小牛血清的DMEM培养基调整细胞密度为100×103mL-1,每孔200 μL接种入96孔培养板中,置37℃、含体积分数5%CO2培养箱中培养至细胞贴壁后,每孔加入不同浓度的Decorin药液,使其终浓度分别为 0.1 mg·L-1、1.0 mg·L-1、10.0 mg·L-1,每组设 4 个复孔。继续培养 24 h、48 h、72 h后行MTT比色测定。在酶联免疫检测仪490 nm波长处测量各孔的吸光度值(A值)。按下列公式计算细胞生长抑制率:生长抑制率=(对照组A值-用药组A值)/对照组A值×100%。本实验在不同时间重复3次。
1.4 流式细胞技术测定细胞增殖周期 用0.1 mg·L-1、1.0 mg·L-1、10.0 mg·L-1Decorin 分别作用HPF 24 h、48 h、72 h 后,无水乙醇固定,Triton-100 振荡,RNA酶水浴,碘化丙啶染色过滤,置于流式细胞仪(美国B.D公司产品)进行细胞周期分析。
1.5 免疫组织化学染色PCNA检测细胞生长活性收集对数生长期细胞,胰蛋白酶消化、调整细胞密度后接种入6孔培养板中。培养板中预先放入清洗灭菌的盖玻片作细胞爬片。分别加入0.1 mg·L-1、1.0 mg·L-1、10.0 mg·L-1Decorin 培养 72 h 后取出盖玻片,细胞固定后行免疫组织化学 SABC法染色测定PCNA的表达情况。每张盖玻片随机选取5个高倍视野,在同一光线强度、同一放大倍数(×100)下检测PCNA阳性细胞的光密度值。每种浓度重复检测3次。
1.6 统计学分析 本研究数据应用SPSS 13.0软件进行处理,数据以均数±标准差()表示,不同组间采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 Decorin对 HPF增生的抑制作用 MTT比色法结果显示,与空白对照组相比,0.1 mg·L-1Decorin作用72 h后可明显抑制 HPF的增生,差异有统计学意义(P <0.05);1.0 mg·L-1、10.0 mg·L-1Decorin作用 24 h、48 h、72 h 时均能明显抑制HPF的增生,差异均有统计学意义(均为P<0.05);Decorin抑制HPF增生的强度随着其药物浓度的增加而增强,并随药物作用时间延长而增强(表1)。

表1 不同浓度Decorin对HPF增生不同时间的抑制率比较Table 1 Inhibitive ratios of Decorin on HPE proliferation at different doses and time points(¯x± s,rate/%)
2.2 Decorin对HPF细胞周期的影响 Decorin对HPF细胞周期的影响结果见表2。0.1 mg·L-1Decorin作用72 h后G0/G1期细胞比率为(60.46±4.28)%,与空白对照组相比差异有统计学意义(P<0.05);1.0 mg·L-1、10.0 mg·L-1Decorin 作用 24 h、48 h、72 h时 G0/G1期细胞比率均较空白对照组高,差异均有统计学意义(均为 P<0.05)。说明细胞阻滞于G0/G1期,进入 DNA合成期的细胞减少。此外,在同一作用时间内随着药物浓度的增加,G0/G1期比率升高;且同一浓度随药物作用时间的延长,G0/G1期比率升高。
2.3 Decorin对 HPF PCNA表达的影响 光学显微镜下观察细胞核呈浅黄色或深棕色的细胞为PCNA阳性细胞。空白对照组与Decorin组的阳性染色程度存在明显的差异。10.0 mg·L-1Decorin组阳性极少,1.0 mg·L-1Decorin 组也较少,而 0.1 mg·L-1Decorin组相对较多(图1)。采用 HMIAS-2000高清晰度彩色图文分析系统对结果进行分析,结果显示各组PCNA阳性细胞的光密度值分别为0.21±0.12、0.16±0.33、0.13±0.29、0.07±0.47,表明Decorin能够浓度依赖性地抑制HPF细胞表达PCNA(P <0.05)。

Figure 1 Expression of PCNA in HPF of each group.A:Control group;B:0.1 mg·L-1 Decorin group;C:1.0 mg·L-1 Decorin group;D:10.0 mg·L -1 Decorin group 各组 PCNA 的表达情况。A:空白对照组;B:0.1 mg·L -1 Decorin 组;C:1.0 mg·L-1 Decorin 组;D:10.0 mg·L-1 Decorin组
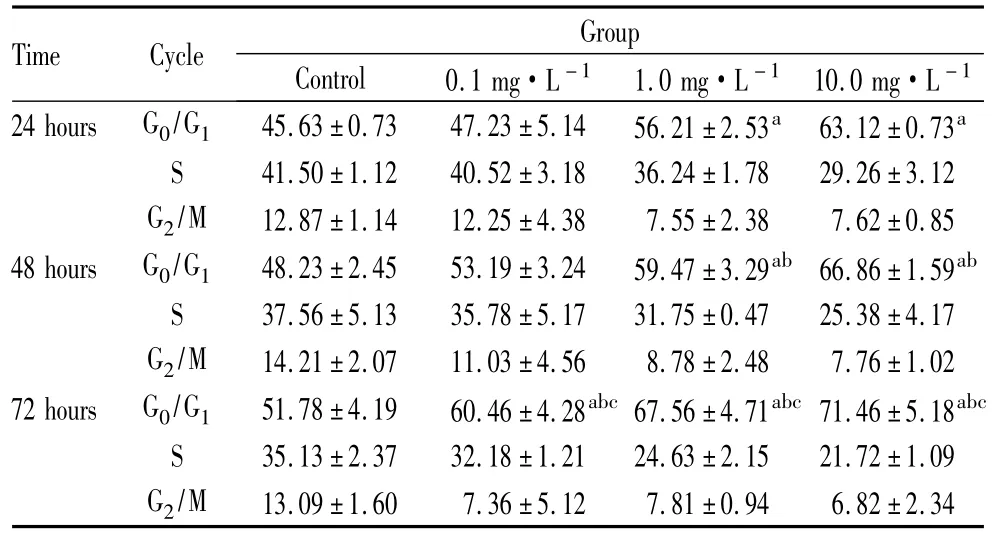
表2 不同浓度Decorin不同时间对HPF细胞周期影响Table 2 Effects of Decorin on HPE growth cycle at different doses and time points (¯x± s,rate/%)
3 讨论
关于翼状胬肉的发病机制,近年来的研究结果提示分两个阶段:一是角膜缘干细胞受到损害,角结膜屏障功能发生障碍;二是结膜上皮下组织成纤维细胞生长活跃,并发生炎症、血管化和结缔组织重塑形,角膜“结膜化”而形成。纤维增生和新生血管化的范围和程度是预测翼状胬肉切除术后复发的可靠形态学指标。目前通过翼状胬肉组织切片发现,许多细胞生长因子在翼状胬肉纤维增生的形成过程中起着重要作用,而TGF-β与 HPF的增生最为密切。石一宁等[6]通过免疫组织化学SP法检测发现原发性翼状胬肉组织中 TGF-β1的表达明显强于正常结膜组织,提示 TGF-β参与翼状胬肉的发生。Chen等[7]的研究表明,外源性TGF-β能促进 HPF增生并呈剂量依赖性,这说明翼状胬肉中 TGF-β的表达增强不仅不能抑制其生长分化,反而促进其增殖,证实TGF-β与翼状胬肉的发病机理密切相关。因此,调控翼状胬肉组织中TGF-β的表达,或阻断其信号转导可能对翼状胬肉的防治有一定作用[8]。
翼状胬肉发病率较高,手术切除是目前主要的治疗方法,但术后复发率也较高。目前临床上常常在翼状胬肉切除术中应用丝裂霉素C、5-氟尿嘧啶、平阳霉素等抗代谢药物来降低其术后的复发率,但由于这些药物对局部及全身有较大的毒副作用,往往会产生结膜伤口无法愈合、巩膜融解、角膜溃疡等相关并发症的发生,故临床上寻找一种安全、有效的抗增殖药是许多学者面临的研究课题[9]。由于Decorin核心蛋白区域能够高亲和性地结合TGF-β,中和TGF-β的活性。同时Decorin没有免疫原性、组织相容性好,且无毒副作用,是TGF-β的拮抗剂和天然调节物。目前国外已将Decorin广泛应用于抗纤维化和肿瘤的实验研究中[10-12]。但在眼科领域,现有文献报道主要用于青光眼术后抗滤过泡瘢痕化、角膜新生血管、增殖性玻璃体视网膜病变、后发性白内障等方面,尚无用于防治翼状胬肉或降低其术后复发率的实验研究[5,13-15]。本实验直接从人翼状胬肉组织中体外培养HPF,其生物学特性符合人眼病变的情况。分别采用 MTT法、流式细胞仪、免疫组织化学染色PCNA来检测Decorin对HPF增生、凋亡的影响。
本研究表明,随着Decorin作用时间的延长(24 h~72 h)和质量浓度(0.1~10.0 mg·L-1)的增加,其抑制 HPF增生的作用逐渐加强,0.1 mg·L-1作用72 h后可产生显著的抑制作用,1.0 mg·L-1Decorin作用48 h和72 h产生的抑制作用更强,说明Decorin对HPF增生的抑制作用是呈浓度依赖性和时间依赖性的。流式细胞仪检测 HPF细胞周期后发现,Decorin组G0/G1期细胞比率明显升高,与空白对照组比较差异有统计学意义,提示Decorin能将HPF阻抑于G0/G1期,使其S期或有丝分裂期延长,阻止了HPF的进一步分化。PCNA是一种核内蛋白,是DNA聚合酶δ的辅助蛋白,直接参与核内DNA的合成,其表达及合成与增生细胞的增生周期密切相关,是评价细胞增生状态的一种理想指标。本实验通过免疫组织化学染色PCNA,结果表明当Decorin作用HPF细胞72 h后,能浓度依赖性地抑制PCNA的表达,这与本实验所采用 MTT法检测的 Decorin对HPF细胞增生活性的抑制作用的结果相一致,也与流式细胞仪测定细胞周期所反映的增生状态一致,这种效应可能是通过Decorin抑制TGF-β的生物学活性而产生的。
本研究通过观察不同质量浓度、不同作用时间Decorin作用HPF后其细胞生长抑制率、细胞周期及细胞凋亡的影响,结果发现 Decorin呈浓度、时间依赖性地抑制HPF增生和诱导其凋亡,提示Decorin对翼状胬肉的防治具有潜在的应用前景。但本研究仅限于体外实验,且目前还没有成熟的翼状胬肉模型,故将Decorin应用于临床防治翼状胬肉或降低其术后复发率还需进一步研究。
1 Bianchi E,Scarinci F,Grande C,Plateroti R,Plateroti P,Plateroti AM,et al.Immunohistochemical profile of VEGF,TGF-β and PGE2in human pterygium and normal conjunctiva:experimental study and review of the literature[J].Int J Immunopathol Pharmacol,2012,25(3):607-615.
2 刘艳艳,罗丽卿,吴平.转化生长因子-β及结缔组织生长与翼状胬肉关系的研究现状[J].广东医学院学报,2011,29(2):73-76.
3 Yamaguchi Y,Mann DM,Ruoslahti E.Negative regulation of transforming growth factor-β by the proteoglycan decorin[J].Nature,1990,346(6281):281-284.
4 Neill T,Schaefer L,Iozzo RV.Decorin:a guardian from the matrix[J].Am J Pathol,2012,181(2):380-387
5 Grisanti S,Szurman P,Warga M,Kaczmarek R ,Ziemssen F,Tatar O ,et al.Decorin modulates wound healing in experimental glaucoma filtration surgery:a pilot study[J].Invest Ophthalmol Vis Sci,2005,46(1):191-196.
6 石一宁,张纯涛.TGF-β1、TGF-βRⅡ及 Smad4蛋白在原发性翼状胬肉中的表达[J].眼科新进展,2010,30(5):430-437.
7 Chen JK,Tsai RJ,Lin SS.Fibroblast isolated from human pterygia exhibit transformed cell characteristics[J].Cell Dev Biol Anim,1994,30(4):243-248.
8 Lee SB,Li DQ,Tan DT,Meller DC,Tseng SC.Suppression of TGF-beta signaling in both normal conjunctival fibroblasts and pterygial body fibroblasts by amniotic membrane[J].Curr Eye Res,2000,20(4):325-334.
9 史伟云,王富华.翼状胬肉手术中慎用丝裂霉素 C[J].中华眼科杂志,2013,49(10):869-871.
10 Dudás D,Kovalszky I,Gallai M,Naqy JO,Schaff Z,Knittel T,et al.Expression of decorin,transforming growth factor-beta1,tissue inhibitor metalloproteinase 1 and 2,and type IV collagenases in chronichepatitis[J].Am J Clin Pathol,2001,115(5):725-735.
11 Tralhão JG,Schaefer L,Micegova M,Evaristo C,Schönherr E,Kayal S,et al.In vivo selective and distant killing of cancer cells using adenovirus-mediated decorin gene transfer[J].FASEB J,2003,17(3):464-466.
12 Bi X,Pohi NM,Qian Z,Yang GR,Gou Y,Guzman G,et al.Decorin-mediated inhibition of colorectal cancer growth and migration is associated with E-cadherin in vitro and in mice[J].Carcinogenesis,2012,33(2):326-330.
13 Nassar K,LüKe J,LüKe M,Kamal M,Abd EI-Nabi E,Soliman M,et al.The novel use of decorin in prevention of the development of proliferative vitreoretinopathy(PVR)[J].G raefes Arch Clin Exp Ophthalmol,2011,249(11):1649-1660.
14 Mohan RR,Tovey JC,Sharma A,Schultz GS,Cowden JW,Tandon A.Targeted decorin gene therapy delivered with adeno-associated virus effectively retards corneal neovascularization in vivo[J].PLoS One,2011;6(10):e26432.
15 向建南,张桂兰,张海江,王国华,霍鸣.核心蛋白多糖对兔晶状体上皮细胞增生的抑制作用[J].眼科新进展,2011,31(4):327-331.

