乙酰半胱氨酸对角膜新生血管形成过程中瘦素和PEDF表达的调节
郝瑞霖 杨炜 张奕霞 罗远湘 张晓雪
角膜新生血管(corneal neovascularization,CNV)是眼表疾病的显著特征之一,角膜外伤、感染和有毒物侵入等发生时,一般都伴随CNV。近年来,由于免疫学、分子生物学等学科的发展,人们对CNV的认识有不少突破,但CNV的发病机制仍未完全明了,其治疗仍有许多问题尚待解决。
瘦素(leptin)是近年来发现的一种由脂肪细胞分泌的肽类激素,亦是一种血管生成促进因子[1]。色素上皮衍生因子(pigment epithelium derived factor,PEDF)能抑制血管内皮细胞移行和角膜血管化,被认为是目前最有效的血管生成抑制因子[2]。乙酰半胱氨酸为L-半胱氨酸的乙酰化产物,也是一种氨基酸,其药理作用机制有:提高机体内谷胱甘肽含量,具有直接抗氧化损伤的作用,影响一氧化氮的产生及其合酶活性并对NF-κB产生影响。本研究通过建立大鼠碱烧伤CNV模型,观察碱烧伤后不同时期角膜组织病理形态学变化,了解瘦素与PEDF的表达水平及与CNV生成的相关性,以及乙酰半胱氨酸对瘦素及PEDF表达的影响,为进一步认识碱烧伤后CNV发病机制提供病理学依据。
1 材料与方法
1.1 实验动物与分组 75只健康Wistar雄性大鼠,眼表无任何疾病,由新疆医科大学动物实验中心提供,体质量200~250 g。随机分为 A、B、C 3组,每组各 25 只,分别于伤后 1 d、4 d、7 d、11 d、14 d 取材,大鼠右眼为CNV模型眼,左眼为自身对照。
1.2 动物模型制作 采用100 g·L-1水合氯醛(3 mL·kg-1)腹腔注射诱导全身麻醉。全身麻醉后检查所有鼠眼无炎性反应及其他病变,然后滴10 g·L-1丁卡因3次角膜表面麻醉。统一规格直径3.0 mm单层圆形滤纸浸入1 mol·L-1氢氧化钠溶液6 s,所有实验大鼠均选右眼,快速将滤纸准确贴于眼角膜中央表面23 s,取下滤纸后立即用生理盐水冲洗1 min,观察烧伤区的角膜立即变为致密白色圆形混浊。造模后所有实验眼均给予卓比安眼液散瞳,杰奇眼膏消炎。伤后A组每天滴注PBS液(每次1滴,每天3次),B组每天滴注乙酰半胱氨酸滴眼液(含乙酰半胱氨酸为标示量的90%~110%,每次1滴,每天3次),C组在碱烧伤模型建立后7 d开始每天滴注乙酰半胱氨酸滴眼液(用法用量同B组)。回笼后正常饲养。每天裂隙灯显微镜下观察CNV情况,并作详细记录。
1.3 观察指标及测定方法 分别在大鼠角膜碱烧伤后 1 d、4 d、7 d、11 d、14 d 时,腹腔注射 100 g·L-1水合氯醛(3 mL·kg-1)诱导全身麻醉后,在裂隙灯显微镜下测量大鼠CNV长度。按公式:A=C/123.14×[r2-(r-l)2],计算 CNV 面积,其中 C 为CNV累计圆周钟点数,l为CNV从角膜缘深入角膜的长度,r为大鼠角膜半径。
1.4 样本 分别在大鼠角膜碱烧伤后1 d、4 d、7 d、11 d、14 d,每组随机抽取5只大鼠,记录 CNV生长情况后过量麻醉处死,取下大鼠角膜,用40 g·L-1多聚甲醛溶液固定,包埋后将每个角膜标本制成5 μm厚石蜡切片,所有切片行HE染色,封片,光镜下观察;各组正常对照眼以及1 d、7 d、14 d的样本留一半行免疫组织化学检测。瘦素一抗为兔抗大鼠瘦素多克隆抗体(购自北京博奥森生物工程有限公司)及兔抗大鼠PEDF多克隆抗体(购自美国Bioworld生物工程有限公司),二抗为生物素化羊抗兔IgG(购自北京中杉金桥生物公司)。在光学显微镜下观察瘦素和PEDF的表达情况并拍照。
1.5 瘦素、PEDF阳性表达率的评价标准 随机选择5个高倍镜视野(×400)进行判断,细胞浆着色呈棕黄色为阳性表现,瘦素的表达以染色强度和阳性细胞率的得分之和进行判断:0分:无染色,1分:弱染色(浅黄色),2分:中等染色(棕黄色),3分:强染色(黄褐色);0分:阳性细胞率≤5%,1分:>5%-25%,2分:>25%~50%,3分:>50%。上述2项得分相加,0分为阴性(-),1~2分为弱阳性(+),3~4分为中等阳性(++),5~6分为强阳性(+++)。将瘦素与PEDF的染色结果通过多媒体医用彩色图像病理分析系统(ipp软件)分析,每张切片随机选取5个高倍视野,测量瘦素与PEDF免疫组织化学染色的平均光密度(average optic density,AOD)值,半定量分析瘦素与PEDF蛋白的表达情况。
1.6 统计学分析 用SPSS 13.0统计软件进行统计分析,所有计数资料以均数±标准差表示。CNV长度和面积采用重复测量数据的方差分析,瘦素和PEDF的AOD值在对实验数据进行正态性检验、方差齐性检验后,按完全随机的单因素方差分析进行,组间两两比较用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 CNV生长情况 正常对照眼均无CNV。A组CNV模型眼伤后1 d角膜巩膜缘显著充血,烧伤区的角膜上皮水肿、混浊,未见明显 CNV生长;4 d可见新生血管芽从角巩膜缘开始生长,逐渐向透明角膜延伸;7 d CNV最旺盛,血管伸出分支,血管变长,面积增加;11 d CNV生长渐缓;14 d时CNV基本稳定,面积达到最大,其后生长速率平缓,部分细小血管开始退化。B组CNV生长趋势与A组基本相似,但在角膜碱烧伤后不同时期CNV的生长速度比A组和C组迟缓,明显受到抑制;C组CNV生长趋势与A组基本相似,比A组生长缓慢但稍快于B组。
对碱烧伤后不同时期的CNV长度及面积分别进行方差分析(表1-表2),各组内不同时期CNV长度及面积的总体比较差异有统计学意义(均为P<0.05);在测量的4个不同时间点三组组间CNV长度及面积总体比较差异均有统计学意义(均为P<0.05),多重比较结果显示,4个不同时间点各组间除4 d A组和C组组间差异无统计学意义(P>0.05)外,其余各个时间点各组间差异均有统计学意义(均为P<0.05)。
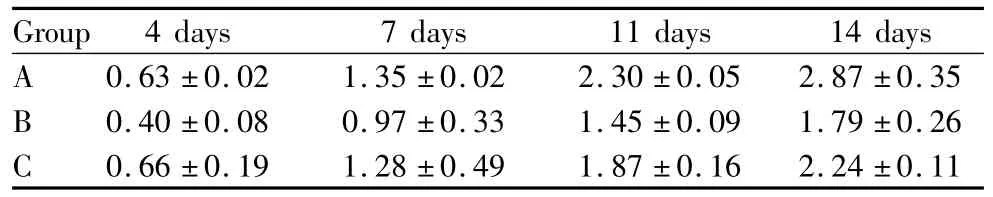
表1 大鼠角膜碱烧伤后不同时期CNV长度比较Table 1 CNV length at different time points after alkali burn (l/mm)

表2 大鼠角膜碱烧伤后不同时期CNV面积比较Table 2 CNV area at different time points after alkali burn (S/mm2)
2.2 角膜组织的HE染色 正常角膜有5层结构,上皮层、前弹力层、基质层、后弹力层和内皮层。A组烧伤后1 d,烧伤区角膜混浊水肿,上皮层脱落,有明显炎症细胞浸润;4 d时新生血管开始生长;7 d时炎症细胞增多,可见新生血管侵入角膜基质层(图1);11 d时可见新生血管增多;14 d时新生血管增加,管腔变大。B组角膜病理变化与A组基本相似,但炎症细胞浸润及新生血管侵入程度比A组轻,C组角膜病理变化与A组基本相似,但7 d后炎症细胞浸润及新生血管侵入比同期A组轻。但比B组稍重(图1)。
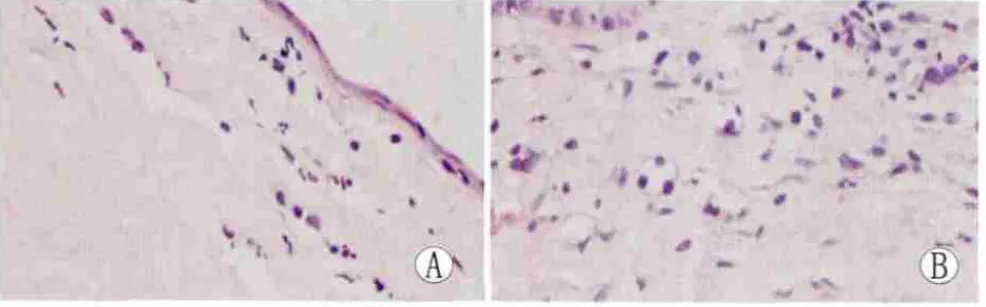
Figure 1 HE staining of corneal tissues(×400).A:Normal control group;B:Experimental group at 7 days after alkali burn 角膜组织HE染色(HE×400)。A:正常对照眼;B:碱烧伤后7 d A组实验眼
2.3 瘦素、PEDF的表达及其与CNV生长的相关性 正常角膜瘦素可以微弱表达于角膜上皮层和基质层,PEDF可表达于角膜上皮、内皮、新生血管内皮细胞。烧伤后不同时期角膜瘦素和PEDF阳性免疫组织化学染色结果显示(图2-图3),各组碱烧伤后1 d瘦素、PEDF开始表达,A、B、C三组总体表达差异均无统计学意义(F瘦素=2.182,P >0.05;FPEDF=2.563,P>0.05)。7 d时瘦素、PEDF表达明显增强,表达部位主要分布在新生血管区域和角膜上皮,三组瘦素总体表达差异有统计学意义(F=159.423,P<0.05);经多重比较结果显示,A组和B组、B组和C组间差异均有统计学意义(均为P<0.05),A组和C组间差异无统计学意义(P>0.05)。三组PEDF总体表达差异有统计学意义(F=418.947,P<0.05);经多重比较结果显示,A组和B组、B组和C组间PEDF差异均有统计学意义(均为P<0.05),A组和C组间差异无统计学意义(P>0.05)。14 d时瘦素表达增强,PEDF表达减弱,三组瘦素总体表达差异有统计学意义(F=651.837,P<0.05);经多重比较结果显示,各组间差异均有统计学意义(均为P<0.05)。三组PEDF总体表达差异有统计学意义(F=735.288,P<0.05);经多重比较结果显示,各组间两两比较差异均有统计学意义(均为 P <0.05,见表3-表4)。
表3 各组角膜碱烧伤后不同时期的瘦素AOD值Table 3 AOD values of leptin at different time points after alkali burn of each group ()

表3 各组角膜碱烧伤后不同时期的瘦素AOD值Table 3 AOD values of leptin at different time points after alkali burn of each group ()
Group 1 day 7 days 14 days A 0.205 5±0.090 1 0.276 1±0.114 4 0.316 1±0.0803 B 0.205 4±0.075 3 0.232 2±0.074 9 0.250 4±0.127 9 C 0.204 8±0.045 1 0.269 2±0.064 6 0.282 3±0.0776

Figure 2 Immunohistochemical staining of leptin at 7days after alkali burn of group A,B,C.Leptin was located in the epithelial and stromal layer(SP staining,×400) 角膜碱烧伤后7 d,A、B、C三组角膜瘦素免疫组织化学染色,瘦素表达于角膜上皮层和基质层(SP染色,×400)
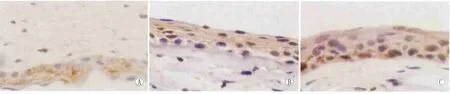
Figure 3 Immunohistochemical staining of PEDF at 7days after alkali burn of group A,B,C.PEDF was located in the epithelial and stromal layer(SP staining,×400) 角膜碱烧伤后7 d,A、B、C三组角膜PEDF免疫组织化学染色,PEDF表达于角膜上皮层和基质层(SP染色,×400)
表4 各组角膜碱烧伤后不同时期的PEDF AOD值Table 4 AOD values of PEDF at different time points after alkali burn of each group ()

表4 各组角膜碱烧伤后不同时期的PEDF AOD值Table 4 AOD values of PEDF at different time points after alkali burn of each group ()
Group 1 day 7 days 14 days A 0.203 2±0.103 5 0.352 1±0.107 4 0.223 4±0.1186 B 0.203 2±0.103 5 0.389 9±0.072 1 0.253 0±0.101 3 C 0.201 2±0.134 5 0.356 1±0.123 3 0.237 7±0.1067
3 讨论
CNV是眼表疾病的显著特征之一,在病理因素下形成,不但严重影响视力,而且容易导致角膜移植手术失败。CNV的形成机制十分复杂,与多种因子有关,如 VEGF、VCAM-1等[3-4]。瘦素的发现基于对肥胖的研究,随着研究的深入,愈来愈多的结果显示瘦素作为一种血管生长促进因子促进炎症组织的血管新生[5]。Park等[6]研究发现,瘦素与脐静脉内皮细胞孵育48 h后,培养基中分泌型血管内皮生长因子表达增加。近年有文献[7]表明在角膜碱烧伤的大鼠模型中,瘦素的表达增强,与CNV的数量正相关。此外,瘦素与多种疾病如冠状动脉病变、乳腺癌患者淋巴转移、代谢综合征、子宫内膜炎等密切相关[8]。PEDF是丝氨酸蛋白酶抑制剂家族中的非抑制性成员,是一种多功能蛋白,在抗新生血管方面,PEDF是已知的最强的内源性血管抑制因子,是“加强血管新生抑制因素”最主要的方式,它在正常人眼组织中高表达,被认为是维持角膜、玻璃体无血管的关键因素[9]。
乙酰半胱氨酸为一含有巯基(-SH)的化合物,最初运用于呼吸道感染,NAC可以调节细胞的代谢活性,预防DNA损伤,调整基因的表达和信号转导,抗细胞凋亡,抑制恶性肿瘤发展等,除此之外,还可以抑制血管生成。De Mattia等[10]对2型糖尿病患者给予NAC治疗,观察到治疗后红细胞内GSH含量增高而血浆sVCAM-1减少。本实验中,各组碱烧伤7 d时,瘦素、PEDF表达明显增强,B组瘦素表达明显低于A、C组,B组PEDF的表达略微高于A、C组,B组CNV明显没有A、C组长势旺盛;14 d时,B组瘦素表达最弱,PEDF表达最强。由此可见,在乙酰半胱氨酸干预下瘦素表达减弱,PEDF表达增强。由此说明,乙酰半胱氨酸能有效降低瘦素表达,提高PEDF的表达。
本实验验证了乙酰半胱氨酸对瘦素有抑制作用,对PEDF有促进作用,这为治疗CNV以及瘦素引起的其他疾病提供了一个新的靶点。PEDF是有效的新生血管生成抑制因子,乙酰半胱氨酸能增强PEDF的表达,可见PEDF和乙酰半胱氨酸联合用药能有更好的效果。目前,乙酰半胱氨酸对瘦素的抑制机制尚不明确,具体机理有待我们进一步研究。本研究不仅为乙酰半胱氨酸治疗新生血管提供了有效的治疗方案,也为瘦素引起的其他疾病提供了更好的治疗前景,使这一老药焕发出新的生机。
1 朱翠翠,张季红,徐佩茹,李敏,马冬梅.β3肾上腺素能受体基因及瘦素基因多态性与新疆哈萨克儿童肥胖的关系[J].中华实用儿科临床杂志,2013,28(11):816-819.
2 金姬,关明,马建兴,刘祖国.PEDF和VEGF在翼状胬肉组织中的不平衡表达[J].眼科研究,2004,22(5):505-507.
3 Kruse FE,Joussen AM,Rohrschneider K,Becker MD,Völcker HE.Thalidomide inhibits cornea langiogenesis induced by vascular endothelial growth factor[J].G raefes Arch Clin Exp Ophthalmol,1998,236(6):461-466.
4 Seo K,Choi J,Park M,Rhee C.Angiogenesis effects of nerve growth factor(NGF)on rat corneas[J].J Vet Sci,2001,2(2):125-130.
5 Cao R,Brakenhielm E,Wahlestedt C,Thyberg J,Cao Y.Leptin induces vascular permeability and synerg istically stimulates angiogenesis with FGF-2 and VEGF[J].Proc Natl Acad Sci USA,2001,98(11):6390-6395.
6 Park HY,KwonH M,Lim HJ.Pontential role of leptin in angiogenesis:Leptin induces endothelial cell proliferation and expression of matrix metalloproteinase in vivo and in vitro[J].Exp Med,2001,33(2):95-102.
7 潘婕,张明昌,张洁,孙广莉.瘦素和血管内皮生长因子在碱烧伤诱导的大鼠角膜新生血管模型中的表达[J].眼科新进展,2010,30(10):941-943.
8 Dong XQ,Huang M,Hu YY,Yu WH,Zhang YZ.Time course of plasma leptin concentrations after acute spontaneous basal ganglia hemorrhage[J].W orld Neurosurg,2010,74(3):286-293.
9 Matsuoka M,Ogata N,Otsuji T,Nishimura T,Takahashi K,Matsumura M.Expression of pigment epithelium-derived factor and vascular endothelial growth factor in choroidal neovascular membranes and polypoidal choroidal vasculopathy[J].Br J Ophthalmol,2004,88(6):809-815.
10 De Mattia G,Bravi MC,Laurenti O.Reduetion of oxidative stress by oral N-acetyl-L-cysteine treatment decreases plasma soluble vascular cell adhesion molecule-1 concentration in non-obese,non-dyslipidaemic,normotensive,patients with non-insulin-dependent diabetes[J].Diabetologia,1998,41(11):1392-1396.

