负载可递送内皮抑制素基因的胶原基复合角膜替代物在兔角膜移植中的研究△
李雪 王海燕 郝永娜 赵少贞 刘文广 李亚楠 边领斋 粘红 魏瑞华
角膜病变和角膜损伤是仅次于白内障的第二位致盲眼病,可以通过角膜移植治愈。人工角膜的出现,使角膜移植摆脱了供体缺乏和移植成功率低的问题,但目前应用的人工角膜术后有一定比例的并发症,如继发性青光眼、植入物排出、角膜渗漏、眼内炎、角膜溶解及视网膜脱离等[1-3],严重时会直接导致视力丧失[4],限制了其临床应用。同时严重新生血管化的角膜植床因免疫排斥反应导致移植失败率高达20%~30%,甚至60%以上[5]。本实验旨在研究一种能够抑制角膜新生血管(corneal neovascularization,CNV)生长的角膜替代物,通过同种异体角膜植片对比来评价此种替代物作为角膜支架材料的可行性。
1 材料与方法
1.1 材料 角膜支架材料由天津大学材料科学与工程学院提供。材料1为胶原基含糖半互穿网络水凝胶角膜替代物材料(Coll-Glyco SIPN,胶原基复合角膜替代物);材料2为负载可递送内皮抑制素基因的胶原基复合角膜替代物(专利号:CN 201210435892)。
角膜支架材料的性能:直径 12.00 mm,厚度300.00 μm,曲率半径7.25 mm。白光透光率90%以上,平衡含水量90%以上,力学性能(0.60±0.10)mPa,体外胶原酶(12 μg·mL-1)降解实验,30 h 内剩余质量在40%以上。正常兔角膜平衡含水量为(75.6±1.3)%,透光率为(89±1)%,遮光指数1.357,拉伸强度(2.77±1.77)mPa[6-7]。
1.2 实验动物与分组 选用健康成年大耳白兔105只,雌雄不限,体质量 2.0~2.5 kg,由天津医科大学动物实验中心提供。随机分为Ⅰ组、Ⅱ组、Ⅲ组,每组30只(每只兔左眼为实验眼,右眼不施手术为正常对照眼),Ⅰ组、Ⅱ组分别行板层植入材料1、2;Ⅲ组为同种异体对照组,行同种异体角膜板层移植。各组根据不同处死时间随机分为3 d、7 d、15 d、1个月、3个月、6个月6个亚组,每个亚组各5只。其余15只兔(30眼)作为Ⅲ组角膜移植供体来源。
1.3 方法 整个手术操作过程严格遵循无菌操作步骤。在兔角膜中心区域剖切植床,直径6.00 mm,约2/3角膜厚度。Ⅰ组、Ⅱ组处理:6.25 mm环钻取支架材料作为供体,用10-0缝线采用上覆缝合方法[8]将植片固定于植床上,术后用左氧氟沙星眼液滴眼,每天4次,氧氟沙星眼膏每天1次,持续2周。Ⅲ组处理:用6.25 mm环钻钻取供体兔角膜前板层2/3角膜厚度,隧道刀剖切获得同种异体角膜板层移植片,10-0缝线间断缝合,术后用药同Ⅰ组、Ⅱ组。
1.4 角膜大体情况观察 术后3 d、7 d、15 d、1个月、3个月、6个月进行肉眼及裂隙灯观察各组的角膜情况,包括角膜透明度及CNV情况。角膜透明度评分标准[9]:完全透明(0分);轻度混浊,虹膜纹理可见(1分);中度混浊,虹膜纹理模糊(2分);重度混浊,瞳孔可见(3分);极重度混浊,前房看不见(4分)。CNV评分标准[9]:角膜无明显 CNV(0分);植床周围有CNV(1分);CNV达植片周边部(2分);CNV达植片中周部(3分);CNV布满角膜植片(4分)。
1.5 组织学观察 分别于术后3 d、7 d、15 d、1个月、3个月、6个月处死动物,行HE染色,光镜下观察角膜病理切片;免疫组织化学法检测上皮细胞标志蛋白K3(BD,美国)和血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白(R&D,美国)在角膜组织的表达。兔眼球石蜡切片经脱蜡至水,用标准SP两步法进行免疫组织化学染色。滴加一抗于4℃条件下孵育过夜,然后与二抗于37℃条件下孵育30 min,DAB染色,苏木素复染后封片。
1.6 统计学分析方法 采用 SPSS 19.0软件,分别对Ⅰ组、Ⅱ组、Ⅲ组的角膜透明度评分与CNV评分进行Friedman秩和检验,两组每个时间点之间比较进行Wilcoxon符号秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 裂隙灯观察结果 术后3 d,三组均可见角结膜充血水肿,Ⅰ组(图1A1)、Ⅱ组隐见瞳孔,结膜囊内有分泌物;Ⅲ组瞳孔可见(图1A2)。术后7 d,角膜水肿减轻,Ⅰ组仍呈现弥漫样水肿,角膜缘上方有细小 CNV向植片生长;Ⅱ组、Ⅲ组瞳孔清晰可见,角膜缘上方有细小 CNV向植片生长(图1B1、B2)。术后15 d,Ⅰ组、Ⅱ组(图1C1)结膜充血基本消失,角膜缘CNV向植片生长;Ⅲ组结膜充血消失,角膜水肿局限在缝线周围,围绕缝线周围有小部分混浊区域,CNV密度明显增高,集中在上方(图1C2)。术后1个月,角膜基本透明,Ⅰ组、Ⅱ组可见CNV呈短毛刷状从角膜缘向植片方向生长,主要集中在上方(图1D1);Ⅲ组部分CNV变细、退化(图1D2)。术后3个月,Ⅰ组、Ⅱ组角膜围绕缝线处仍残留小部分混浊,部分 CNV变细、退化;Ⅲ组角膜围绕缝线处仍残留小部分混浊,可见CNV大部分减退。至术后6个月,各组角膜残留局部混浊区域,未见明显CNV(图2)。整个观察期间,未见角膜植床坏死、溃疡。
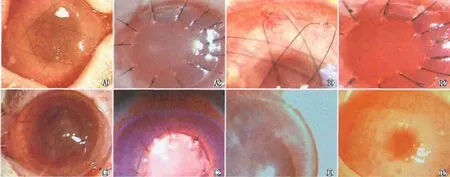
Figure 1 Corneal growth observed by slit lamp after corneal transplantation.A1,A2:3 days in groupⅠ and group Ⅲ;B1,B2:7 days in groupⅡ and groupⅢ;C1,C2:15 days in groupⅡand groupⅢ;D1,D2:1 month in groupⅡ and groupⅢ 角膜移植术后裂隙灯显微镜观察情况。A1、A2:术后3 d,Ⅰ组、Ⅲ组角膜生长情况;B1、B2:术后7 d,Ⅱ组、Ⅲ组角膜生长情况;C1、C2:术后15 d,Ⅱ组、Ⅲ组角膜生长情况;D1、D2:术后1个月,Ⅱ组、Ⅲ组角膜生长情况

Figure 2 No obvious CNV was seen in each group at postoperative 6 months.A:GroupⅠ;B:GroupⅡ;C:GroupⅢ 术后6个月,各组角膜未见明显CNV。A:Ⅰ组;B:Ⅱ组;C:Ⅲ组
2.2 角膜透明度及新生血管评分 随术后时间延长角膜透明度评分逐渐升高(Ⅰ组:χ2=55.614,P=0.000;Ⅱ组:χ2=22.360,P=0.000;Ⅲ 组:χ2=16.376,P=0.006)。术后 3 d、7 d、3 个月,Ⅰ组和Ⅲ组角膜透明度评分差异有统计学意义(均为 P<0.05,见表1)。术后7 dⅠ组和Ⅱ组角膜透明度评分差异有统计学意义(P<0.05,见表2);其余时间点各组间角膜透明度评分差异均无统计学意义(均为P>0.05)。
术后3 d、7 d、15 d,各组 CNV评分随时间延长逐渐升高,至术后15 d达最高,后逐渐降低(Ⅰ组:χ2=56.789,P=0.001;Ⅱ组:χ2=20.652,P=0.001;Ⅲ组:χ2=21.541,P=0.000)。术后 3 d、7 d、15 d,Ⅰ组和Ⅲ组 CNV评分差异均有统计学意义(均为 P<0.05,见表1);术后7 d,Ⅰ组和 Ⅱ 组CNV评分差异有统计学意义(P<0.05,见表2);其余时间点各组比较差异均无统计学意义(均为P >0.05)。
2.3 组织学观察结果 术后3 d,Ⅰ组、Ⅱ组角膜中央上皮大部分缺损,周边上皮向中央生长,均匀红染的胶原物质覆盖表面,基质水肿,炎性细胞在植片与切口交界处明显(图3A1);Ⅲ组角膜上皮局部缺损,浅基质水肿明显,成纤维细胞略有增加(图3A2)。术后7 d,Ⅰ组、Ⅱ组角膜表面单层上皮细胞局部覆盖,基质层内可见逐渐降解的胶原物质;Ⅲ组成纤维细胞数量增加较明显。术后15 d,Ⅰ组浅基质有较多的成纤维细胞,沉积的胶原纤维排列仍不规则(图3B1);Ⅱ组成纤维细胞较少,胶原纤维排列不规则;Ⅲ组上皮完整,基质胶原纤维排列基本规则,成纤维细胞数量有所减少(图3B2)。术后1个月,Ⅰ组、Ⅱ组角膜上皮均覆盖完全,浅基质层胶原纤维排列趋于规则,但仍较正常基质紊乱(图3C1);Ⅲ组胶原纤维排列趋于一致,局部欠规则(图3C2)。术后3个月,Ⅰ组、Ⅱ组上皮修复良好,胶原纤维排列局部欠均匀;Ⅲ组胶原纤维排列局部欠规则。至术后6个月,Ⅰ组、Ⅱ组胶原纤维排列规则,部分区域存在小的胶原紊乱区(图3D1、D2);Ⅲ组细胞层次清楚,基质胶原排列规则(图3D3)。

表1 术后各时间点Ⅰ组、Ⅲ组角膜透明度及新生血管评分Table 1 Scores of corneal transparency and CNV in groupⅠand groupⅢ at each postoperative time point(Score)
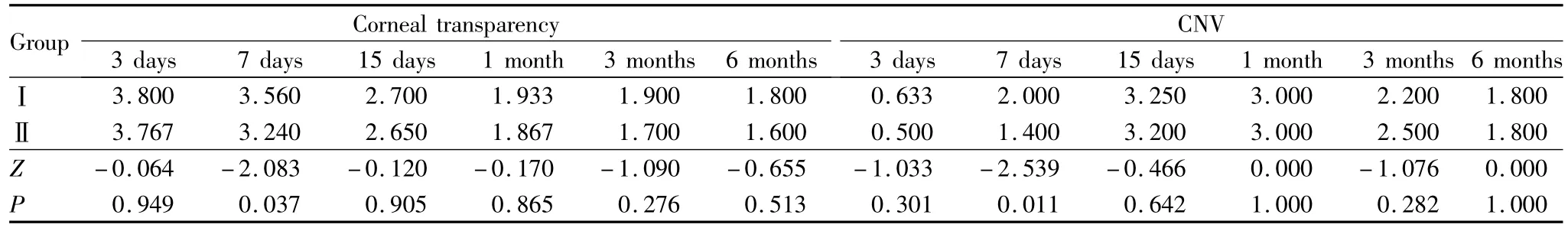
表2 术后各时间点Ⅰ组、Ⅱ组角膜透明度及新生血管评分Table 2 Scores of corneal transparency and CNV in groupⅠand group II at each postoperative time point(Score)

Figure 3 HE staining of corneal tissue after corneal transplantation(×400).A1,B1:3 days in groupⅠ and group Ⅲ;B1,B3:15 days in groupⅠand groupⅢ;C1,C2:1 month in groupⅠand groupⅢ;D1,D2,D3:6 months in groupⅠ,groupⅡ and groupⅢ 角膜移植术后角膜组织 HE染色(×400)。A1、A2:术后 3 d,Ⅰ组、Ⅲ组角膜组织;B1、B2:术后 15 d,Ⅰ组、Ⅲ组角膜组织;C1、C2:术后 1 个月,Ⅰ组、Ⅲ组角膜组织;D1、D2、D3:术后6个月,Ⅰ组、Ⅱ组、Ⅲ组角膜组织
2.4 免疫组织化学检查
2.4.1 K3检测 术后6个月,Ⅰ组、Ⅱ组和Ⅲ组角膜上皮细胞特异性标志蛋白K3检测均为阳性表达(图4)。
2.4.2 VEGF检测 术后 15 d,三组在切口处和1/3浅基质处炎性细胞胞浆VEGF表达呈阳性,附近炎性细胞明显,Ⅰ组、Ⅱ组可见少量CNV(图5)。术后6个月,三组1/3浅基质处炎性细胞均明显减少,VEGF染色阳性,Ⅲ组与Ⅰ组、Ⅱ组比较VEGF表达减少(图5)。
3 讨论
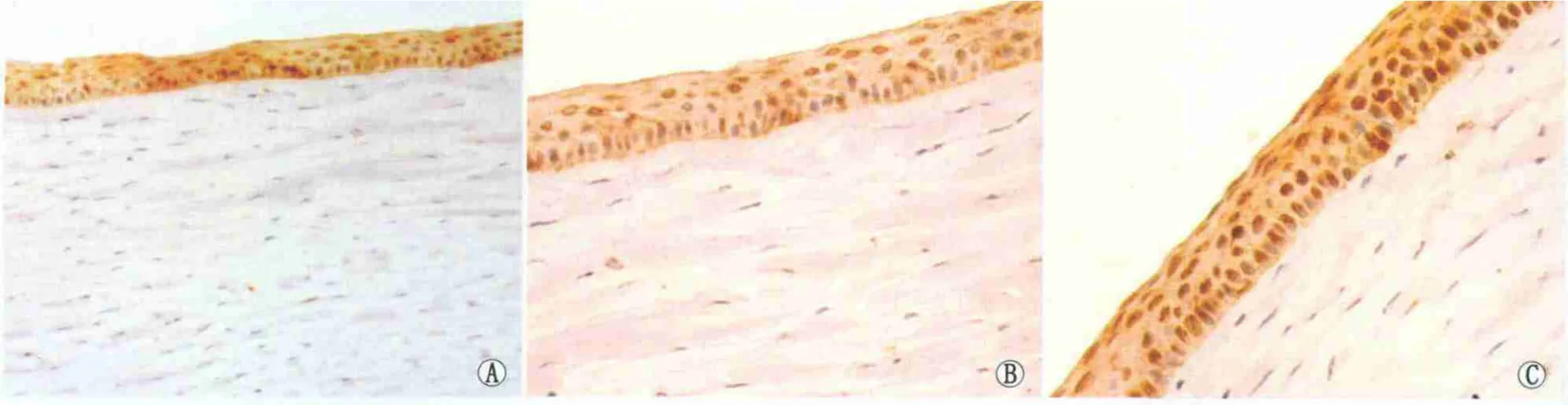
Figure 4 Expression of K3 at 6 months after corneal transplantation(DAB,×400).A:GroupⅠ;B:GroupⅡ;C:GroupⅢ 角膜移植术后6个月,角膜组织K3表达(DAB,×400)。A:Ⅰ组;B:Ⅱ组;C:Ⅲ组

Figure 5 Expression of VEGF in corneal matrix after corneal transplantation(DAB,×400).A1,A2,A3:15 days in group Ⅰ,group Ⅱ and groupⅢ;B1,B2,B3:6 months in groupⅠ,groupⅡ and groupⅢ 角膜移植术后角膜组织角膜组织VEGF表达(DAB,×400)。A1、A2、A3:术后15 d,Ⅰ组、Ⅱ组、Ⅲ组兔角膜基质VEGF表达;B1、B2、B3:术后6个月,Ⅰ组、Ⅱ组、Ⅲ组兔角膜基质VEGF表达
随着近年来组织工程技术的发展,羊膜、脱细胞角膜基质、纤维蛋白、胶原等生物组织常被应用于人工角膜的研究。胶原以其免疫原性低、易获得、无化学材料降解产生酸性降解产物等优点越来越受到科研工作者的重视,但胶原的力学强度差。本实验通过交联剂EDC和NHC对去端肽猪皮Ⅰ型胶原进行交联后,并通过特殊的上覆缝合法进行固定从而避免其缺点[10],结果表明,该材料与白兔剩余角膜基质床贴附良好。
本实验中,随术后时间延长,三组角膜透明度评分逐渐升高,术后3 d、7 d、3个月,Ⅰ组、Ⅲ组之间差异均有统计学意义(均为 P<0.05);术后7 d,Ⅰ组和Ⅱ组评分差异有统计学意义(P<0.05)。分析原因可能与手术的机械性刺激有关,但主要还是与角膜受到机械性损伤后自身修复过程有关。早期炎性细胞特别是中性粒细胞聚集到损伤区域,随后炎性细胞、角膜细胞合成或激活基质金属蛋白酶(matrix metalloproteinases,MMP),并释放到泪膜中,在整个病理过程中发挥主要作用。角膜基质对创伤的反应主要依赖于角膜细胞的作用,创伤附近健康的角膜细胞增殖、移行至创伤区,并分化为成纤维细胞,合成并分泌胶原、硫酸软骨素、蛋白多糖等细胞外基质成分(extracellular matrix,ECM)。开始时基质是混浊的,主要是由于新合成的ECM结构高度紊乱,本实验病理结果也证明新合成的角膜基质结构紊乱。随着时间的推移,在活化 MMP,尤其是成纤维细胞分泌的MMP作用下,胶原重塑,混浊逐渐消退。但是,MMP浓度过高易导致角膜溃疡穿孔,过低就会引起角膜瘢痕化[11-12]。
三组CNV评分在术后3 d、7 d、15 d随时间延长逐渐升高,至术后15 d达最高,后逐渐降低。羊膜、脱细胞角膜基质等天然角膜支架材料的主要成分胶原可能会造成一部分抗原成分的残留,本实验应用的是去端肽猪皮Ⅰ型胶原,作为一种异体材料,虽然已将其末端含有免疫原位点的非螺旋部分去掉,降低了其免疫原性,但不排除部分存在,实验组新生血管相对密集并且持续时间长可能与此相关[13]。Burns等[14]提出:在新生血管形成因子中 VEGF起着核心作用,角膜损伤后伤口处碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)表达增强[15-16],bFGF作为角膜组织的正常生理成分,在正常角膜组织全层中都有分布,正常状态下主要以无活性或低活性形态存在于细胞间质中,体外实验表明,0.1~1.0 ng·mL-1bFGF 可明显地刺激 FGF、内皮细胞等增殖,同时其又是一种趋化因子,对晶状体纤维细胞、内皮细胞、FGF和星形胶质细胞均有趋化作用[15,17],三组 CNV 评分均逐渐增高,达高峰后逐渐下降。步建平等[18]研究发现,大鼠穿透性角膜移植术后bFGF表达持续升高至伤后3周,随后表达水平开始下降,而新生血管的表达与bFGF呈正相关,CNV的消退与创伤修复后bFGF水平下降以及实验动物对异体抗原产生的免疫耐受相关[19]。另外,因材料的力学强度未完全达到活体角膜的要求,采用上覆缝合法对角膜的愈合、CNV的发生和发展也存在一定的影响。随着1个月后手术缝线的拆除及炎症反应的降低,新生血管逐渐变细并且退化,提示胶原基复合角膜替代材料具有较好的生物相容性。
本研究中组织病理检查结果显示:Ⅰ组、Ⅱ组由术后3 d起,角膜中央上皮层大部分缺损,基质层水肿,炎性细胞浸润逐渐修复,浅层基质胶原纤维排列紊乱;至术后1个月角膜上皮覆盖完全,浅基质层胶原纤维排列趋于规则;虽然在术后6个月部分区域存在小的胶原紊乱区,但与Ⅲ组相比未见明显异常。并且Ⅰ组、Ⅱ组术后6个月角膜上皮细胞K3免疫组织化学染色均为阳性,说明角膜上皮细胞增生修复,上皮重建,表明胶原材料可介导细胞黏附、增殖。但Ⅰ组、Ⅱ组的VEGF染色结果未见明显差异,表明材料2对新生血管的抑制效应不明显,可能由于内皮抑制素在体内的释放与体外有差异。
胶原基复合角膜替代材料是一种拥有良好光学性能与一定力学强度的角膜移植材料,并且在兔角膜组织内能支持角膜上皮的生长,促进活性角膜基质的改建,但距离活体角膜的力学强度还有较大差距,其负载的内皮抑制素的体内释放对新生血管的抑制作用还不明显。下一步我们将继续提高角膜材料体内移植的稳定性,加强其机械强度,降低材料的免疫性,改进内皮抑制素的负载方式和体内释放。胶原基含糖半互穿网络角膜替代物具有较好的体内外生物相容性,进一步改进后有望成为一种新型的角膜移植支架材料。
1 Chalam KV,Chokshi A,Agarwal S,Edward DP.Complications of AlphaCor keratoprosthesis:a clinicopathologic report[J].Cornea,2007,26(10):1258-1260.
2 Stolz AP,Kwitko S,Dal Pizzol MM,Marinho D,Rymer S.Experience with Dohlman-Doane keratoprosthesis:case reports[J].Arq Bras Oftalmol,2008,71(2):257-261.
3 Chew HF,Ayres BD,Hammersmith KM,Rapuano CJ,Laibson PR,Myers JS,et al.Boston keratoprosthesis outcomes and complications[J].Cornea,2009,28(9):989-996.
4 黄一飞,王大江,王丽强,张晗,马骁.人工角膜在治疗严重化学烧伤眼中的研究[J].中华眼科杂志,2007,43(4):297-302.
5 Thompson RJ,Price MO ,Bowers PJ,Price FW Jr.Long-term graft survival after penetrating keratoplasty[J].Ophthalmology,2003,110(7):1396-1402.
6 刘晓霞,陈建苏,丁勇,黎明庆.角膜脱细胞基质的特性研究[J].广东医学,2005,26(11):1463-1464.
7 Leonard DW,Meek KM.Refractive indices of the collagen fibrils and extrafibrillar material of the corneal stroma[J].Biophys J,1997,72(3):1382-1387.
8 杨朝忠,柳林.现代角膜移植学[M].北京:人民军医出版社,1998:167-170.
9 王林妮,戎慧丰,颜华,梁爽,王鹏飞,刘文广.兔眼角膜去端肽猪皮Ⅰ型胶原膜移植的研究[J].中华眼科杂志,2011,47(5):451-456.
10 Fagerholm P,Lagali NS,Merrett K,Jackson WB,Munger R,Liu Y,et al.A biosynthetic alternative to human donor tissue for inducing corneal regeneration:24-month follow-up of a phase 1 clinical study[J].Sci Trans Med,2010,2(46):46ra61.
11 Smith VA,Hoh HB,Littleton M,Easty DL.Over-expression of a gelatinase A activity in keratoconus[J].Eye(Lond),1995,9(Pt 4):429-433.
12 Sivak JM,Fini ME.MMPs in the eye:emerging roles for matrix metalloproteinases in ocular physiology[J].Prog Retin Eye Res,2002,21(1):1-14.
13 张姝江,张美霞,杨志明,罗静聪,李秀群,孟丹.两种生物衍生材料修复兔角膜浅层缺损的初步实验研究[J].中国修复重建外科杂志,2006,20(4):463-466.
14 Burns PA,Wilson DJ.Angiogenesis mediated by metabolites is dependent on vascular endothelial growth factor(VEGF)[J].Angiogenesis,2003,6(1):73-77.
15 Andresen JL,Ehlers N.Chemotaxis of human keratocytes is increased by platelet-derived growth factor-BB,epidermal growth factor,transforming growth factor-alpha,acidic fibroblast growth factor,insulin-like growth factor-I,and transforming growth factor-beta[J].Curr Eye Res,1998,17(1):79-87.
16 Faktorovich EG,Badawi DY,Maloney RK,Ariyasu RG.Growth factor expression in corneal wound healing after excimer laser keratectomy[J].Cornea,1999,18(5):580-588.
17 Wilson SE,Lloyd SA,He YG.Fibroblast growth factor-1 receptor messenger RNA expression in corneal cells[J].Cornea,1993,12(3):249-254.
18 步建平,周善璧,程琳.PEDF对大鼠穿透性角膜移植片VEGF影响的实验研究[J].重庆医科大学学报,2009,34(2):152-156.
19 张悦,张适,陈小平,胡世兴.汉防己甲素滴眼液防治大鼠角膜移植排斥反应的实验研究[J].眼科学报,2006,22(3):202-206.

