脉络膜上腔视觉假体刺激参数的选择△
梁婷 范明 马兰茗 隋晓红
脉络膜上腔跨视网膜电刺激是近年来提出的一种新型的视网膜视觉假体,相比之前的两种视网膜视觉假体(视网膜上视觉假体和视网膜下视觉假体)来讲,该假体具有很多优势,如:避免了电极与视网膜直接接触带来的损伤,电极容易在体内长期固定等等。在过去的几年中,该领域内的研究证明了这种新兴假体的可行性[1-4],有关假体的刺激参数的研究还相对较少[5]。由于刺激参数直接决定了假体的安全性和有效性,因此我们对实际应用中所涉及的各种刺激参数进行了系统研究(脉冲宽度、刺激频率以及脉冲波形),获得的实验结果一方面可以用来指导假体刺激器的设计,另一方面可以辅助实际应用中选择安全有效的电刺激方案。
1 材料与方法
1.1 实验动物 健康成年白兔15只,体质量2.0~2.5 kg(上海交通大学激光与光子医学生物研究所提供)。所有操作过程符合眼及视力研究协会的实验动物使用规定。
1.2 刺激电极 实验采用的薄膜电极(图1)由中国科学院上海微系统与信息技术研究所提供,刺激点的材料为铂金。
1.3 手术过程 白兔耳缘静脉注射30 g·L-1异戊巴比妥钠1 mL·kg-1诱导动物麻醉,将动物固定于手术台上。每0.5 h静脉给予30 g·L-1异戊巴比妥钠0.3 mL维持麻醉状态。美多丽散瞳剂(复方托吡卡胺滴眼液)滴眼,散大双眼瞳孔。手术显微镜下开睑器撑开眼睑,环形剪开下方球结膜,分离并剪断下直肌。角巩膜缘后10 mm与角巩膜缘平行切开巩膜3 mm,暴露脉络膜。将薄膜电极轻柔地顺着巩膜切口植入脉络膜上腔,刺激点部位到达眼球后极部,视盘正下方。5-0线将薄膜电极固定于巩膜上。常规眼底检查,确定电极植入位置,检查是否有脉络膜脱离及出血等并发症。

Figure 1 Photograph of electrode array.The 3 ×4 electrode array consisted of platinum monopolar planar electrodes of 50 μm,150 μm,350 μm,and 500 μm diameter mounted on a 30 μm thick polyimide strip 聚酰亚胺薄膜电极。薄膜电极带有3×4的12电极阵列,包含有直径50 μm、150 μm、350 μm、500 μm 的四种尺寸的刺激点
1.4 皮层信号的记录 切开头部皮肤,分离皮下组织,暴露颅骨。根据白兔视网膜与视皮层的投射对应关系,于植入眼的对侧视皮层相应的区域内(距垂直中线约 4 mm、Bregma点后 11 mm,大小约 5.00 mm×5.00 mm)记录电刺激诱发的响应。该区域内钻3×3(9)个孔,将不锈钢螺钉拧入孔中,末端与硬脑膜接触,作为记录电极。在植入眼同侧的视皮层相应位置(Bregma点前6 mm、中线旁4 mm处),钻入不锈钢螺钉作为参考电极。不锈钢针插入兔耳皮下作为地电极。采用多通道电生理记录系统(System 3,Tucker-Davis Technologies,Alachua,FL,USA),带通频率为3~500 Hz,记录到的结果为50个皮层反应叠加后的平均结果。
1.5 刺激阈值的测定 实验中采用电荷平衡的双相脉冲进行电刺激,脉冲宽度分别为0.25 ms、0.50 ms、0.75 ms、1.00 ms、刺激频率为 1 Hz、2 Hz、4 Hz。首先给以阈下刺激,逐步增加刺激强度,直到一个稳定、确切的皮层响应电诱发电位(electrical evoked potential,EEP)出现,我们将这个最小的电流强度确定为阈电流。阈电流乘以脉冲脉宽,则得到阈电荷。将阈电荷除以刺激电极的面积,则得到相应的阈电荷密度。
1.6 统计学分析 同一动物体内获得的结果,采用配对t检验进行比较;不同的动物体内获得的结果采用方差分析进行比较(ANOVA)。所有的统计学分析采用SPSS 13.0软件完成。P<0.05为差异有统计学意义。
2 结果
实验中采用直径为50 μm的刺激点进行电刺激,刺激频率为1 Hz,脉冲宽度分别为 0.25 ms和1.00 ms时,诱发EEP所需的阈电荷密度分别为1.0 mC·cm-2和 2.1 mC·cm-2,电极表面发生了明显的腐蚀,其他尺寸的电极未发生损坏。
2.1 皮层的响应 皮层记录到的EEP波形和视觉诱发的反应(visual voked potential,VEP)的波形相类似,但潜伏期存在着显著的差异。VEP的潜伏期为(24.7±2.2)ms(n=5),EEP 的潜伏期为(13.1±1.9)ms(n=5),明显短于VEP的潜伏期(P<0.05;图2)。
2.2 刺激频率对于EEP幅度的影响 刺激强度不变,随着刺激频率的增加,EEP的幅度逐渐下降。我们将1 Hz时EEP的幅度作为1,其他频率下获得的EEP的幅度与其相比求得相对的幅度。结果显示:1 Hz时EEP幅度为 1.00±0.00;2 Hz时幅度降低到为0.61±0.03;4 Hz时幅度为 0.36±0.07;当刺激频率达到6 Hz时,EEP幅度降低为1 Hz时的12%,为0.12±0.06。并且随着刺激频率的增加,EEP的潜伏期也随之延长。从1 Hz时的(14.4±2.8)ms增加到6 Hz的(17.72±1.1)ms。当刺激频率增加到8 Hz时,没有记录到EEP。
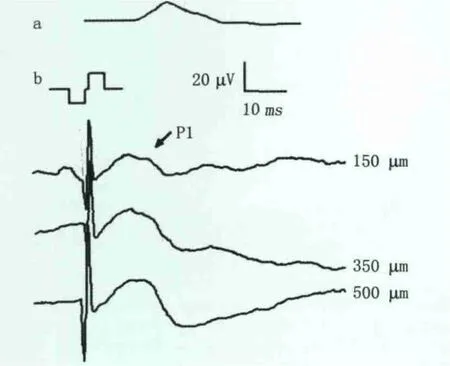
Figure 2 Waveform of VEP(a)and EEP(b)recorded at visual cortex.VEP:The flash power of the photic stimulator was 90 mJ with frequency of 1 Hz;EEP:Stimulus current was a biphasic current pulse with anodic-or cathodic-first stimulation at the pulse durations(stimulus amplitude was 200 μA,pulse duration was 0.5 ms and stimulus frequency was 1 Hz) 在兔的视皮层记录到的VEP(a)和EEP(b)的波形。VEP:刺激的能量为90 mJ,频率为1 Hz;EEP:刺激波形为先负后正的电荷平衡的双相脉冲,幅度200 μA、脉冲宽度0.5 ms,刺激频率 1 Hz
2.3 不同的刺激频率下电极尺寸对阈电流强度的影响 无论在哪一刺激频率下,500 μm电极和350 μm电极诱发皮层响应所需的阈电流大小之间无明显差异(P>0.05,图3)。在低频脉冲刺激下(1 Hz)小电极(150 μm)诱发EEP所需的电流强度比大电极(350 μm、500 μm)低(P<0.05,图 3);随着刺激频率的增加,诱发EEP所需的阈电流强度也随之增加,当刺激频率为2 Hz时,三种尺寸的电极之间的阈电流无明显差异(P>0.05)。当刺激频率增加为4 Hz时,尽管三者所需的阈电流之间差异依然无统计学意义(P>0.05),但此时150 μm电极所需的阈电流要略高于大电极(500 μm、350 μm)所需的阈电流(图3)。
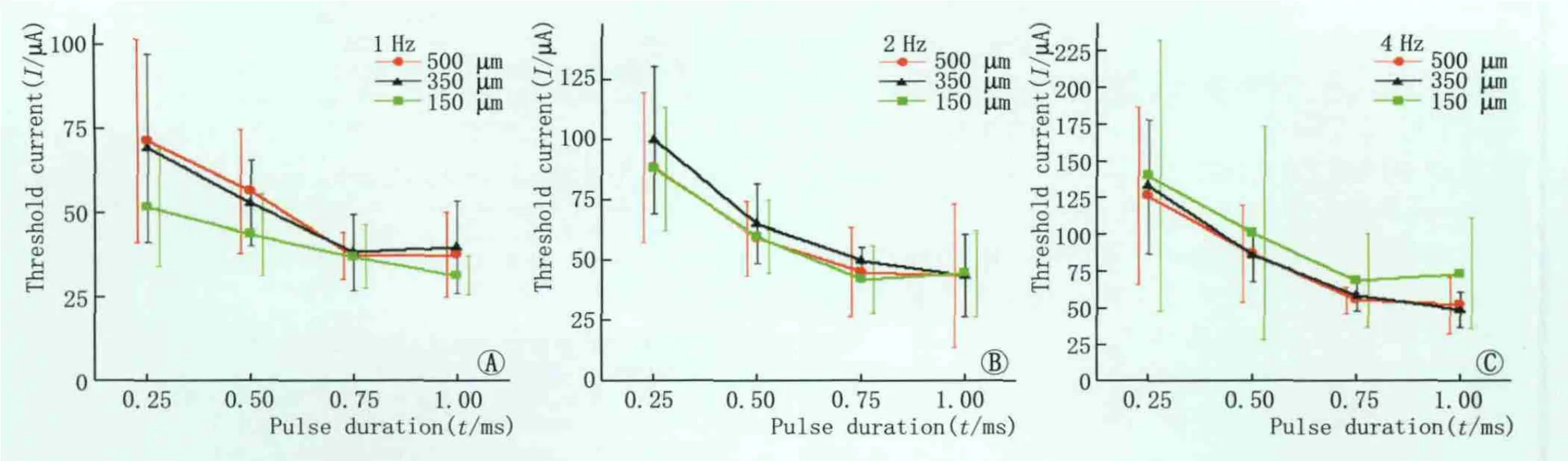
Figure 3 Effects of electrode size on threshold current 电极尺寸对阈电流强度的影响
2.4 电极尺寸、脉冲宽度和刺激频率共同对于阈电流的影响 整体上诱发皮层响应所需的阈电流均随着脉冲宽度的增加而减小,随着刺激频率的增加而增加(图3)。无论采用哪种尺寸的电极进行刺激,在4 Hz下获得的阈电流的大小总是高于1 Hz时所需的阈电流(P<0.05),这种增加的比率在短脉冲宽度(0.25 ms)刺激时为77%(500 μm 电极)和170%(150 μm 电极);在长脉冲宽度(1.0 ms)刺激时,增加的比率较低,约为38%(500 μm电极)和131%(150 μm 电极)。
2.5 刺激波形对于阈电流的影响 采用先负后正及先正后负两种刺激脉冲进行电刺激,先负后正的刺激脉冲诱发EEP所需的阈电流总是低于先正后负的刺激脉冲所需的阈电流(P<0.05,图4)。
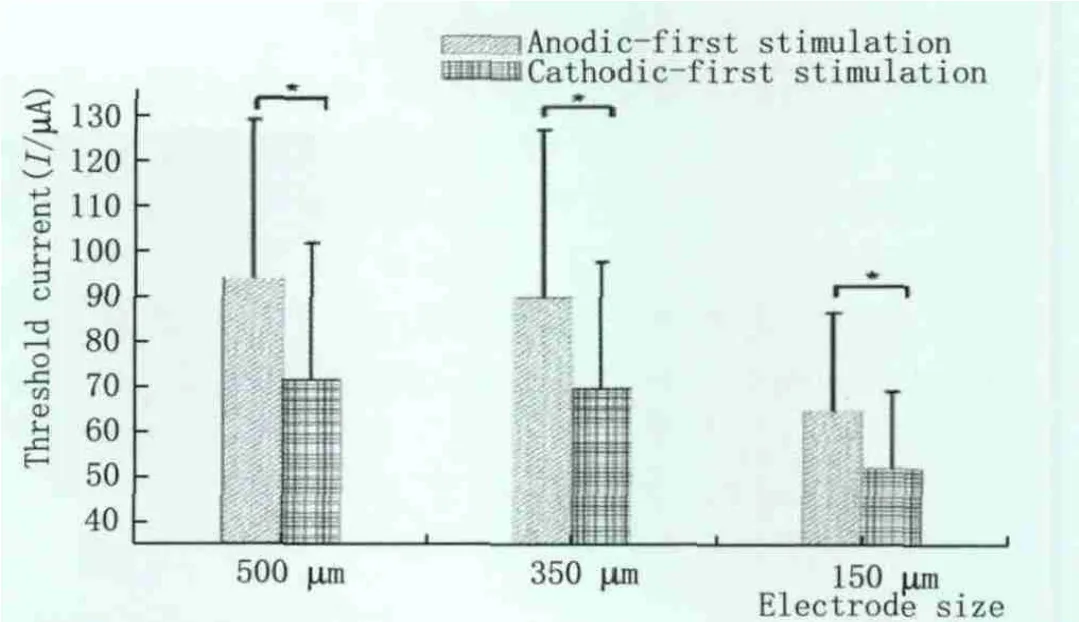
Figure 4 Effects of stimulus waveforms on threshold current(*statistical differences).Pulse duration was 0.25 ms and stimulus frequency was 1 Hz 刺激波形对于阈电流的影响(*表示差异有统计学意义)。脉冲跨度为0.25 ms,刺激频率为1 Hz
3 讨论
3.1 与其他实验结果的比较 本实验诱发EEP所需的阈值与其他研究小组获得的结果相接近[4]。Sakaguchi等[3]使用直径 100 μm 的电极、0.5 ms 的脉冲宽度在脉络膜上腔对视网膜进行电刺激时,所需的阈电流大小为66 μA。而我们研究中采用的直径150 μm电极、0.5 ms的脉冲宽度进行刺激时,阈电流大小为50.8 μA,两者非常接近。对于电极尺寸与阈电流之间的关系,我们获得的结果并未如期待的那样:大电极需要的阈值高,小电极需要的阈值低。研究发现500 μm和350 μm电极诱发 EEP所需的阈电流强度没有明显的差异,这可能是电极与视网膜神经元之间的距离导致的。有研究表明在视网膜表面进行电刺激时,大电极诱发视网膜神经节细胞兴奋所需的阈值高,小电极所需的阈值低。随着电极不断的远离视网膜表面,大电极与小电极之间的差异消失[6]。同时在 Chowdhury 等[7]和 de Balthasar等[8]的研究中也发现了类似的现象,当电极距离视网膜一定位置时,电极尺寸与阈电流的大小无关。在我们的研究中,电极植入的位置位于脉络膜上腔,电极与视网膜之间也存在着一定的距离,可能是这一距离消除了500 μm电极和350 μm电极之间的差异。
3.2 电极尺寸的选择 实验中采用直径为50 μm的电极进行刺激时,诱发EEP相应的阈电荷密度,显然高于铂电极所能承受的最大电荷密度0.35 mC·cm-2,因此电极发生了损坏[9-10]。这可能与电极过小有关,由于过小的电极诱发神经元活动的数量较少,为了获得一个可观察到的皮层反应,势必需要增大刺激强度。此外,由于电极植入的位置相对于视网膜上和视网膜下电极来说,距离视网膜内神经元位置相对较远,加之视网膜色素上皮层附加的阻抗较高[11],因此诱发 EEP 所需的刺激阈值较高[12]。由此可见对于STS视觉假体来说,使用过小尺寸的电极是不安全的。目前人们正在使用各种电化学技术对电极的表面进行加工修饰,使其光滑的表面变得粗糙,增加电极实际的使用面积,从而降低电荷密度,达到避免电极和组织损伤的目的[13-15]。
3.3 刺激参数最优组合 研究中发现,高频刺激时小电极(150 μm)比大电极(500 μm)需要更大的刺激强度,并且当刺激频率达到一定高度时,加大刺激强度也未能引出皮层的响应,这可能是由于反复地电刺激导致神经元兴奋性下降的结果,尤其是小电极更为明显。与此同时,大电极伴随长脉冲宽度刺激时,刺激强度随着刺激频率增加的幅度最小,此时也可能对神经元兴奋性的影响最小。因此大电极伴以长脉冲宽度可能是未来STS视觉假体实际应用中优先选择的刺激方案。此外由于先负后正的刺激脉冲所需的阈电流较低,因此这也将成为未来优先选择的刺激波形。
本实验采用脉络膜上腔跨视网膜电刺激的方式,对电刺激中各种参数进行了系统地研究,尽管研究结果揭示了刺激参数的优化的组合方式,但是具体参数的选择将会产生怎样的视觉感觉依然不十分清楚,这就需要我们进一步了解这种电刺激潜在的神经机制,因为只有真正地认识这种人工装置才能更好地为盲人提供完美的视觉。
1 Kanda H,Morimoto T,Fujikado T,Tano Y,Fukuda Y,Sawai H.Electrophysiological studies of the feasibility of suprachoroidal-transretinal stimulation for artificial vision in normal and RCS rats[J].Invest Ophthalmol Vis Sci,2004,45(2):560-566.
2 Zhou JA,Woo SJ,Park SI,Kim ET,Seo JM,Chung H,et al.A suprachoroidal electrical retinal stimulator design for long-term animal experiments and in vivo assessment of its feasibility and biocompatibility in rabbits[J].J Biomed Biotechnol,2008,2008:547428.
3 Sakaguchi H,Fujikado T,Fang X,Kanda H,Osanai M,Nakauchi K,et al.Transretinal electrical stimulation with a suprachoroidal sultichannel electrode in rabbit eyes[J].Jpn J Ophthalmol,2004,48(3):256-261.
4 Nakauchi K,Fujikado T,Kanda H,Morimoto T,Choi JS,Ikuno Y,et al.Transretinal electrical stimulation by an intrascleral multichannel electrode array in rabbit eyes[J].G raefes Arch Clin Exp Ophthalmol,2005,243(2):169-174.
5 Wong YT,Chen SC,Seo JM,Morley JW,Lovell NH,Suaning GJ.Focal activation of the feline retina via a suprachoroidal electrode array[J].Vision Res,2009,49(8):825-833.
6 Jensen RJ,Ziv OR,Rizzo III JF.Thresholds for activation of rabbit retinal ganglion cells with relatively large,extracellular microelectrodes[J].Invest Ophthalmol Vis Sci,2005,46(4):1486-1496.
7 Chowdhury V,Morley JW,Coroneo MT.Development of an extraocular retinal prosthesis:Evaluation of stimulation parameters in the cat[J].J Clin Neurosci,2008,15(8):900-906.
8 de Balthasar C,Patel S,Roy A,Freda R,Greenwald S,Horsager A,et al.Factors affecting perceptual thresholds in epiretinal prostheses[J].Invest Ophthalmol Vis Sci,2008,49(6):2303-2314.
9 Rose TL,Robblee LS.Electrical stimulation with pt electrodes.VIII.Electrochemically safe charge injection limits with 0.2 ms pulses[J].IEEE Trans Biomed Eng,1990,37(11):1118-1120.
10 Weiland JD,Liu W,Humayun MS.Retinal prosthesis[J].Annu Rev Biomed Eng,2005,7(3):361-401.
11 Shah S,Hines A,Zhou D,Greenberg RJ,Humayun MS,Weiland JD.Electrical properties of retinal-electrode interface[J].J Neural Eng,2007,4(1):S24-S29.
12 Yamauchi Y,Franco LM,Jackson DJ,Naber JF,Ziv RO,Rizzo JF,et al.Comparison of electrically evoked cortical potential thresholds generated with subretinal or suprachoroidal placement of a microelectrode array in the rabbit[J].J Neural Eng,2005,2(1):S48-S56.
13 Norlin A,Pan J,Leygraf C.Investigation of interfacial capacitance of Pt,Ti,and TiN coated electrodes by electrochemical impedance spectroscopy[J].Biomol Eng,2002,19(2):67-71.
14 Tykocinski M,Duan Y,Tabor B,Cowan RS.Chronic electrical stimulation of the auditory nerve using high surface area(HiQ)platinum electrodes[J].Hear Res,2001,159(1):53-68.
15 Huang CQ,Shepherd RK.Reduction in excitability of the auditory nerve following electrical stimulation at high stimulus rates:V.Effects of electrode surface area[J].Hear Res,2000,146(1):57-71.

