失重对大鼠髁突软骨细胞中TNF-αmRNA表达的影响*
金波涛,于绍冰,郑卫卫,于 洁,曹 岩
失重环境能引起机体血液动力学的改变,从而使心血管系统和咀嚼肌、骨骼肌发生一系列适应性变化。近年来,有关失重状态下,咀嚼肌的变化逐渐得到学者的关注,由此是否可以引起对颞颌关节病(temporomandibular disorders,TMD)国内外鲜有报道。为了进一步探讨失重环境与TMD的关系,本研究拟采用尾部悬吊模拟失重大鼠模型,应用组织形态学方法,观察失重不同时期对颞下颌关节(temporomandibular joint,TMJ)内相关炎性因子TNF-α的表达,以探讨其在颞下颌关节病发病机制中的作用。
1 材料和方法
1.1 实验动物分组和方法 SD大鼠,一级,60只,体重(150±10)g,雄性,由山东大学动物中心提供。大鼠在实验室适应性饲养1周后,随机分为4组,分别为悬吊1、3、5周及对照组,每组15只。悬吊组进行尾部悬吊[1];对照组不做任何处理。动物实验严格按照有关实验室动物饲养及使用规则实施。各组大鼠在同一条件下以国家标准啮齿类动物常规饲料单笼喂养,大鼠饲养笼具、饮水瓶定期消毒,使用垫料均经高压灭菌。称量大鼠体重1次/5 d,自由进水饮食,室温维持在(21±2)℃,相对湿度45% ~55%,动物饲养房实行12 h光照与12 h黑暗交替循环。
1.2 软骨细胞的分离 直视下切取髁突软骨层,放入盛有无钙平衡盐液(D-Hanks液)的平皿中,眼科剪尽量剪碎,移入离心管内10倍量胰蛋白酶37℃振荡,消化30 min,0.2%胶原酶II 37℃振荡下消化2 h,10 ml混合培养基(含20%胎牛血清,青霉素100 U/ml,链霉素100 U/ml,抗坏血酸50 U/ml)培养于37℃,5%CO2培养箱内,48 h后首次换液,以后隔天换液。透明软骨细胞长成单层后,进行传代,弃去培养液,磷酸盐缓冲液(PBS)冲洗2遍,0.5%胰蛋白酶约10 ml消化5 min,DMEM混合培养基反复吹打成单细胞悬液,消化传代至平底24孔培养板,每孔种植细胞数约5×10G个。
1.3 TNF-α含量测定 用ELISA法定量测定大鼠髁突软骨细胞培养物上清TNF-α含量,严格按Promage公司试剂盒使用说明书操作。
1.4 总RNA提取 PBS0.01%mol/L,冲洗离心后加Catrimox-14AM等量简单地粉碎细胞,GeneQuaant-pro-RNA/DNA定量RNA最后溶于RNA缓冲液中,吸取5 μl RNA样品在20 μl反应体系中进行反转录反应,反应条件:水浴5 min,37℃水浴5 min,37℃水浴60 min及 70 min 加热 10 min,PCR 反应体系为 50 μl,扩增条件为:变性94℃ 30 s,复性50℃ 40 s,延伸72℃ 40 s,循环35次,凝胶成像分析系统观察摄片。
1.5 髁突软骨细胞分离纯化 按常规方法以髁突软骨细胞分离液分离静脉血髁突软骨细胞PBMC采用异硫氰酸胍一步法,严格按Promage公司试剂盒使用说明书操作。cDNA合成:0.5%焦碳酸二乙酯(DEPC)水处理过的微量离心管中,依次进行。RT-PCR参数:TNF-α循环参数:94℃预变性3 min;变性94℃1 min,退火58℃115 min,延伸72℃2 min,循环30次;最后延伸2 min。引物设计如下:
TNF-α上游(5’-3’):AGG CGC TCC CCA AAA AGA TG;下游(5’-3’):TGG CGG AGA GGA GGC TGA CT。
β-actin上游(5’-3’):CTA TCG GCA ATG AGC GGT TC;下游(5’-3’):CTT AGG AGT TGG GGG TGG CT。
2 结果
TNF-αmRNA在悬吊1周表达最强,以后逐渐达到正常水平;悬吊1周组细胞因子mRNA升高最显著,较悬吊3、5周2组有所下降并接近对照组。对照组变化不大,但与各悬吊组相比较明显降低。见表1。
表1 各时点两组TNF-αmRNA水平(n=15,±s)
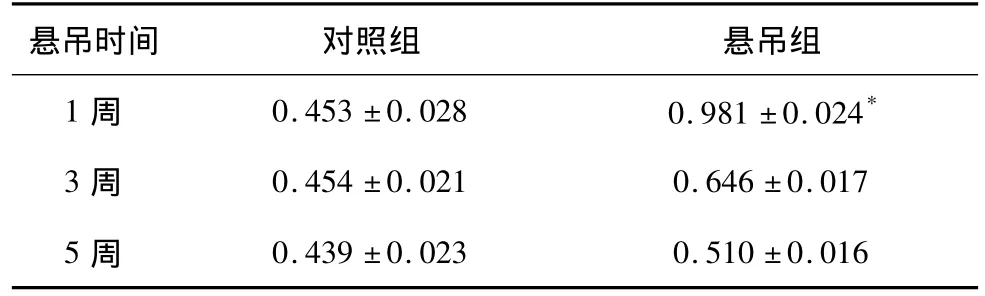
表1 各时点两组TNF-αmRNA水平(n=15,±s)
注:与对照组比较*P<0.05
悬吊时间 对照组 悬吊组1 周 0.453 ±0.028 0.981 ±0.024*0.439 ±0.023 0.510 ±0.016 3 周 0.454 ±0.021 0.646 ±0.017 5周
3 讨论
微重力或模拟失重环境会导致肌肉的结构、功能及电生理学特性发生一系列的变化,如肌肉趋于缩性改变[2]、收缩功能下降[1]、超微结构及生化特性的改变等[3],但这些变化的分子机制尚不清楚。那么,与咬肌密切相关颞下颌关节是否会因为咬肌功能的变化而变化呢?从本文结果可以看出,这种模拟失重环境能够引起颞下颌关节内炎性因子发生变化。
目前,TMD的确切病因和发病机制尚不明了,有研究发现颞下颌关节紊乱症患者的关节局部组织产生大量细胞因子TNF-α等,然而这些细胞因子对关节软骨细胞增殖、代谢和凋亡的作用机制和影响途径迄今尚无定论[4]。TNF-α由单核吞噬细胞和其它类型细胞产生并作用于这些细胞来调节黏附分子、免疫球蛋Fc受体、一氧化氮合成和金属蛋白酶产生及其它细胞因子分泌,同时促进结缔组织和内皮细胞激活。其主要功能是致炎作用,并能直接或间接地介导骨组织吸收。已经有证据表明TNF-α在软骨细胞的降解-退变过程中起到最重要的分解作用。本文结果说明悬吊1、3、5周时,TMJ髁突软骨有严重的炎性反应,而随着时间增加,炎性反应会渐渐减轻,这可能因为笔者的研究采取了单一的失重模式,大鼠渐渐适应了这种方式的原因。
细胞因子是低分子量蛋白质,是炎症和免疫过程起始因子和效应器,其中TNF-β起重要作用。T细胞经抗原刺激后表达IL-1受体,在IL-1作用下被活化,从而分泌 IL-2、IFN、GM -CSF、IL-4等细胞因子,增加T细胞表面MHC2类抗原的表达,诱导细胞毒性T淋巴细胞的分化,诱导单核/巨噬细胞产生TNF,并通过单核细胞和巨噬细胞产生IL-8介导对中性粒细胞的趋化作用,加速血纤维蛋白原、C反应蛋白等的合成[5]。TNF-活化单核/巨噬细胞,提高其杀伤活性,释放超氧、促进NO、IL-2等细胞因子的产生,促进中性粒细胞、淋巴细胞和单核细胞粘附到内皮细胞上,从而参与炎症反应[6]。
[1]ZB,Zhang LF,Jin JP.A proteolytic NHZ -terminal truncation of cardiac troponin I that is up - regulated in simulated microgravity[J].J Biol Chem,2001,276(19):15753 -15760.
[2]List T,Wahlund K,Larsson B.Psychosocial functioning and dental factors in adolescents with temporomandibular disorders:a casecontrol study[J].J Orofac Pain,2001,15(3):218 -227.
[3]Zhang L,Wang YY,Yu ZB.Depressed responsiveness of cardiomyocytes to isoproterenol in simulated weightlessness rats[J].Acta Physiol Sin,2007,59(6):845 -850.
[4] Convertino VA.Status of cardiovascular issues related to space flight:Implications for future research directions[J].Respir Physio1 Neurobiol,2009,169(Suppl 1):s34 - s37.
[5]Dalekos GN,Elisaf M,Bairaktarl E,et al.Increased serum levels of interleuk in-1 in the systemic circulation of patients with essential hyperten sive patients[J].J Lab Clin Med,1997,129(3):300-305.
[6]Futrakul N,Buthep P,Patumarys,et al.Enhanced tumor necrosis factor in the serum and renal hyperfusion in nephrosis associated with focal segment glomerlo-sclerosis[J].Ren Fail,2002,22(2):213-215.

