产壳聚糖酶菌株的筛选及初步鉴定
王建兴 赵琼洲 冯会家
(湖北水环境监测中心黄石分中心,湖北 黄石 435000)
甲壳素,又称几丁质、甲壳质、聚乙酰氨基葡萄糖等,通过β-D-(1,4)-糖苷键连接而成的线性聚合物,广泛存在于甲壳纲动物、软体动物、昆虫、真菌以及高等植物中,自然界每年生成的甲壳素将近100亿吨,是地球上含量仅次于纤维素的天然高分子化合物、数量最大的含氮有机化合物。
甲壳素脱乙酰化后的产物是壳聚糖。一般而言,N-乙酰基脱去55%以上,或者说能在1%乙酸或1%盐酸中溶解1%的脱乙酰甲壳素,称之为壳聚糖。作为工业品的壳聚糖,N-脱乙酰度在70%以上。壳聚糖一方面来自甲壳素,另一方面在自然界中也大量存在,是迄今为止发现的唯一的天然碱性多糖。壳聚糖呈白色或灰白色,平均分子量在1.2×105左右,不溶于水、碱性溶液或普通有机溶剂,但可溶于盐酸、硝酸、甲酸、乙酸等稀酸。
不同分子量的壳聚糖的性质各异,分子量低于10kDa的水溶性壳聚糖,具有降血糖、降血脂、抗真菌、抗细菌以及抑制肿瘤生长等功效,在医药、食品等领域具有潜在的发展前景。目前制备低分子量壳聚糖的方法,主要有化学法和酶解法。其中,酶解法以条件温和、产率高、污染小等优点,成为研究的热点。壳聚糖酶(Chitosanase)是一种专一性降解壳聚糖的水解酶,能特异性作用于壳聚糖的β-D-(1,4)-糖苷键,得到聚合度低至2~7的水溶性壳寡糖。
甲壳素广泛分布于湖泊中,也是湖水中化学耗氧量的重要来源。筛选、驯化产壳聚糖酶菌株,经过培养后,附着在生物骨料中投入水体中,可以提高水体净化能力。
近年来,国内外研究人员从自然界中分离到Beauveria bassiana,Pseudomonas sp.,Mitsuaria chitosanitabida,Bacillus sp.等产壳聚糖酶菌株,并对其分类学、发酵工艺以及酶学性质,展开了一系列研究。本文筛选得到7株产壳聚糖酶菌株,并对其中的5株菌,进行了初步鉴定。
1 材料与方法
1.1 主要材料、试剂及培养基
壳聚糖胶体溶液:1g壳聚糖, 加入30mL 0.2mol/L的 HCl,75℃水浴15h~20h至完全溶解,用 1mol/L的NaOH缓慢调pH5.0,加蒸馏水定容,配成一定浓度的溶液。
富集培养液:2%的胶体壳聚糖溶液,加入0.2%的K2HPO4,121℃、灭菌30min。
壳聚糖固体培养基:
甲液:1%壳聚糖胶体溶液;
乙液:K2HPO40.4%,KH2PO40.2%,MgSO40.14%,NaCl 0.1%,CaCl20.02%,酵母粉 0.1%,琼脂 4%,pH7.0;
壳聚糖固体培养基:甲、乙液分别于121℃条件下灭菌30分钟后,等体积混合倒平板。
1.2 取样
分别从山上、菜地、池塘污泥、垃圾堆附近等地采集了7份土壤样品和1份来自青山湖的水样,样品取回后置4℃冰箱冷藏。
本报讯 日前,财政部、农业农村部、中国银保监会共同印发《关于开展三大粮食作物完全成本保险和收入保险试点工作的通知》,推动保障水平在目前种子、化肥等物化成本和地租成本的基础上,进一步增加劳动力成本至覆盖全部农业生产成本或直接开展收入保险,切实促进农业保险转型升级,保障农户种粮积极性。试点保险标的为关系国计民生和粮食安全的水稻、小麦、玉米三大主粮作物。
1.3 富集培养
取适量土壤样品,用无菌水稀释成悬浊液,取0.5mL(水样直接取)加至10mL富集培养液中,28℃培养3d~5d。
1.4 初筛
采用梯度稀释法,在壳聚糖平板上均匀涂布10-3、10-4、10-5稀释的培养液,置28℃恒温箱中培养,不时观察菌落生长情况,3d后,取生长良好且能产生透明圈的单菌落,接至壳聚糖斜面培养基上培养,保藏。
同时,将挑选出的各菌株用无菌牙签点接种至壳聚糖固体平板上,每个平板接3株或4株菌,三组平行,培养3d后,取出平板,置4℃冰箱中冷藏1d。测量各菌株的菌落直径(d)和透明圈直径(D),计算D/d,并求其平均值,以d值和D/d值为指标,挑选降解壳聚糖能力强的菌株。
1.5 菌株的形态和生理生化特征研究
1.5.1 形态特征鉴定
将产壳聚糖酶菌株接种于壳聚糖平板上,置于30℃恒温箱培养。培养24h后,挑取单菌落进行革兰氏染色,用显微镜测微尺测定大小;培养72h后,观察菌落形态。
1.5.2 氧化发酵试验(O-F test)
休和利夫森二氏培养基:蛋白胨 2g、NaCl5g、K2HPO40.2g、葡萄糖10.0g、琼脂 3.0g、1%溴里百酚蓝(溴麝香草酚蓝)溶液 3mL(先用少量95%酒精溶解后,再加水配成1%的水溶液)、蒸馏水 1000mL,pH7.0,分装于试管中,培养基高度约4mm~5mm,121℃灭菌、20min;博德和霍尔二氏培养基:NH4H2PO40.5g、K2HPO40.5g、酵母膏 0.5g、葡萄糖10.0g、琼脂 3.0g、1%溴百里酚蓝溶液 3mL、 蒸馏水 1000mL,pH7.0, 同上分装,灭菌。进行穿刺接种培养,每株菌做两组平行。每组包括4支:E1:不接种、不加石蜡密封;E2:不接种、石蜡密封;E3:接种、不加石蜡密封;E4:接种,石蜡密封(石蜡事先灭菌,添加高度为1mm左右)。30℃恒温培养,1、3、5、7 d 后,与 E1、E2对照,观察试管培养基颜色变化。 对用于本试验的菌株,如果E3、E4管颜色均变黄,说明该菌株为氧化型(O),如果仅 E4颜色变黄,说明为发酵型(F)。
1.5.3 脲酶试验
培养基:蛋白胨 1g,葡萄糖 1g,NaCl 5g,KH2PO42g,0.2%酚磺酞指示液6mL,20%尿素溶液100mL,琼脂20g,水900mL。除尿素外,将上述成分混合,调 pH 值为 6.8~6.9,加热溶化后分装于试管中,115℃灭菌、30min,冷却至50℃~55℃,加入经过滤除菌的尿素溶液,摆斜面。划线培养,于30℃恒温培养,2、4d天后,观察结果,菌体周围培养基颜色呈桃红色者为阳性,不变者为阴性(以不加尿素的培养基作对照)。
1.5.4 吐温 80 水解试验
蛋白胨 10g,NaCl 5g,CaCl2·7H2O 0.1g,琼脂 9g,蒸馏水 1000mL,pH7.4,121℃灭菌20min。 吐温60于121℃灭菌20min后,培养基冷却至45℃左右时,加入至终浓度为1%,倒平板。划线接种,培养7d,每天观察结果。
1.5.5 耐 pH 值试验
LB培养基:胰蛋白胨 1%,酵母粉 0.5%,NaCl 0.5%,调节培养基的 pH 值,分别为 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,30℃,摇床培养 3天,观察生长情况,确定耐生长pH值。
2 结果与分析
2.1 富集培养
培养5d后,除水样外,其它培养液变混浊,有菌体产生,个别有絮状沉淀。
2.2 平板分离
通过以壳聚糖为唯一碳源的平板筛选分离,挑出7株产透明圈的菌株,并对其编号,点接种比较d值D/d值,结果如表1示。
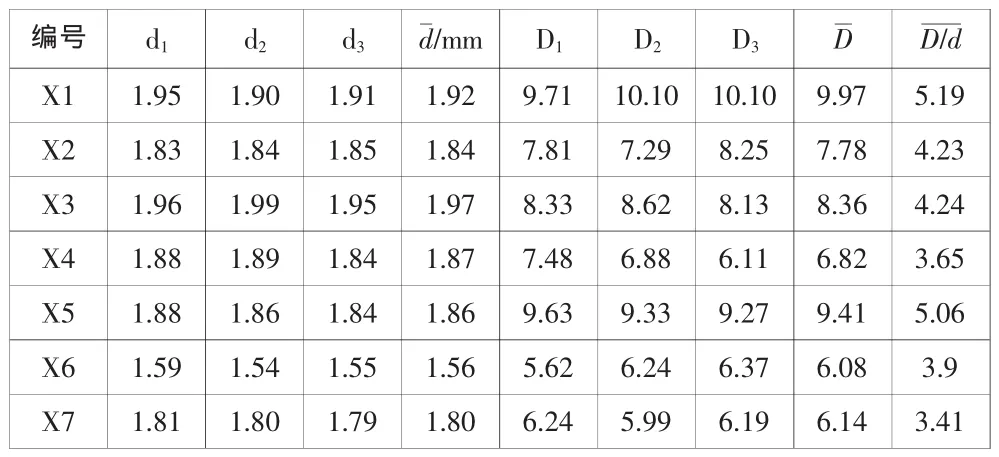
表1 菌株筛选结果
由表1初步认为,X1菌株降解能力最强,其次为X5,其它菌株降解能力相对较弱。
2.3 菌株形态与生理生化特征
从中挑选出X1、X2、X3、X5、X6共5株菌,对进行形态与生理生化特征鉴定。结果均为G-、杆状、不产芽孢;在壳聚糖平板上,菌落呈白色、圆形、隆起,表面光滑、湿润、边缘平整,周围有透明圈,其它形态特征和生理生化特征见表2。

表2 生理生化鉴定结果
根据以上结果将其归为氧化型革兰氏阴性菌,具体的分类地位有等进一步鉴定。
3 讨论
自然环境中的微生物是一个非常混杂的群体,从中分离到具有某种特性的微生物具有很大的随机性,是否能取得成功在很大程度上依赖于快速、高通量的筛选方法和简便、可靠的检测手段。为此,我们设计了一套有效的筛选方案和技术路线。
取样方面,因为壳聚糖广泛存在于水生甲壳类动物、软体动物和节肢动物的外壳中,所以我们主要集中在池塘及其周边自然环境中取样。样品通过以壳聚糖为唯一碳源和氮源的培养基进行富集培养,限制其它微生物的生长,使菌群中的特定微生物生长繁殖,这样目标菌株在富集培养液占据绝对优势。富集培养后,梯度稀释涂平板,筛选能利用壳聚糖的微生物。其依据的原理是:壳聚糖平板呈白色不透明状,能利用壳聚糖的微生物必然会分解壳聚糖成小分子,菌落周围形成透明圈,其产酶活性越高,降解壳聚糖的能力越强,透明圈相对大小就越大,该方法易于观察,效果明显。通过初步筛选,最终得到了7株产壳聚糖酶的菌株。
产壳聚糖酶的微生物种类繁多,在国内外文献上报道的有曲霉、假单胞菌、青霉菌、球孢白僵菌以及Mitsuaria chitosanitabida等。为此,我们对其中的5株菌进行了初步鉴定,要得到更可靠的结果,还将进一步通过生理生化特征和其它手段进行鉴定。
[1]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002:187-190.
[2]蒋挺大.壳聚糖[M].北京:化学工业出版社,2001.
[3]王艳,周培根,俞剑燊,等.产壳聚糖酶菌株选育及培养条件优化[J].中国海洋大学学报,2005,35(2):293-296.
[4]方祥年,杜昱光,黄秀梨,等.球孢白僵菌高产壳聚糖酶突变株的筛选[J].微生物学通报,2001,28(3):60-64.
[5]李风平,何潇,鲍春平.壳聚糖酶产生菌的筛选及其酶解产物的初步研究[J].山东大学学报,2003,38(1):96-99.
[6]逄玉娟,韩宝芹,刘万顺,杨菊林.高产壳聚糖酶菌株的筛选和发酵产酶条件研究[J].中国海洋大学学报,2005,35(2):287-292.
[7]王钦宏,蔡静平.壳聚糖酶生产菌的筛选、鉴定及产酶培养条件研究[J].工业微生物,2000,30(4):32-36.
[8]蔡俊,杜予民.生物法制备壳聚糖的研究进展[J].现代食品科技,2005,21(1):163-166.
[9]PARK JK,SHIMONO K,OCHIAI N.Purification,characterization,and gene analysis of a chitosanase(ChoA)from Matsuebacter chitosanotabidus 3001[J].J.Bacteriol.,1999,181(21):6642-6649.
[10]AMAKATA D,MATSUO Y,SHIMONO K,et al..Mitsuaria chitosanotabidus gen.nov.,sp.nov.,an aerobic,chitosanase-producing member of the‘Betaproteobacteria’[J].Int J Syst Evol Microbiol,2005,55(5):1927-1932.
[11]Mitsumori M,Ajisaka N,Tajima K,et al..Detection of Proteobacteria from the rumen by PCR using methanotroph-specific primers[J].Letters in Applied Microbiolog,2002,35(3):251-255.

