蚊虫两种靶标抗性机制的研究进展*
赵明惠 李春晓 赵彤言**
(1. 安徽医科大学,合肥 230032;2.军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071)
蚊虫是重要的媒介昆虫之一,是传播多种疾病的重要媒介,包括登革热、疟疾、丝虫病、流行性乙型脑炎、西尼罗病毒病等(马淮健等,2000;崔峰和乔传令,2007;吴治明等,2013;朱小娟等,2013),由于其特殊的生理行为而与人类的生产生活密切相关。目前对于蚊虫的综合防治措施仍以化学防治为主,有机磷和氨基甲酸酯类杀虫剂自上个世纪中叶被开发合成以来,由于其具有合成简单、杀虫谱广等优点,而被广泛的应用于蚊虫的防治中。80年代初,拟除虫菊酯类杀虫剂因为具有高效、低毒和对环境友好等特点也被人们大量的使用。但是由于这些杀虫剂的长期、大量应用,已经导致蚊虫抗药性的持续发生(徐菲等,1999;王士珍等,2000;曾林海等,2008;张家林等,2008;李士根等,2010)。不仅抗性蚊虫种类在逐年增多,而且抗性倍数也在不断增加,并出现多重抗性现象,蚊虫抗性的产生和抗性的加强成为蚊虫防治中的突出问题。
对蚊虫抗性的研究已经逐步从生理生化水平发展到分子水平,例如蚊虫的靶标抗性就是其对化学杀虫剂抗性的分子机制之一。靶标是杀虫剂对蚊虫产生致死效应的靶部位,如有机磷和氨基甲酸酯类抑制乙酰胆碱酯酶(AChE),DDT和拟除虫菊酯抑制钠离子通道,环戊二烯类抑制γ-氨基丁酸受体及保幼激素受体等。各类杀虫剂通过以上多种途径对蚊虫产生毒性或致死效应(胡小邦和朱昌亮,2004;亢春雨等,2007)。靶标抗性是指由于杀虫剂作用靶标敏感度降低而产生的抗药性,从而降低杀虫剂的毒性效应,进而起不到杀虫效果。由于靶标抗性的产生可导致昆虫对一类杀虫剂甚至对同时有交叉抗性的另一类杀虫剂也产生抗药性,从而严重制约了杀虫剂的持续使用,因此靶标抗性在抗药性机理的研究中也就显得更为重要。在对蚊虫的靶标抗性机制研究中,钠离子通道和乙酰胆碱酯酶靶标抗性的研究最为深入,本文将从分子水平对这两种靶标抗性的作用机制研究进展进行简单的介绍。
1 钠离子通道
1.1 钠离子通道的结构
钠通道由3个亚基组成,包括一个主要的α亚基和两个较小的β辅助亚基。α亚基形成离子的渗透洞孔,两个β亚基在调节通道功能中起着关键的作用。钠通道α亚基蛋白由1 800~2 500个氨基酸组成,它们的共同结构的特征如图1所示,含4个大的同源结构域(Ⅰ~Ⅳ),每个结构域有6个疏水性跨膜螺旋体(S1~S6),以及一个S5~S6之间的保守序列元件,后者形成离子孔道。肽链的N端和C端都在膜的细胞质一侧。N端位于结构域Ⅰ的前面,由110个氨基酸组成。C端位于结构域Ⅳ的后面,由315个氨基酸组成。糖基化位点位于结构域Ⅰ和Ⅲ的膜外部分(唐振华等,2004)。
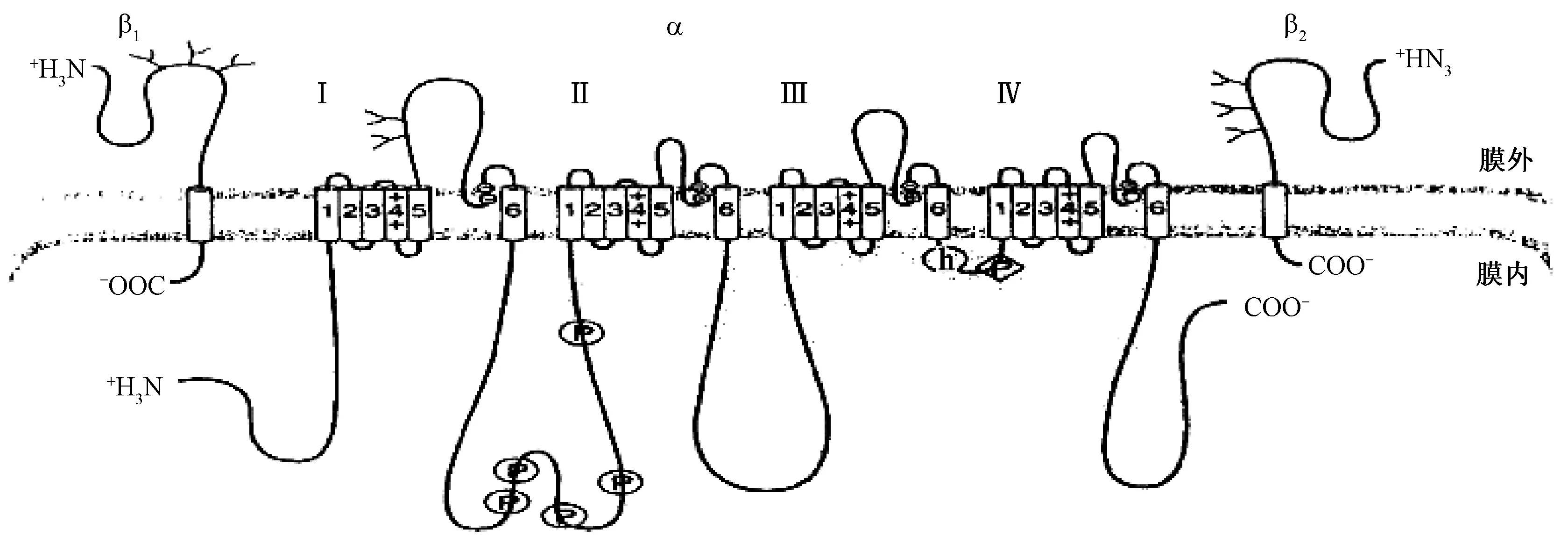
图1 钠离子通道结构示意图Fig. 1 Schematic diagram of the sodium channel (from Hille et al., 1999)
钠通道蛋白如同钾通道和钙通道一样,存在许多的通道蛋白亚型。对哺乳动物钠通道蛋白的研究表明不同的蛋白亚型具有不同的生理功能和药理学特性(Goldin,2001)。研究表明哺乳动物中钠通道蛋白多样性是不同基因选择性表达的结果。然而对昆虫钠通道的研究表明,Pre-mRNA的选择性剪接是产生昆虫钠离子通道蛋白多样性的主要原因,选择性剪接所产生的不同钠通道蛋白亚型也受时间和空间的影响(Thackerayetal.,1995)。迄今为止,昆虫钠通道基因的选择性剪接已在多种果蝇和蚊虫中发现,包括黑尾果蝇Drosophilamelanogaster(Loughneyetal.,1989)、家蝇Muscadomestica(Leeetal.,2002)、尖音库蚊Culexpipiens(Martinez-Torresetal.,1999)、致倦库蚊Cx.quinquefasciatus(Heetal.,2012)等。
1.2 钠离子通道与蚊虫抗性的关系
钠离子通道是拟除虫菊酯类杀虫剂的作用靶标,此类杀虫剂通过控制钠通道的失活而使昆虫出现兴奋状态或中毒症状。昆虫通过钠通道基因的突变对该类杀虫剂产生抗性,称为击倒抗性(kdr,knockdown resistance)。击倒抗性最初是在对DDT具有抗性的意大利品系家蝇中首次被描述(Busvine,1951),Milani(1956)将该抗性表型命名为击倒抗性,在此之后发现在包括多种蚊虫在内的昆虫中也发现了这样的突变。钠离子通道功能位点的突变使其蛋白质的性质发生巨大的变化,对拟除虫菊酯类杀虫剂的敏感性降低。对家蝇的Vssc1钠通道定向突变进行研究,使其含有L1014F突变,然后与果蝇tipE蛋白在爪蟾卵母细胞中表达,成为“Vssc1/tipE”通道,并用2个电极的电压钳进行测定含有L1014F突变的Vssc1/tipE通道和不含L1014F突变的野生型通道对各种拟除虫菊酯的敏感性和尾电流衰退速率,结果表明突变导致其对生物苄呋菊酯的敏感性降低了10倍,并且导致尾电流加速衰退(Smithetal.,1997)。此外,对黑腹果蝇,德国小蠊和烟蚜夜蛾的研究也表明,含有L1014F突变的钠通道的对不同类型的拟除虫菊酯的敏感性都会明显地下降。并且在大多数情况下会伴随加速尾电流衰退的速率(Vaisetal., 2000;Zhaoetal., 2000;Tanetal., 2002a)。
1.3 蚊虫钠离子通道与抗性相关的基因突变
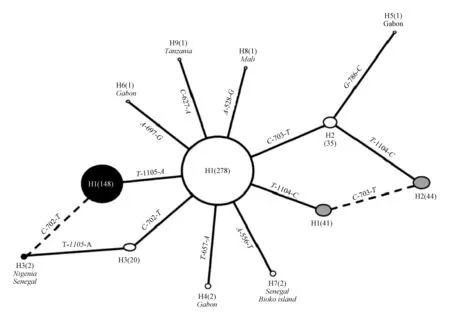
图2 冈比亚按蚊kdr基因型的系统进化关系Fig. 2 TCS network showing the genealogical relations among kdr haplotypes of Ae. gambiae(from Pinto et al.,2007)
与拟除虫菊酯抗性有关的钠通道氨基酸序列多态性突变有很多报道。研究发现,蚊虫钠通道ⅡS6节段L1014位点是一个较保守的突变位点,经典突变类型L1014F(TTA-TTT)普遍见于冈比亚按蚊(Martinez-Torresetal.,1998)、淡色库蚊(Songetal.,2007)、致倦库蚊(Xuetal.,2011)等蚊虫。这些突变的出现,使得蚊虫对杀虫剂的敏感性降低,进而产生对其的抗药性。在蚊科昆虫中也相继发现了几个出现在这一位点的双突变,如冈比亚按蚊、斯氏按蚊、萨氏按蚊、尖音库蚊和淡色库蚊的L1014F(TTA-TTT)和L1014S(TTA-TCA)双突变(Martinez-Torresetal.,1999; Luleyapetal.,2002;Etangetal.,2006;Chenetal.,2010;Singhetal.,2011; Wangetal.,2012),致倦库蚊的L1014F(TTA-TTT)和(TTA-TTC)的碱基双突变(Wondjietal.,2008),中华按蚊的L1014F(TTG-TTT)和L1014C(TTG-TGT)双突变与高效氯氰菊酯抗性密切相关(Kimetal.,2007;Tanetal.,2012)。此外,在其他位点也发现许多突变与抗性密切相关,例如,埃及伊蚊的I1011M和V1016G突变(Brenguesetal.,2003)及同一位点的I1011V和V1016I突变与长时间的接触氯菊酯有关(Saavedra-Rodriguezetal.,2007)、V1016G和D1763Y双突变(Changetal.,2009)、V1016G和S989P双突变与溴氰菊酯的抗性有关(Srisawatetal.,2010)、F1269C突变与90%的丙烯除虫菊酯关系密切(Kawadaetal.,2009);白纹伊蚊的F1534C突变与氯菊酯抗性有关(Kasaietal.,2011);库态按蚊的V1010L和L1014S双突变(Singhetal.,2010);冈比亚按蚊的N1575Y突变补偿了L1014F突变对DDT和氯菊酯抗性的适合度代价(Jonesetal.,2012);中华按蚊的N1013S 和L1014W突变(Tanetal.,2012b)等都与杀虫剂的使用密切相关。对某一蚊虫而言,既可能是某一位点的单突变,也可能是双突变或联合突变。不同种类的蚊虫钠通道基因突变的类型不完全相同,即在一定程度上具有种的特异性。对一些重要媒介蚊虫需要有针对性的研究,以揭示其特定的突变类型。
目前,与抗性相关的钠离子通道基因突变在世界各地多个国家的多种蚊虫中都有发现,包括拉丁美洲的埃及伊蚊(Saavedra-Rodriguezetal.,2007),非洲的冈比亚按蚊(Jonesetal.,2012),朝鲜的中华按蚊(Kimetal.,2007),新加坡的白纹伊蚊(Kasaietal.,2011),湄公河流域的的迷走按蚊,中华按蚊和带足按蚊(Verhaeghenetal.,2010),泰国、墨西哥和巴西的埃及伊蚊(Brenguesetal.,2003;Garciaetal.,2009;Srisawatetal.,2010),印度的库态按蚊(Singhetal.,2010),肯尼亚的冈比亚按蚊,阿拉伯按蚊和催命按蚊(Kawadaetal.,2011),以及我国的淡色库蚊、中华按蚊(Tanetal.,2012a;Wangetal.,2012)等蚊虫。这些抗性突变的产生与拟除虫菊酯类杀虫剂的使用密切相关,在今后的卫生城市创建中,要注意这类杀虫剂的使用,加强抗性监测。
1.4 蚊虫钠离子通道基因突变的进化
对非洲15个国家的冈比亚按蚊kdr基因的研究表明,钠离子通道基因突变至少经历了4次独立的变化(图2)(Pintoetal.,2007)。前两次是比较明确的单核苷酸变异导致的基因突变,包括H1-1014F和H1-1014S,它们分别是通过T1105A和T11O4C两个核苷酸突变形成的;后两次变异则认识的相对模糊,只是一些假设认为这两次变异(H2-1014S和H3-1014F)分别来自携带kdr基因突变的前体,即H1-1014S和H1-1014F,在此基础上各自再经历了一次突变而形成的。另有猜测表示后两次突变是来自突变型和野生型kdr基因的重组(Hudsonetal., 1985)。无论突变的来源是什么,这都与杀虫剂的选择压力和基因流密切相关。
2 乙酰胆碱酯酶
2.1 乙酰胆碱酯酶的晶体结构与功能位点
2.1.1乙酰胆碱酯酶的晶体结构: Sussman等(1991)首次报道了电鳐Torpedocalifornica的AChE催化亚基晶体X射线衍射图谱。实验结果显示,该催化亚基是由14个α螺旋与12个β折叠组成,α螺旋和β折叠在晶体中的含量分别为15%、30%。亚基大小为4.5 nm×6.0 nm×6.5 nm,呈椭球状,β折叠位于椭球状分子的中央,α螺旋将其包围。AChE的晶体形式是糖酯锚型的同源二聚体,在羧基端的半胱氨酸(Cys537)形成二硫键(施明安等,2000)。
2.1.2乙酰胆碱酯酶的功能位点:乙酰胆碱酯酶的主要功能位点有7个,分别是催化三联体,胆碱结合位点、酰基口袋、养阴离子洞、外围阴离子位点,芳香族氨基酸谷内表面以及后门,它们在催化底物反应过程中分别起着不同的作用。催化三联体包括Ser200、Glu327、His440三个氨基酸,位于谷内,称活性部位谷(Aactive site gorge),属于氢键型,使Ser200变得更为亲核,攻击乙酰胆碱的碳,导致形成乙酰化酶,并迅速去乙酰化。胆碱结合位包括Trp84、Tyr330、Tyr442和Glu199四个氨基酸,构成与底物的结合部位。酰基口袋包括Phe288、Phe290两个氨基酸,在谷内壁一侧,它们的侧链伸向活性中心,约束活性空问范围,从而限制较大的底物和环基进入活性中心。氧阴离子洞包括Gly118、G1y119和Ala201三个氨基酸,它们由主链氮原子与羰基氧相互作用,以及酯键的氧与His440的咪唑基相互作用共同构成。外围阴离子位点由Tyr70、Tyr71、Trp279和Asp72四个氨基酸组成,它们位于AChE分子外表面近谷的入口处,都带负电荷,有助于提高AChE的催化效力。芳香族氨基酸形成谷内表面,它们由14个疏水性的氨基酸残基组成,它们是5个Tyr:Tyr70、Tyr121、Tyr130、Tyr334、Tyr442;5个Trp:Trp80、Trpl14、Trp233、Trp279和Trp432和4个Phe:Phe288、Phe 290、Phe330和Phe331。它们占谷内表面氨基酸残基的40%。其主要功能足加速底物向活性中心扩散,把乙酰胆碱吸收到低亲和力位点,接着通过二维扩散至活性部位,使酶具有很高的催化活力。后门由Cys67、Cys95之间的“Q”噜噗组成,促使催化反应过程中形成有序地通道开放,后门的开放供产物释放(唐振华等,2002)。
2.2 乙酰胆碱酯酶与蚊虫抗性的关系
乙酰胆碱酯酶作为一种丝氨酸水解酶,通过催化神经系统中神经传递物质(乙酰胆碱)的水解而终止神经冲动。有机磷类和氨基甲酸酯类杀虫剂就是以乙酰胆碱酯酶为靶标,通过酶活性位点的丝氨酸羟基磷酸化和酰基化而不可逆地抑制酶的活性,使乙酰胆碱的分解受阻,导致在神经突触和高度兴奋的中枢神经体统中乙酰胆碱浓度的积聚,使突触后神经持续冲动,神经系统的敏感性降低,最终导致生物体的死亡。AChE基因的突变使乙酰胆碱酯酶的结构发生改变,改变活性中心的空间结构,从而导致AChE对有机磷农药和氨基甲酸盐类农药敏感性下降(Muteroetal.,1994;Zhuetal.,1996;Walshetal.,2001;Vontasetal.,2002)。Radic等(1992)以电鳐的AChE为模型,用天冬氨酸和谷氨酸胺替代AChE的谷氨酸199后发现AChE与胆碱酯酶抑制剂的亲和力降低了,并且该酶的磷酸化率和氨基甲酸酯化率降低。这一结果表明昆虫AChE谷氨酸199的突变将导致昆虫对有机磷和氨基甲酸酯类杀虫剂抗性的产生。Vaughan等(1997)以杆状病毒为载体,通过PCR定位诱变导入敏感cDNA,经过重组的杆状病毒含有野生突变型和7个突变的Ace cDNA位点(3个单基因突变:F105S,G285A,F350Y;3个双突变:F105S+G285A,F350Y+F1O5S,F35OY+G285A;一个三联突变: F105A+G285A+F350Y)。Sf21细胞在细胞指数生长的后期被重组的杆状病毒大量转染,并表达诱变的AChE,然后测量活性。研究结果表明,对于有机磷杀虫剂paraxon,有4种基因突变(F105S+G285A,G285A+F350Y,G285A和F105S+G285A+F350Y)与野生型AChE相比有相当高的IC50,其中低者(Fl05S+G285A)可提高15倍,而高者(G285A+F350Y)则可提高至120倍。而对于氨基甲酸酯杀虫剂卡巴呋喃来说,有3种基因突变在反应中轻度提高了IC50,其中Fl05S+F350Y提高了5倍,Fl05S+G285A+F35OY提高了8倍,G285A+F35OY提高了12倍。同样的突变也导致对另一种氨基甲酸酯杀虫剂残杀威IC50值的提高,如F105S+F350Y提高30倍,G285A+F350Y提高60倍,Fl05S+G285A+F350Y则可提高至80倍。突变型AChE与野生型AChE ki值之比显示出在不同的突变结构中AChE的不敏感性的水平,总的趋势是与抗性相关的突变位点越多,AChE残余活性越高,抗性比就越高,说明蚊对杀虫剂的不敏感性水平是由不同的结构基因突变造成的。以上证据表明基因突变导致的氨基酸替代可能影响酶活性部位的空间构象,这种变化也改变了杀虫剂对酶活性部位的抑制作用,从而产生抗性。所以,Ace基因突变是导致蚊对杀虫剂产生抗性的一个重要原因,不敏感的AChE是蚊虫对有机磷酸酯类和氨基甲酸酯类杀虫剂产生抗性的普遍机制(Fournieretal.,1994)。
2.3 蚊虫中发现的与抗性相关的乙酰胆碱酯酶基因突变
乙酰胆碱酯酶是有机磷和氨基甲酸酯类杀虫剂的作用靶标。在一些抗性品系蚊虫的乙酰胆碱酯酶分子中发现单氨基酸替换现象,这些突变使乙酰胆碱酯酶对杀虫剂不敏感程度上升,从而产生抗药性。蚊虫有2个AChE,即AChE1和AChE2,分别由ace-1和ace-2编码,研究显示只有ace-1与抗药性有关(Bourguetetal.,1996;王敦等,2006)。到目前为止,在蚊虫中只发现3个单氨基酸置换与抗性有关。包括G119S(GGC-AGC)突变、F331W(TTT-TGG)突变和F290V(TTT-GTT)突变。Weill等(2003)发现尖音库蚊和冈比亚按蚊中的G119S突变与有机磷和氨基甲酸酯类杀虫剂的抗性密切相关。Liu (2005)等发现致倦库蚊中存在的G119S突变与毒死蜱抗性有关。Nabeshima等(2004)在日本三带喙库蚊的Ace1基因中发现一个突变F455W,相当于在Torpedo中F331,并证明与高水平的有机磷抗性有关;Alout等(2007b)发现塞浦路斯尖音库蚊中存在的F290V突变与有机磷和氨基甲酸酯类杀虫剂密切相关。在对中国不同地区杂鳞库蚊的G119S突变和三带喙库蚊的F331W突变与有机磷和氨基甲酸酯类杀虫剂抗性进行研究时发现其相关性密切。
目前,在具有基因变异的乙酰胆碱酯酶在世界上许多国家的蚊虫中都有发现,包括法国的尖音库蚊和冈比亚按蚊(Weilletal. 2003),塞浦路斯,黎巴嫩和突尼斯的尖音库蚊(Aloutetal. 2007;Benetal. 2009;Ostaetal. 2012),贝宁和非洲西部的致倦库蚊(Chandreetal. 1997;Djogbénouetal. 2008),以及我国的杂鳞库蚊,三带喙库蚊和尖音库蚊(Cuietal. 2006;Aloutetal. 2007a)等。但是突变只发现在少数几种蚊虫中,这也许与乙酰胆碱酯酶基因突变产生的适合度代价较大有关系(Berticatetal. 2008;Djogbénouetal. 2010)。
2.4 蚊虫乙酰胆碱酯酶基因突变的进化
蚊虫乙酰胆碱酯酶基因的突变遵循“改善基因”的基本原则。在70年代最初使用有机磷类杀虫剂的时候,蚊虫通过基因的突变(G119S)来适应强大的杀虫剂选择压力,虽然这一突变事件在没有使用杀虫剂的区域对基因是有毒害作用的,但是其仍然在广泛的传播。之后这一基因型经历了两次独立的复制。第一次是敏感和抗性的ace基因之间通过复制而结合,在这一时期,抗性的ace基因并没有完全被替代,因为形成的纯合子由于尚不致死。第二次复制形成的杂合子毒害效应也不致命,所以也开始流传。乙酰胆碱酯酶基因抗性相关的突变是核苷酸突变,杀虫剂选择和基因重排的结果(Lynchetal.,2000;Labbeetal.,2007)。
综上所述,蚊虫在长期的化学杀虫剂的选择压力下,已从分子水平上进化出抵抗这种选择压的能力,因此对其抗药性分子机理的研究具有重要的理论及现实意义。随着分子生物学的发展,基因芯片技术的普及和后基因组时代的到来,人们对蚊虫抗性形成和进化的研究从分子水平展开了比较深入的研究,对抗性蚊虫的基因进行了分离、克隆和差异表达的鉴定,为进一步研究每种抗性机制的整条通路奠定了基础。系统回答蚊虫的抗性生理问题的分子机制是目前抗药性领域的研究趋势,这将使人们对于蚊虫抗性产生和发展的认识更加深刻,在实际生产生活中对杀虫剂的使用也起到重要的指导作用。

