家蝇抗菌肽defensin对人肝癌细胞HepG2的增殖、凋亡和周期的影响*
程璟侠 焦莉萍 赵瑞君 原发家 杜 斌 王文建
(1. 山西省疾病预防控制中心, 太原 030001; 2. 山西医科大学基础医学部,寄生虫教研室,太原 030001)
抗菌肽是昆虫体内重要的先天性免疫分子,研究表明抗菌肽具有良好的抗菌作用,免疫调节作用,抗寄生虫、抗肿瘤作用,抗菌肽在杀伤肿瘤细胞作用的同时对正常人体细胞影响较小(Casteelsetal.,1989),这是天然抗肿瘤药物的一个重要特点(许玉澄等,1998)。防御素(Defensin)是抗菌肽家族中最大的亚家族,从哺乳动物、昆虫、植物中分离出来并且充当自然免疫的效应分子,它是机体有效抵抗病原菌感染的第一步(Lietal., 2012) 起到调节机体免疫系统的作用。丘晓燕等(2003)从舍(家)蝇幼虫中提取的抗菌肽类物质能抑制人乳腺癌细胞MCF-7、人胃癌细胞BGC-823、MCC-803 和人肺癌细胞SPC-A-1等人源性肿瘤细胞的体外增殖生长。国内报道的用家蝇幼虫匀浆提取的混合物(万启惠等,2008;张庆华等,2007;Jinetal., 2010)和血淋巴直接冻干粉获得的杂合多肽(文彩虹等,2004)对SMMC-7721肝癌细胞、A375、K562等肿瘤细胞均有抑制作用,并且对正常细胞无毒性。本课题组利用分子生物学方法从家蝇幼虫体内提取抗菌肽defensin并研究其对人肝癌细胞HepG2肿瘤细胞的作用及对人正常心肌细胞H9C2的作用。结果证明家蝇幼虫抗菌肽defensin对肿瘤细胞有明显的杀伤作用,并发现该抗菌肽defensin对肝癌细胞HepG2细胞周期及细胞凋亡有一定的影响,为天然抗肿瘤药物的开发提供基础的理论数据。
1 材料与方法
1.1 实验材料
1.1.1细胞株:人肝癌细胞HepG2和人正常心肌细胞H9C2均为山西医科大学基础医学院生物化学教研室惠赠。
1.1.2家蝇抗菌肽defensin:防御素defensin从家蝇体内提取,并经过诱导、表达及纯化制备而成,经抑菌活性鉴定有杀菌效果。
1.1.3材料和试剂:AnnexinV-Fitc-PI 细胞凋亡检测试剂盒,细胞周期检测试剂盒,南京凯基生物科技发展有限公司;DMEM干粉,美国Gibco公司;RPMI 1640培养基,赛默飞世尔生物化学制品(北京)有限公司;胎牛血清,杭州四季青公司;四甲基偶氮噻唑蓝(MTT),美国Sigma公司。
1.1.4实验设备与仪器:流式细胞仪 FACS Calibur,B.D Corp,USA;自动板式酶标仪ZS-2,北京新风机械厂;倒置生物显微镜XDS-IB,重庆光电仪器有限公司。高速台式冷冻离心机TGL-16G,上海安亭科学仪器厂。立式压力蒸气灭菌器YXQ-LS-30S,上海博迅实业有限公司医疗设备厂;CO2培养箱,311,美国Thermo Forma公司。
1.2 方法
1.2.1细胞的培养及光镜观察法检测defensin抗肿瘤活性:将人肝癌细胞HepG2培养于含10%胎牛血清的1640培养液中,放于5%的CO2培养箱中。调整细胞浓度在l×105个/mL,将正常人心肌细胞H9C2培养于含10%胎牛血清的DMEM培养液中,其余培养方式同肿瘤细胞相同,调整细胞浓度在 2.5×105个/mL左右。设置对照组和实验组,实验组中用DMEM培养液与抗菌肽defensin混合配置,并将其加入含肝癌细胞HepG2的培养瓶中,对照组加不含血清的DMEM培养液。放置37℃,5%的CO2培养箱中,48 h后取出培养液在倒置光学显微镜 400 倍下观察细胞状态并拍照。
1.2.2MTT法测细胞增殖抑制率: 取对数生长活跃期细胞,调整细胞使其浓度在2×105个/mL左右,将其加入到96孔板中,每孔各100μL。随后将抗菌肽defensin分别加到实验组孔位中,使其终浓度分别为30、60、120、360、680和1 000 μg/mL。每个浓度设4个复孔。培养24 h后使肿瘤细胞贴壁。空白孔组设4个复孔,每孔PBS 100 μL。将孔板放置37℃,5%的CO2培养箱中培养24 h后弃液,每孔加入 MTT 20 μL(5 mg/mL),放置培养箱中,4 h之后每孔加入二甲基亚砜(DMSO) 100 μL,在37℃摇床上震摇10 min后用酶标仪检测450 nm时的吸光值。根据以下公式求出抗菌肽各浓度的相对抑制率(IR)。
1.2.3MTT比色法测定不同浓度抗菌肽作用下细胞生长曲线: 取对数生长活跃期的细胞,调整细胞浓度为(0.5~5.0)×105/mL。在每孔中加入 100 μL的细胞悬液,置于37℃,5%CO2培养箱中培养24 h。在其中加入不同浓度的抗菌肽defensin培养液 100 μL,阴性对照组中加入培养基,培养5 d。每个浓度组每天各取6孔,在每孔中加入5 mg/mL的 MTT 20 μL,继续培养4 h后加入 200 μL的DMSO,温箱中培养30 min,在450 nm处测定吸光度值。根据测定值绘制细胞生长曲线。

1.2.4用Annexin v-Fitc凋亡检测试剂盒检测肿瘤细胞细胞凋亡率: 用1640培养液调整细胞浓度为2.5×106/mL的细胞悬液。将细胞悬液加入24孔板中,800 μL/孔,将不同浓度抗菌肽加入靶细胞中,400 μL/孔,剩余孔板中加PBS作为对照,各设置3个复孔,放入37℃, 5%CO2培养箱中培养36 h。用PBS洗涤细胞两次(2 000 r/min离心5 min)收集浓度为1~5×105的细胞;在加入500 μL的 Binding Buffer缓冲液(hepes(10 mmol/L)/NaOH(PH 7.4),NaCl(140 mmol/L),CaCl2(2.5 mmol/L)),在500 μL 的Binding Buffer缓冲液中加入5 μL Annexin V-FITC,5 μL Propidium Iodide(碘化丙啶),混匀。室温避光反应5~15 min;1 h内进行流式细胞仪的观察和检测。
1.2.5用细胞周期试剂盒检测肿瘤细胞细胞周期: 调整细胞浓度为5×105/mL,每个培养瓶中加入4 mL培养液,将细胞贴壁培养24 h,去上清,加入2 mL抗菌肽和l mL培养基混合物,在阴性对照组中加入2 mL PBS和l mL培养基。每个浓度组各设置3瓶。在加抗菌肽48 h后收集细胞,用PBS洗涤细胞1次(离心2 000 r/min,5 min)后收集并调整细胞浓度;之后用70%乙醇固定细胞悬液,在4℃冰箱中保存,4 h后进行染色;细胞悬液用200目筛网过滤1次;加100 μL RNase A 37℃水浴箱中水浴30 min;再加入400 μL PI染液进行染色混匀,4℃避光30 min;上机检测,记录激发波长488 nm 处的红色荧光。
1.2.6统计学处理:实验所得数据用均数±标准差(±s)表示,实验数据用 SPSS13.0软件包处理,用实验分析数据进行单因素方差分析,用Duncan进行两两比较。细胞增殖抑制实验用该软件得出回归方程和IC50,检验水准a=0.05。抗菌肽MD对肝癌细胞HepG2的caspase-3含量的影响数据采用两独立样本t检验,检验水准a=0.05。
2 结果
2.1 倒置显微镜观察检测defensin抗肿瘤细胞HepG2结果
将defensin蛋白作用于肝癌细胞HepG2,在实验组中加入 680 μg/mL蛋白48 h,它的作用结果如图1(A, B)所示,实验组B中的细胞严重受损,细胞胞膜不完整,细胞内容物外泄,基本已看不到完整的细胞。而对照组A中细胞则比较规整。
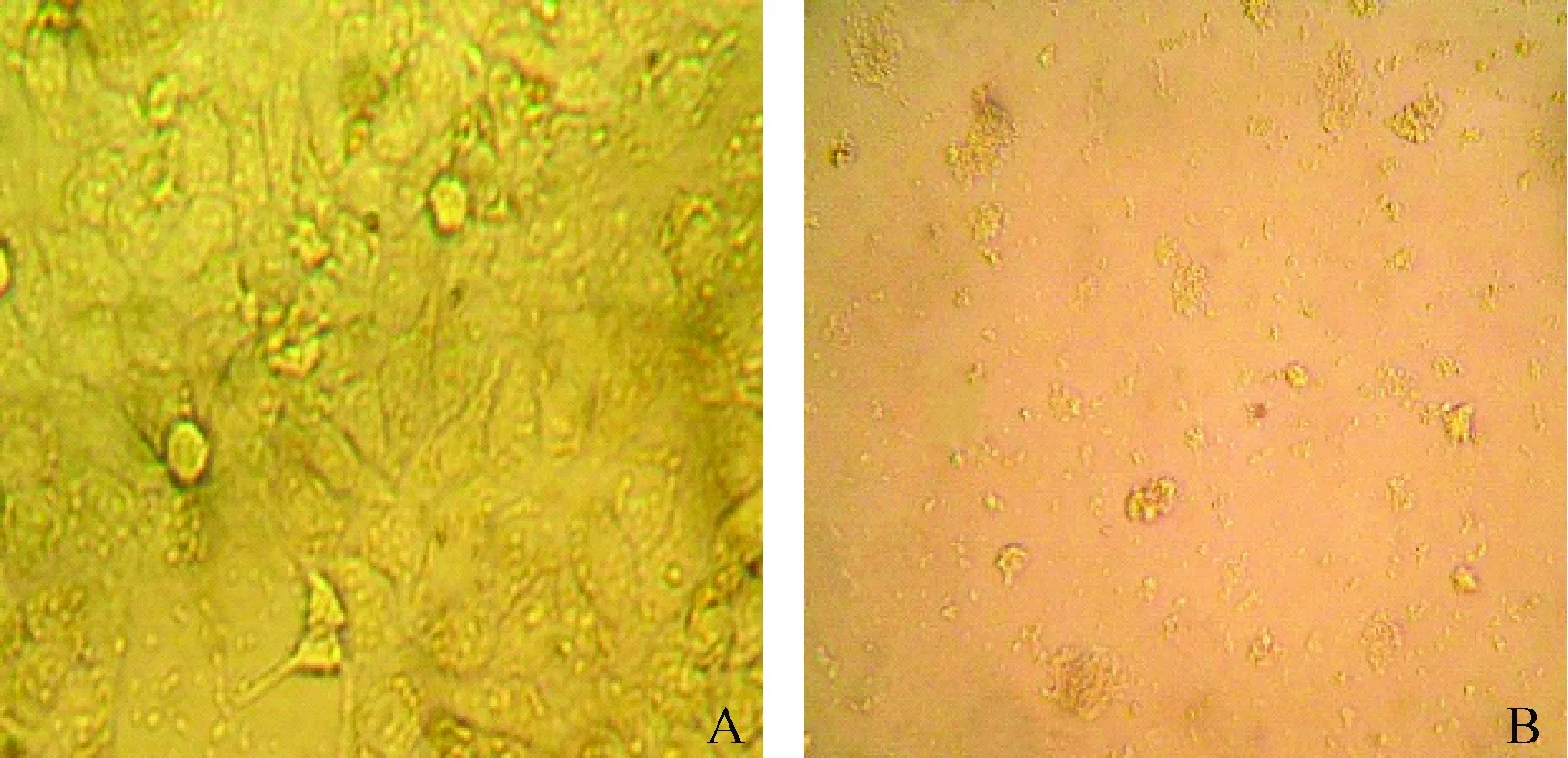
图1 倒置显微镜观察检测defensin抗肿瘤细胞HepG2结果Fig.1 Results of defensin on tumor cell HepG2 by inverted microscopeA. 阴性对照组(HepG2)(×400);B. Defensin作用组(HepG2)(×400)。A. Negative control group(HepG2)(×400);B. Treatment group(HepG2)(×400).
2.2 MTT法检测抗菌肽defensin对人心肌细胞和肝癌细胞的抑制作用
从表1中可以看出,不同浓度组抗菌肽defensin对人心肌细胞H9C2抑制率较低,各个浓度组抗菌肽defensin与正常对照组实际OD值相比,差异不具有统计学意义(P>0.05)。
如表2六个浓度组的抗菌肽defensin均对肝癌细胞HepG2有抑制作用,各浓度抗菌肽实验组与正常对照组相比较差异具有统计学意义(P<0.05),高浓度组(120、360、680、1 000 μg/mL组)与其他低浓度组相比较差异具有显著性,其结果具有统计学意义(P<0.05)。实验组的抑制率随浓度的增加逐渐上升,具有剂量效应反应关系。
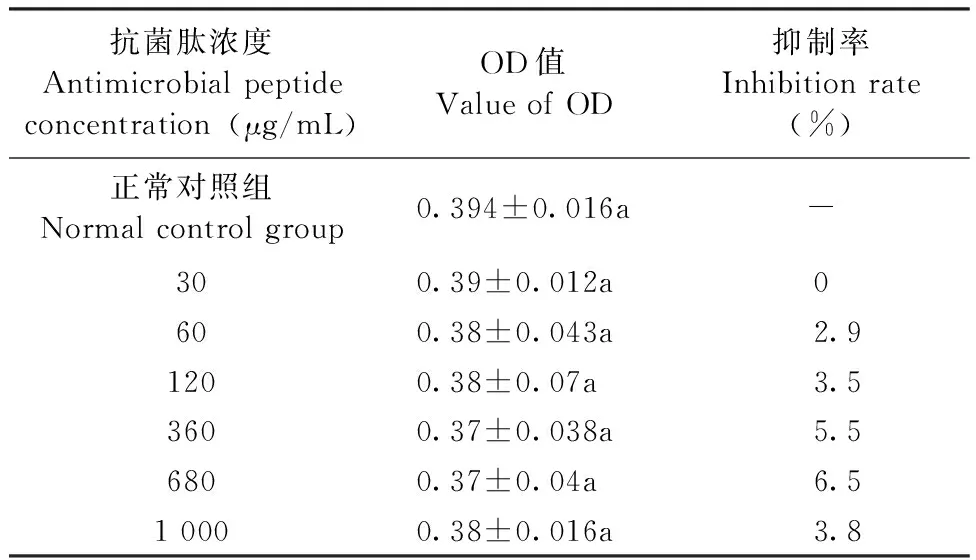
表1 抗菌肽对人心肌细胞的抑制作用 (n=6)Tab.1 Inhibitional effect on HCM cell by antimicrobial peptides MD
注: 同列数据后标有不同小写字母表示差异显著(P<0.05),相同字母表示差异无显著性(P>0.05,邓肯新复级差检测)。以下表中字母意义相同。
Note: Within each column, values followed by the different letter are significantly different (P<0.05,Duncan’s new multiple differential detection). The same below.
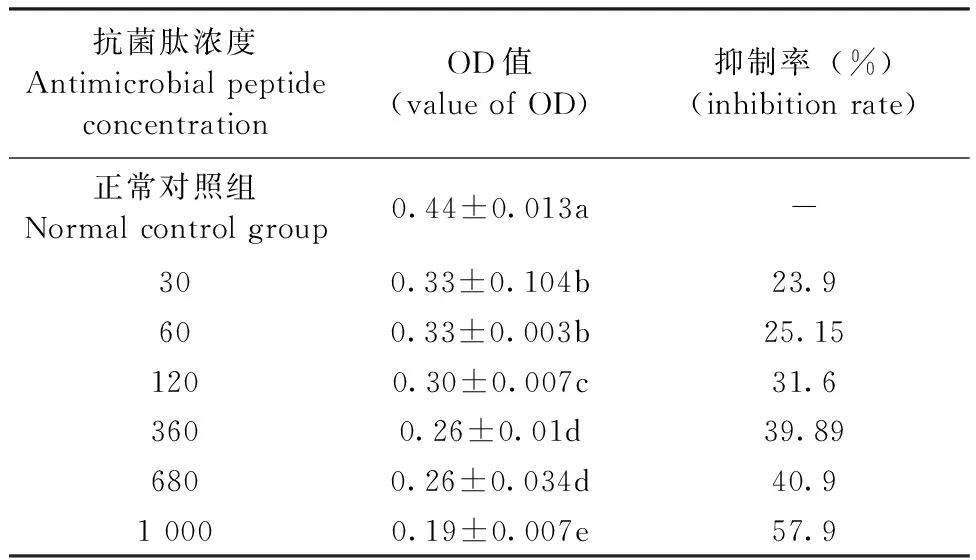
表2 抗菌肽defensin对肿瘤细胞HepG2的抑制作用(n=6)Tab.2 Inhibitional effect on HepG2 cell by antimicrobial peptides defensin
2.3 抗菌肽defensin作用下HepG2的生长情况
从图2中可以看出,肝癌细胞HepG2细胞的对数生长活跃繁殖期是第1天,各抗菌肽defensin浓度组在实验早期对细胞的生长就产生抑制作用,随着抗菌肽defensin浓度的增加和作用时间的延长,抗菌肽defensin对细胞的抑制杀伤作用显著增强。
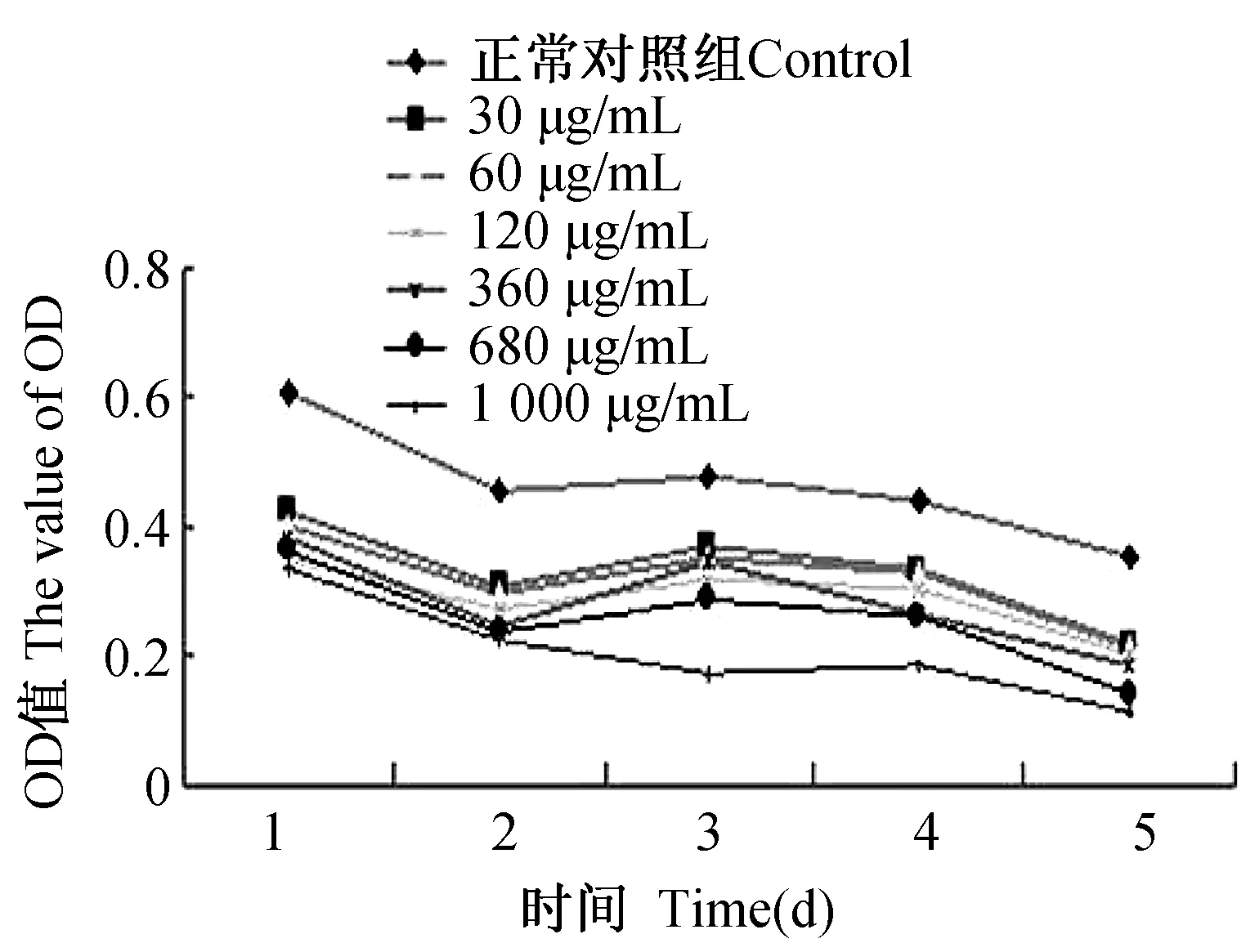
图2 各浓度组抗菌肽作用下HepG2肿瘤细胞的生长作用曲线Fig.2 Growth curve of HepG2 tumor cells under different concentration of antimicrobial peptides
2.4 流式细胞仪检测抗菌肽defensin作用于肝癌细胞HepG2所引起的细胞凋亡
如表3图3所示,各浓度组中680和1 000 μg/mL的抗菌肽defensin作用组对肝癌细胞HepG2有一定的抑制杀伤作用,细胞坏死和凋亡组与对照组相比具有统计学意义(P<0.05)。实验结果表明,该抗菌肽defensin可以有效地抑杀肝癌细胞HepG2。
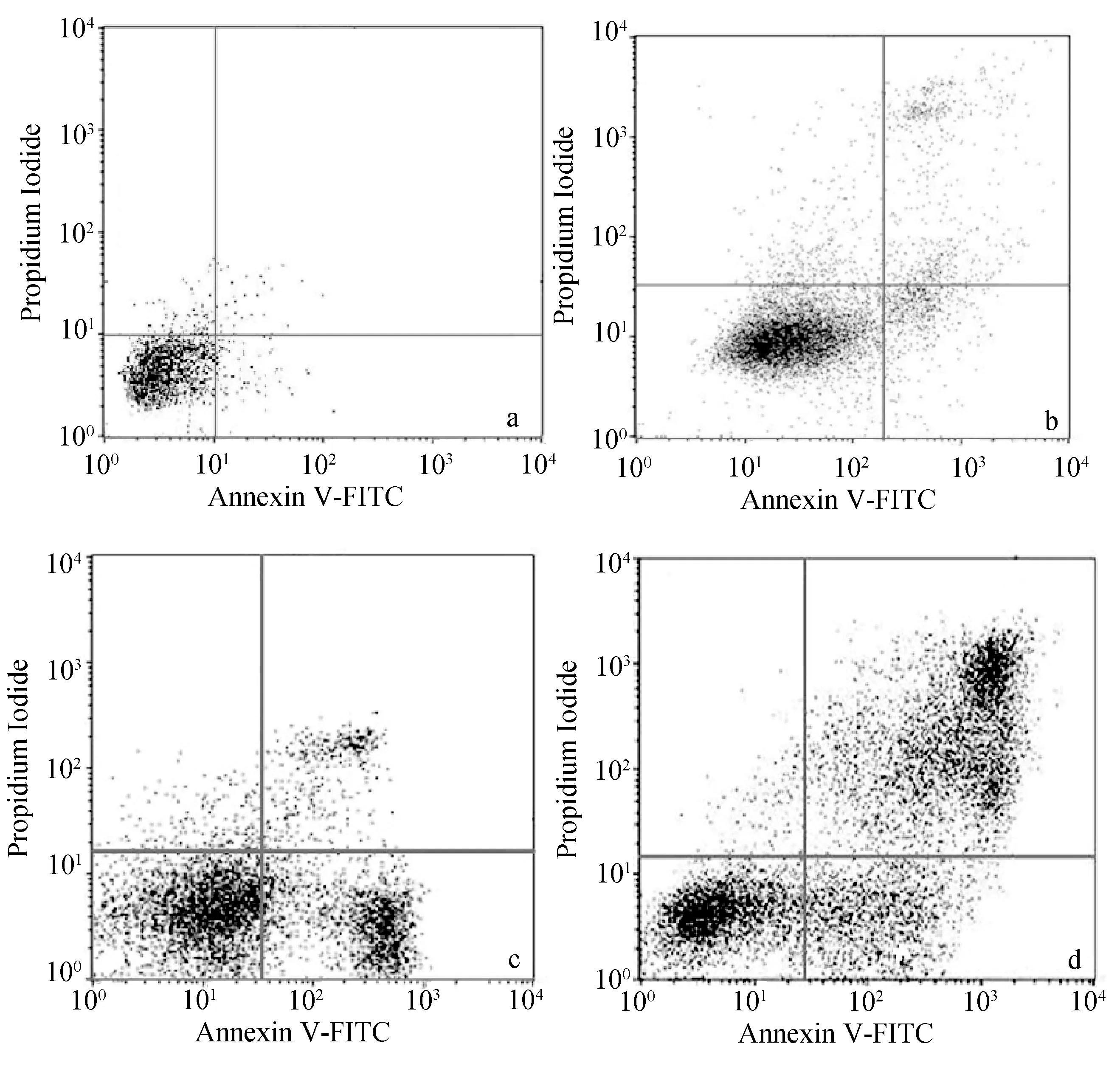
图3 经家蝇抗菌肽defensin不同浓度处理后凋亡率的测定Fig.3 The cell apoptotic rate by the flow cytometry analysis after treatment with different concentration of defensina. 对照组; b. 120 μg/mL处理组; c. 680 μg/mL处理组; d. 1 000 μg/mL处理组。a. Control; b. 120 μg/mL treatment group; c. 680 μg/mL treatment group; d. 1 000 μg/mL treatment group.
2.5 流式细胞仪检测肝癌细胞HepG2细胞周期
从表4和图4中可以看出,各浓度组抗菌肽defensin作用组使肝癌细胞HepG2细胞的S期降低,并且G0/G1期有所升高,从而引起细胞增殖指数PI降低,这个实验结果与正常对照组相比差异具有统计学意义,P<0.05。因此可以说该抗菌肽defensin可使肝癌细胞HepG2细胞周期阻滞于G0/G1期,从而抑制了S期DNA的合成。
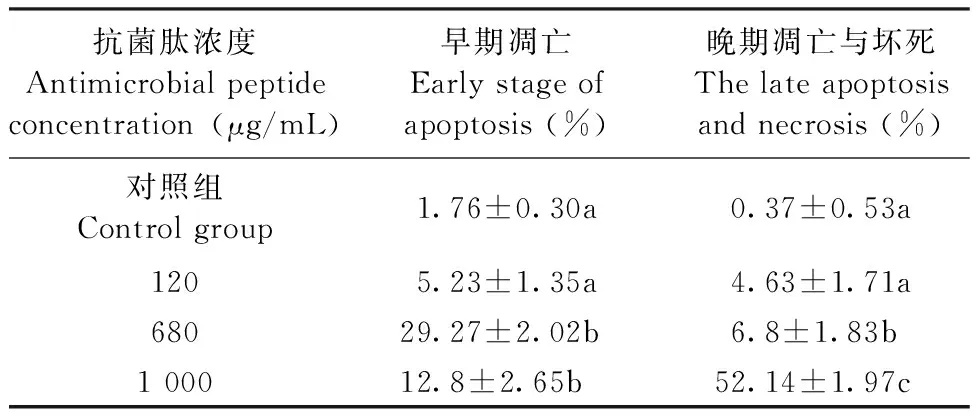
表3 不同浓度抗菌肽作用下HepG2细胞凋亡结果Tab.3 apoptosis of HepG2 under different concentration antimicrobial
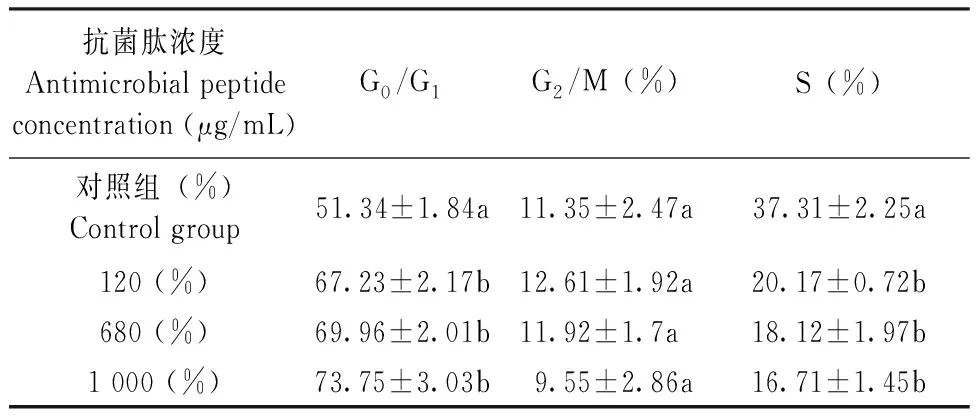
表4 抗菌肽对HepG2细胞周期的影响Tab.4 Effect of the antimicrobial Peptide on cell cycle of HepG2 cell
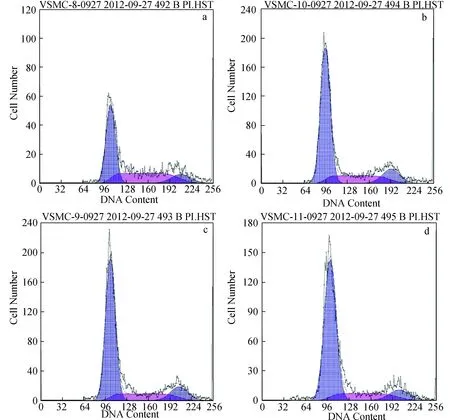
图4 经家蝇抗菌肽defensin不同浓度作用处理后细胞周期的测定Fig.4 The cell cycle result by the flow cytometry analysis after treatment with different concentration of defensina. 对照组; b. 120 μg/mL处理组; c. 680 μg/mL处理组; d. 1 000 μg/mL处理组。a. Control; b. 120 μg/mL group; c. 680 μg/mL group; d. 1 000 μg/mL group.
3 讨论
肝癌是一种常见的恶性肿瘤,在中国统计年鉴报道中居于癌症发病率第2位。它和其他恶性肿瘤细胞一样,主要是细胞增殖过度,而在细胞凋亡信号通路受阻时所造成的异型细胞无限制地过度增长,从而引起相关的病理生理变化。临床上用来治疗肝癌的药物有的虽然有效,但是引起的不良反应和副作用往往使病人难以忍受,有的甚至引起并发症;然而抗菌肽在杀伤肿瘤细胞的同时对正常细胞的作用比较小,因此这个原因就成为我们研究抗菌肽的焦点。昆虫防御素(Insect defensin)主要作用于病菌细胞膜,使病菌不易产生对防御素的抗性(Leeetal., 2002),但其它短肽主要作用于病原生物的酶物质,但酶基因会产生突变。一旦突变就会使目的细胞对这些短肽产生抗性,而防御素却具有其它肽类所没有的优点,它不会使靶细胞对其产生抗性。机体免疫系统也可以通过防御素来调节,能够抗感染。我们通过显微镜观察法检测到纯化目的蛋白defensin对肝癌细胞HepG2细胞具有抑制杀伤作用,目前国内外对该蛋白的抑菌活性有所研究,本实验采用MTT法测定抗菌肽defensin对肝癌细胞HepG2的抑制率,MTT比色法具有特异性较强、灵敏度较高、速度较快、准确性好及重复性好的特点,在客观基础上与常用的传统的方法相比具有很大的优点(Mosmannetal.,1983)。实验结果显示6个浓度组的抗菌肽defensin对肿瘤细胞HepG2有抑制作用,各组与正常对照组相比差异具有统计学意义(P<0.05),并且高浓度组与低浓度组 (30 μg/mL组)相比差异具有统计学意义(P<0.05),而且随着浓度的增加它对肿瘤细胞抑制率逐渐上升,呈剂量效应反应关系。人心肌细胞H9C2各浓度组与正常对照组相比差异不具有显著性(P>0.05),说明我们所提取的家蝇幼虫抗菌肽defensin对肿瘤细胞HepG2具有抑制作用,而对正常人心肌细胞H9C2基本无抑制作用。这与国内外报道的抗菌肽对肿瘤细胞有抑制作用,而对正常细胞无毒性作用结果相一致。赵瑞君等(2007)利用家蝇幼虫抗菌肽作用于人髓样白血病细胞株K562、人淋巴瘤细胞株Daudi、人食管癌细胞株Eca109和人膀胱癌细胞株T24,该实验结果表明4种肿瘤细胞都受到不同程度的损伤。
细胞生长曲线是用来观察细胞生长,增殖的常用指标。本实验采用MTT比色法测定绘制不同浓度家蝇幼虫抗菌肽作用下HepG2肿瘤细胞生长曲线。结果显示,HepG2细胞的对数生长期在第1天,随着药物作用时间的加长和浓度的增强细胞数量逐渐减少,且高浓度组抗菌肽对细胞的抑制作用明显高于其他浓度组。肿瘤细胞HepG2在不同浓度抗菌肽defensin作用下的生长曲线显示家蝇幼虫抗菌肽defensin对肿瘤细胞的作用随着时间加长和浓度的递增而逐步加强。
贺莉芳等(2006)采用家蝇幼虫抗菌肽在体外诱导子宫内膜癌细胞JEC凋亡,他的实验结果显示证明高浓度组家蝇幼虫抗菌肽可以引起细胞凋亡,并且子宫内膜癌细胞JEC细胞的凋亡率显著升高,所以该实验结果能推测出家蝇幼虫抗菌肽可以通过某些途径来诱导细胞凋亡而达到抑杀肿瘤细胞的效果。我们的实验结果显示680和1 000 μg/mL抗菌肽defensin对肝癌细胞HepG2的作用,显示和它与正常对照组相比差异具有统计学意义(P<0.05)。由此说明抗菌肽defensin可能通过某种途径导致细胞凋亡而用来杀伤细胞。
王芳等(1998)研究鲎抗菌肽对人肝癌细胞周期调节的作用中发现,鲎抗菌肽能阻止细胞生长在G0/G1期,并上调P16蛋白和P21mRNA,下调突变型P53蛋白,细胞周期蛋白D1和CDK4蛋白及c-myc mRNA。刘文钊等(2008)利用家蝇幼虫抗菌肽作用于子宫内膜癌细胞JEc和黑色素瘤细胞A375,该实验发现JEC细胞在2.5%和12.5%抗菌肽组作用下G0/G1期下降;高浓度组(12.5%)引起A375细胞在G0/G1期下降,GI/M期及PI有显著升高。我们从实验结果中能够看到,抗菌肽使大量的细胞在G1期停滞,且不能进入S期,从而抑制了S期DNA合成,说明抗菌肽可通过影响细胞周期作用来发挥抑制肝癌细胞HepG2的作用。
本研究从形态学着手观察,纯化蛋白defensin能够诱导人肝癌细胞HepG2的凋亡,抑制其增殖,并且该蛋白对正常人心肌细胞H9C2无抑杀作用。该蛋白通过影响细胞周期作用来发挥抑制肝癌细胞HepG2的作用,但是纯化蛋白defensin对人肝癌细胞HepG2诱导凋亡发生机制及对其他肿瘤细胞作用效果仍需进一步探讨和研究。

