再灌注前干预肥大细胞功能对大鼠肠缺血再灌注后早期肝损伤的影响*
黄品婕, 李晓芸, 罗晨芳, 张瑷兰, 刘健培
(中山大学附属第三医院1麻醉科,2胃肠外科,广东广州510630)
肠缺血再灌注(intestinal ischemia-reperfusion,IIR)除引起肠道损伤外,还是全身炎症反应和多器官衰竭发生的重要原因[1-2]。由于接受来自肠道的双重血液供应,肝脏是肠缺血再灌注最先受累的远隔脏器,而其本身具有巨大的内皮细胞和单核巨噬细胞库,可能成为失控炎症反应过程中多种炎症介质的源泉[3-4]。肠缺血再灌注后可能会导致急性肝功能障碍[3]。目前研究证明氧化应激、炎症介质的激活及失控性释放等是肠缺血再灌注损伤的重要机制之一[5-6],大多数学者认为肠源性内毒素血症是肠缺血再灌注致远隔器官损伤的主要原因,但由于肠源性毒性物质众多,肠缺血再灌注引起继发性早期肝损伤的具体发生机制目前仍不明确。
肥大细胞广泛分布于全身结缔组织中,尤以皮肤、呼吸道、消化道黏膜下层结缔组织中居多,正常情况下肥大细胞很少分布于人/鼠类肝脏,而在肝硬化晚期肝脏中可见肥大细胞数目急剧增加[7]。肥大细胞受刺激时,以胞吐方式大量释放颗粒内的物质(常称为脱颗粒),主要介质包括组胺、类胰蛋白酶、类糜蛋白酶、肝素和细胞因子等,在病理状态下产生广泛的生物学效应。组胺是由肥大细胞脱颗粒释放的胺类物质,通过与组胺受体结合参与过敏、炎症反应、调节机体免疫功能、促进胃酸分泌、维持内皮功能等。Kalia等[8]通过肠缺血前3 d连续经胃灌注组胺拮抗剂酮替酚,可提高大鼠再灌注后生存率。Zhao等[9]的研究表明,可通过核因子E2相关因子2-抗氧化反应元件(nuclear factor E2-related factor 2-antioxidant response element,Nrf2-ARE)信号通路增强抗氧化能力,从而减轻肠缺血再灌注导致的继发性肝损伤。Cámara-Lemarroy等[10]报道抑制肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)表达和脂质过氧化反应可能对肠缺血再灌注后肠道、肺和肝损伤具有保护作用。
以肥大细胞为靶点防治肠缺血再灌注后肠、肺损伤已有报道,并证明了抑制肥大细胞脱颗粒能减轻肠缺血再灌注损伤,但这些处理对继发性早期肝损伤的影响尚不明确。本研究的主要目的是通过药物干预肥大细胞功能,观察色甘酸钠(肥大细胞膜稳定剂)、酮替酚(组胺H1受体拮抗剂)和compound 48/80(肥大细胞脱颗粒剂)于肠缺血后再灌注前静脉应用对肠缺血再灌注继发性肝损伤的影响,并从肝脏功能性和病理性改变、血清组胺水平、肝细胞因子的变化、氧化应激和炎症反应等方面探讨肥大细胞在肠缺血再灌注致早期肝损伤中的可能机制,以及分析血浆肝功能水平与组胺、肝细胞因子及氧化指标的关系,为肥大细胞为靶点的药物治疗提供实验依据。
材料和方法
1 主要试剂
色甘酸钠(ICN Pharmaceuticals),酮替酚和compound 48/80(Sigma),TNF-α、白细胞介素 8(interleukin-8,IL-8)和组胺 ELISA试剂盒(R&D),BCA组织总蛋白提取试剂盒(凯基生物公司),乳酸脱氢酶(lactate dehydrogenase,LDH)活性试剂盒(南京建成生物工程公司)。
2 动物与分组
中山大学实验动物中心提供的35只清洁级雄性SD大鼠,体重180~270 g。按基础饲料饲养1周,室温25~27℃,适应环境后,按体重随机分为5组,每组7 只:假手术(sham operation,S)组、IR 组、IR+C组(缺血再灌注+色甘酸钠25 mg/kg)、IR+K组(缺血再灌注+酮替芬1 mg/kg)和IR+CP组(缺血再灌注+compound 48/80 0.75 mg/kg)。色甘酸钠、酮替芬和compound 48/80剂量参照我们以往的研究所用剂量[8,11-12]。
3 动物模型建立
模型建立参照我们以往研究,5组大鼠均于术前16 h禁食,自由饮水。腹腔注射10%水合氯醛3.5 mL/kg麻醉后,仰卧位固定,消毒铺巾,腹部正中切口进腹,分离肠系膜上动脉。S组只分离肠系膜上动脉,不阻断;其余4组用无损伤动脉夹夹闭肠系膜上动脉根部,75 min后松开动脉夹,模型复制成功的标准为缺血处肠系膜微动脉搏动消失;且再灌注前肠道淤黑、肿胀;动脉夹松开后缺血处肠系膜微动脉恢复搏动。IR+C、IR+K和IR+CP组分别在再灌注前5 min经尾静脉注射色甘酸钠、酮替芬或compound 48/80;S和IR组分别给予等量生理盐水。然后缝合腹膜、肌肉和皮肤,放于37℃恒温箱保温,自由饮水。
4 主要方法
4.1 标本处理 分别在再灌注4 h时断头处死各组大鼠,动物处死后立即取肝左内侧叶用10%甲醛固定,用于光镜病理观察。肝右叶标本冷生理盐水冲洗,装入冻存管液氮快速冰冻,-80℃保存备用。肝组织150 mg制作组织匀浆,以4 000 r/min离心15 min,取上清液以BCA法测定组织总蛋白浓度。同时,动物处死后立即取2 mL下腔静脉血,分离血浆取上清液放于-70℃冰冻保存。
4.2 血清丙氨酸氨基转移酶(alanine aminotrans-ferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)和组胺水平检测 血清 ALT和AST的检测使用全自动生化分析仪,单位以U/L表示。采用ELISA试剂盒测定大鼠血清组胺浓度。按试剂盒操作说明进行。
4.3 肝组织病理学损伤的评价 采用盲法在光镜下观察其病理学变化,每个标本随机取5个视野取平均值作为每个标本的评分值。肝组织损伤分级和评分采用如下标准[13]:0分:肝小叶、肝细胞、肝细胞索、中央静脉、肝窦均正常;1分:少见肝细胞变性,汇管区少量炎症细胞聚集;2分:肝中央静脉、肝窦内瘀血,散在肝细胞变性、坏死,肝组织内炎症细胞聚集较多,肝小叶结构完整;3分:肝中央静脉、肝窦内瘀血,广泛肝细胞变性、坏死,大量炎症细胞聚集,部分肝小叶破坏不完整。
4.4 肝组织LDH活性检测 采用组织全LDH活性试剂盒测定肝组织LDH活性。按试剂盒操作说明进行。
4.5 肝组织TNF-α和IL-8浓度检测 采用ELISA试剂盒测定大鼠肝组织匀浆TNF-α和IL-8浓度。按试剂盒操作说明进行。
4.6 肝组织超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量检测 采用黄嘌呤氧化酶法测定SOD活性。按照操作程序分别在测定管、对照管加入对应的试剂及样品,混匀,置37℃恒温水浴40 min,加入显色剂,混匀,室温放置10 min,于波长550 nm处,1 cm光径比色杯,蒸馏水调零,测各管吸光度值。根据吸光度值算出肝组织匀浆中SOD活力。采用硫代巴比妥酸反应法测定MDA含量。按照操作程序分别在标准管、标准空白管、测定管、测定空白管加入对应的试剂和样品,混匀,95℃水浴40 min,取出后流水冷却,然后3 500~4 000 r/min离心10 min。取上清1 mL,532 nm处,1 cm光径,蒸馏水调零,测各管吸光度值。根据吸光度值算出肝组织匀浆中MDA含量。
5 统计学处理
数据用SPSS 12.0软件处理。对数据进行正态性检验、方差齐性检验。正态分布的计量资料以均数±标准差(mean±SD)表示,多组均数间比较采用单因素方差分析(One-way ANOVA),采用SNK法进行组间的两两比较。血浆组胺水平、肝TNF-α、IL-8、MDA浓度、SOD活性与血浆AST水平的关系采用Pearson相关分析。以P<0.05为差异有统计学意义。
结 果
1 一般资料
各组大鼠的体重、体表面积等一般情况无显著差别(P >0.05)。
2 血清ALT、AST、组胺水平
与S组相比,其余各组的血清ALT和AST水平明显升高(P<0.05);与IR组相比,IR+C和IR+K组的血清ALT和AST水平明显降低(P<0.05),IR+CP组的血清 ALT和 AST水平明显增高(P<0.05),见图1A、B。
与S组相比,各组的血清组胺浓度明显升高(P<0.05);与IR组相比,IR+C和IR+K组的血清组胺浓度明显降低(P<0.05),IR+CP组的血清组胺含量明显增高(P<0.05),见图1C。
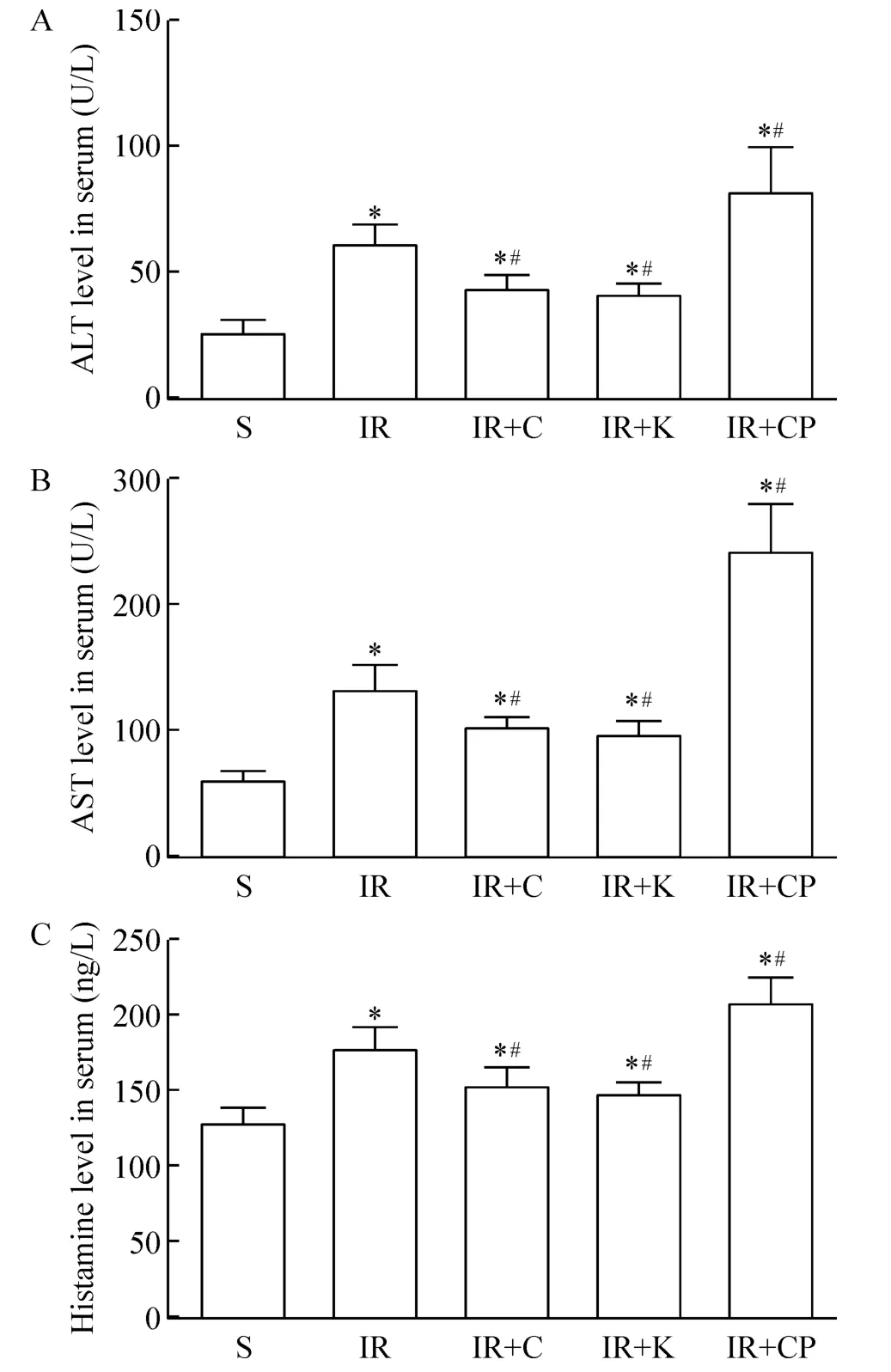
Figure 1.The levels of ALT(A),AST(B)and histamine(C)in serum after IR injury.Mean±SD.n=7.*P<0.05 vs S group;#P <0.05 vs IR group.图1 肠缺血再灌注后血清ALT、AST、组胺浓度变化
3 肝组织光镜病理改变
光学显微镜观察可见,S组肝细胞排列整齐,胞浆染色均匀,肝血窦清晰且无明显扩张,汇管区结构正常;IR组和IR+CP组表现肝细胞肿胀,胞浆淡染,肝血窦不规则有少量充血,汇管区血管充血、扩张;而IR+C和IR+K组与IR组相比,表现为肝细胞肿胀明显减轻,胞浆染色较匀,肝细胞的排列较整齐,肝血窦清楚,汇管区血管充血、扩张明显减轻。
病理形态学积分,与S组相比,各组的病理评分明显增加(P<0.05);与IR组相比,IR+C和IR+K组的病理评分降低(P<0.05),而IR+CP组的病理评分增加(P <0.05),见图2。
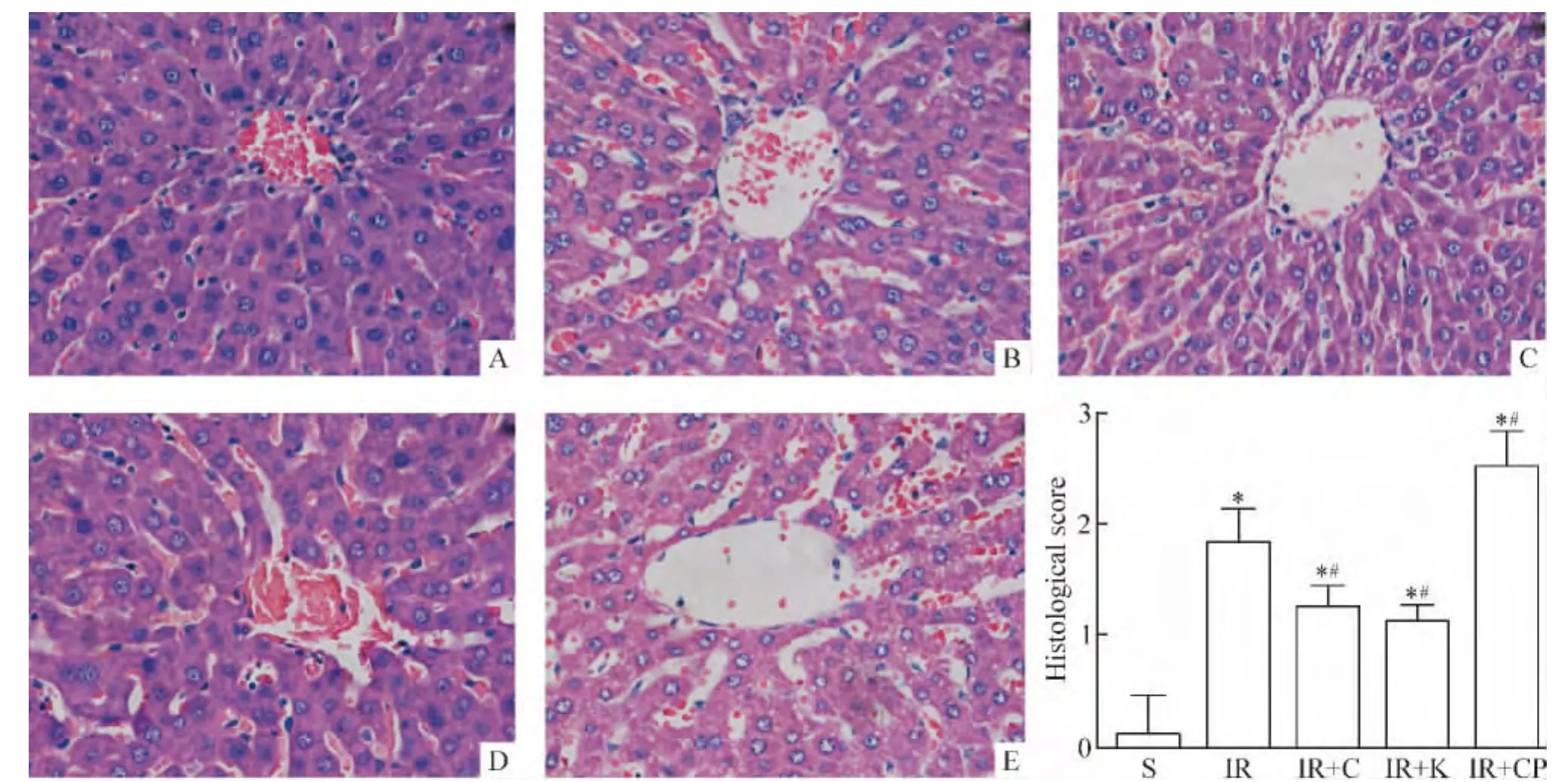
Figure 2.Morphological changes of liver tissues and liver histological score under light microscope after IR injury(HE staining,×400).A:sham;B:IR;C:IR+C;D:IR+K;E:IR+CP.Mean±SD.n=7.*P <0.05 vs S group;#P <0.05 vs IR group.图2 肠缺血再灌注后肝脏形态学及组织学评分改变
4 肝组织TNF-α和IL-8含量测定结果
与S组相比,其余各组的TNF-α和IL-8浓度明显升高(P<0.05);与IR组相比,IR+CP组的肝组织TNF-α和IL-8浓度明显升高(P<0.05),而 IR+C、IR+K组的肝组织TNF-α和IL-8浓度明显降低(P <0.05),见图 3A、B。
5 肝组织MDA含量和SOD活性变化
与S组相比,各组的肝组织MDA浓度明显升高,SOD活性降低(P<0.05);与IR组相比,IR+C和IR+K组的肝组织MDA浓度明显降低,SOD活性升高(P<0.05),IR+CP组的肝组织MDA含量明显增高,SOD 活性降低(P <0.05),见图3C、D。
6 肝组织LDH活性检测结果
与S组相比,各组的肝组织LDH活性明显升高(P<0.05);与IR组相比,IR+C和IR+K组的肝组织LDH活性明显降低(P<0.05),IR+CP组的肝组织LDH活性明显升高(P<0.05),见图3E。
7 血清 AST与血清组胺、肝 TNF-α、IL-8、MDA、SOD水平的相关分析
血清AST水平与血清组胺水平呈正相关(r=0.757,P<0.01),与肝组织 TNF-α含量呈正相关(r=0.893,P <0.01),与肝组织 IL-8 含量呈正相关(r=0.859,P <0.01),与肝组织 MDA 含量呈正相关(r=0.836,P <0.01),与肝组织 SOD 活性呈负相关(r= -0.793,P <0.01)。
讨 论
在肠、肺、心脏和脑缺血再灌注损伤的研究中,以肥大细胞为靶点进行干预减轻缺血再灌注损伤取得了一定效果,证实有可能是一种有前景的方法[8,14-16]。早期在急性胰腺炎引起继发性肺损伤的研究中,应用肥大细胞膜稳定剂色甘酸钠干预肥大细胞功能,也证实肥大细胞可能通过增加中性粒细胞、单核细胞/巨噬细胞的细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)的表达来促进白细胞的活化,启动远隔器官损伤[17]。我们的前期研究证明了缺血后给予色甘酸钠、酮替芬能减轻肠缺血再灌注损伤,提高动物存活率;而使用肥大细胞脱颗粒剂compound 48/80则加重肠缺血再灌注损伤,使动物存活率降低[12]。在本次研究中,我们发现肠缺血再灌注后肝脏出现继发性损伤,伴随血清ALT、AST水平和肝脏LDH活性升高,给予色甘酸钠、酮替芬能减轻肝脏病理性及功能性损伤,使用compound 48/80则加重肝损伤。提示肠缺血后给予色甘酸钠、酮替芬能减轻再灌注后肝脏早期损伤,使用肥大细胞脱颗粒剂compound 48/80则起相反作用。
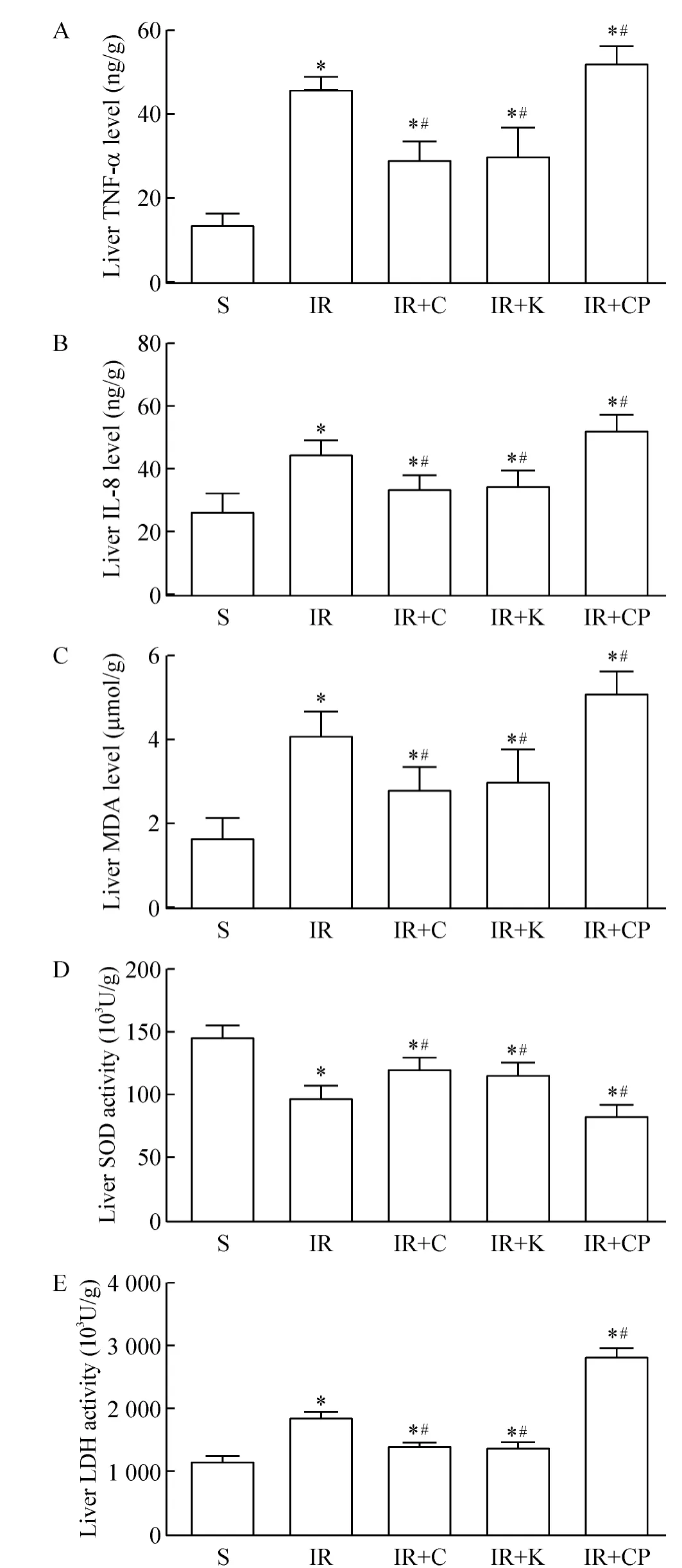
Figure 3.The levels of TNF-α (A),IL-8(B)MDA(C),SOD(D)and LDH(E)in liver tissues after IR injury.Mean±SD.n=7.*P <0.05 vs S group;#P <0.05 vs IR group.图3 肠缺血再灌注后肝组织 IL-8、TNF-α、MDA、SOD及LDH水平的变化
组胺是肥大细胞释放的主要活性物质之一,能增加血管通透性,诱导炎症细胞浸润,刺激上皮细胞释放细胞因子,引起或加重组织损伤,同时能进一步诱发肥大细胞活化。组胺拮抗剂被广泛应用于缺血再灌注的保护,有学者报道通过肠缺血前3 d连续经胃灌注酮替酚可提高大鼠生存率[8]。我们的研究发现肠缺血再灌注后血清组胺含量增高,给予色甘酸钠、酮替芬处理后血清组胺含量减少,而使用compound 48/80则增加组胺含量。同时相关分析结果表明血清组胺含量与血清AST水平呈正相关。以上结果提示肠缺血再灌注后肠源性肥大细胞被激活,并释放大量活性物质进入血液系统,其中组胺可能是造成远隔器官肝脏损伤的原因之一。
肠缺血后再灌注肝损伤的研究发现,肠道内的毒性物质及肠道组织缺氧产生的反应性氧化中介因子可以诱导肝脏的氧化损伤[9]。有研究发现肥大细胞可加重氧化损伤,肥大细胞激活促进细胞内活性氧自由基产生,促使 SOD活性降低,MDA水平增高[18]。我们的研究显示应用色甘酸钠抑制肥大细胞脱颗粒、应用酮替芬拮抗组胺效应,均可升高肝脏SOD活性,减少肝脏MDA水平,减轻肝脏早期氧化损伤;而compound 48/80促进肥大细胞脱颗粒,可加重肝氧化损伤。相关分析显示血清AST含量与肝脏MDA水平呈正相关,与肝脏SOD活性呈负相关。以上表明肥大细胞介导的氧化应激可能参与了肠缺血再灌注后早期肝损伤过程。
炎症介质的激活是引发远隔脏器损伤机制中极为关键的环节。研究表明,肠缺血再灌注后内毒素易位诱导肝脏内 IL-1、IL-6、IL-8和TNF-α等细胞因子的产生,组织病理切片可观察到出血、水肿和炎症细胞浸润,血清ALT、AST水平明显增加[4]。本研究结果发现使用色甘酸钠或酮替芬后肝TNF-α和IL-8水平显著降低;而compound 48/80组TNF-α和IL-8水平显著增高,提示抑制肥大细胞脱颗粒或拮抗组胺效应,均可减轻肠缺血再灌注肝脏炎症反应,相反促进肥大细胞脱颗粒则加重肝脏炎症反应。相关分析显示血清AST含量与肝TNF-α和IL-8水平呈正相关。这些结果表明肥大细胞激活参与了促炎因子的生成,可能也是肥大细胞引起肠缺血再灌注致早期肝损伤的机制之一。
总之,本研究结果首次表明干预肥大细胞功能可以影响大鼠肠缺血再灌注导致的肝损伤情况。再灌注前抑制肥大细胞功能,减少组胺释放可以减轻肠缺血再灌注后肝脏早期氧化损伤和炎症反应从而减轻肝脏损伤。而促进肥大细胞脱颗粒则加重肝损伤。关于肠缺血再灌注后早期肝损伤的具体机制还有待进一步研究。
[1] Mallick IH,Yang W,Winslet MC,et al.Ischemia-reper-fusion injury of the intestine and protective strategies against injury[J].Dig Dis Sci,2004,49(9):1359-1377.
[2] Harward TR,Brooks DL,Flynn TC,et al.Multiple organ dysfunction after mesenteric artery revascularization[J].J Vasc Surg,1993,18(3):459-469.
[3] Turnage RH,Bagnasco J,Berger J,et al.Hepatocellular oxidant stress following intestinal ischemia-reperfusion injury[J].J Surg Res,1991,51(6):467-471.
[4] Yao JH,Li YH,Wang ZZ,et al.Proteasome inhibitor lactacystin ablates liver injury induced by intestinal ischaemia-reperfusion[J].Clin Exp Pharmacol Physiol,2007,34(11):1102-1108.
[5] 李 毅,李坤河,温仕宏,等.JAK/STAT通路在大鼠肠缺血再灌注所致肠损伤中的作用[J].中国病理生理杂志,2011,27(12):2338-2344.
[6] 叶志强,戴海涛,刘旭辉,等.乳果糖预处理减轻大鼠肠缺血再灌注损伤的机制研究[J].中国病理生理杂志,2013,29(5):918-922.
[7] Armbrust T,Batusic D,Ringe B,et al.Mast cells distribution in human liver disease and experimental rat liver fibrosis.Indications for mast cell participation in development of liver fibrosis[J].J Hepatol,1997,26(5):1042-1054.
[8] Kalia N,Brown NJ,Wood RF,et al.Ketotifen abrogates local and systemic consequences of rat intestinal ische-miareperfusion injury[J].J Gastroenterol Hepatol,2005,20(7):1032-1038.
[9] Zhao HD,Zhang F,Shen G,et al.Sulforaphane protects liver injury induced by intestinal ischemia reperfusion through Nrf2-ARE pathway[J].World J Gastroenterol,2010,16(24):3002-3010.
[10] Cámara-Lemarroy CR,Guzmán-de la Garza FJ,Alarcón-Galván G,et al.Effects of thalidomide and pentoxyphylline over local and remote organ injury after intestinal ischemia/reperfusion[J].Transplant Proc,2010,42(5):1624-1626.
[11] Gan XL,Hei ZQ,Huang HQ,et al.Effect of Astragalus membranaceus injection on the activity of the intestinal mucosal mast cells after hemorrhagic shock-reperfusion in rats[J].Chin Med J(Engl),2006,119(22):1892-1898.
[12] Hei ZQ,Huang PJ,Gan XL,et al.Influence of cromolyn sodium and compound 48/80 administered prior to and after reperfueion on the third day’s survival rate in a rat intestinal ischemia model[J].Chin Med J(Engl),2008,121(18):1843-1847.
[13] Hakan C,Tamer A,Canten T.The effects of exogenous L-carnitine on lipid peroxidation and tissue damage in an experimental warm hepatic ischemia-reperfusion injury model[J].Curr Therapeutic Res,2007,68(1):32-46.
[14] Vural KM,Liao H,Oz MC,et al.Effects of mast cell membrane stabilizing agents in a rat lung ischemia-reperfusion model[J].Ann Thorac Surg,2000,69(1):228-232.
[15] Frangogiannis NG,Youker KA,Rossen RD,et al.Cytokines and the microcirculation in ischemia and reperfusion[J].J Mol Cell Cardiol,1998,30(12):2567-2576.
[16] Lindsberg PJ,Strbian D,Karjalainen-Lindsberg ML.Mast cells as early responders in the regulation of acute bloodbrain barrier changes after cerebral ischemia and hemorrhage[J].J Cereb Blood Flow Metab,2010,30(4):689-702.
[17]Dib M,Zhao X,Wang XD,et al.Role of mast cells in the development of pancreatitis-induced multiple organ dysfunction[J].Br J Surg,2002,89(2):172-178.
[18] Okayama Y.Oxidative stress in allergic and inflammatory skin diseases[J].Curr Drug Targets Inflamm Allergy,2005,4(4):517-519.

