胰脂肪酶抑制剂产生菌的筛选
孙 菲, 郑 榕, 杨煌建, 张祝兰
福建省微生物研究所,福州 350007
肥胖症是危害人类健康的全球性疾病。1997年,世界卫生组织(World Health Oganization,WHO)已明确认定肥胖是全球成年人最大的慢性疾病,被列为世界四大医学社会问题之一。根据WHO 2011年公布的数据,2008年全球超重者达15亿人,其中肥胖者5亿人。卫生部2004年统计资料表明,我国有2.6亿人超重或肥胖,且肥胖患病率呈明显上升趋势。因此研究肥胖病因、开发安全有效的减肥药物已成为世界关注的研究领域。
目前已开发应用的减肥药物大都作用于中枢神经系统,具有较强的副作用,如引起中枢神经兴奋(包括失眠、紧张、不安、噩梦、易怒等)、血压上升或下降以及心脏瓣膜病等[1~4]。因此,现在基本被禁用。胰脂肪酶抑制剂是迄今为止唯一不通过中枢神经系统作用的减肥药物,它通过选择性地抑制胃肠道内的胰脂肪酶,减少脂肪的分解和吸收,从而达到控制体重的目的,对其他营养物质的吸收无影响,副作用主要表现为胃肠道不适,安全性相对较高[5,6]。
胰脂肪酶抑制剂作用机理独特,并有良好的减肥功效和较高的安全性,是当前减肥药物研究的主要方向。国外研究者对胰脂肪酶抑制剂的研究较早,已筛选到一系列的胰脂肪酶抑制剂,如Esterastin[7]、Ebelactone A、Ebelactone B[8]、Valiacton[9]、Lipstatin[10]、Panclicin A~E[11]等,并对它们的生物活性、生物合成机理、作用机制、分子结构等方面进行了研究。其中Lipstatin已由罗氏公司开发为减肥药物赛尼可,是目前唯一的OTC(非处方药)减肥药物。国内近年来也相继从植物[12]、中药[13~15]及微生物[16,17]中筛选到一些脂肪酶抑制剂。
本文通过建立高通量的胰脂肪酶抑制剂产生菌筛选模型对微生物进行筛选,获得具有胰脂肪酶抑制活性的菌株,同时对产生菌代谢产物对淀粉酶、蛋白酶的抑制活性进行考察,使筛选获得的胰脂肪酶抑制剂能够较高选择性地抑制脂肪酶活力,对淀粉酶、蛋白酶的活力影响很小,不影响人体对其他营养物质,如对淀粉、蛋白质的吸收,从而符合减肥药物开发的要求[18]。应用此模型对来源于土壤的千余株菌株进行筛选,得到目标菌株FIM-1013、FIL-19和FIMe-3,具有潜在的工业应用价值。
1 材料与方法
1.1 主要材料
猪胰脂肪酶、α-淀粉酶、蛋白酶购自Sigma公司;脂肪乳剂Intralipid购自B.Braun Mel-sungen AG公司(德国);其他试剂均为国产分析纯。
1.2 培养基与培养条件
高氏I号培养基:可溶性淀粉20g/L,NaCl 0.5g/L,KNO31g/L,K2HPO3·3H2O 0.5g/L,MgSO4·7H2O 0.5g/L,FeSO4·7H2O 0.01g/L,K2Cr2O70.25g/L,pH 7.4~7.6。
液体培养基用于摇瓶培养,装液量60mL/500mL,转速220r/min,28℃培养7d。
固体培养基添加琼脂20g/L,分离平板28℃培养10d,斜面28℃培养7d。
1.3 方法
1.3.1 微生物的分离 土壤样品采集于福建省福州市鼓山。将采集的土样制成土样悬液,梯度稀释后涂布于高氏I号培养基分离平板上,28℃培养10d,挑取单菌落至斜面培养基,28℃培养7d。
1.3.2 菌株发酵液筛选的样品制备 各分离菌株进行摇瓶发酵培养。所得发酵液加入4倍体积的无水乙醇,振摇(搅拌)60min后,10 000r/min离心10min,取上清液作为脂肪酶抑制活性的测定样品。空白对照样品以摇瓶培养的原始培养基(高氏I号液体培养基)按上述方法制备。
1.3.3 胰脂肪酶抑制剂体外筛选模型的建立
根据姚朗等[19]方法建立胰脂肪酶抑制剂体外筛选模型。该模型以临床注射用静脉脂肪乳剂Intralipid作脂肪酶活性测定底物,以奥利司他作为阳性对照样品。发酵液样品(10μL)、胰脂肪酶(100μL)及静脉脂肪乳剂Intralipid(70μL)35℃共同反应30min后,比浊度发生变化,发酵液样品的胰脂肪酶抑制能力与比浊度变化呈负相关,胰脂肪酶抑制能力越强则比浊度下降值越小。应用酶标仪,采用96孔比浊法于波长490nm测定比浊度,筛选出具有较强胰脂肪酶抑制能力的菌株。
1.3.4 淀粉酶、蛋白酶、胰脂肪酶抑制活性测定
分别用空白对照样品和各分离菌株的发酵液样品溶解淀粉酶、蛋白酶、胰脂肪酶酶粉,按标准方法测定发酵液对淀粉酶、蛋白酶、胰脂肪酶的抑制活性[20]。淀粉酶活力单位以l g酶粉在60℃、pH 6.0条件下,在1h内液化可溶性淀粉的克数表示。酸性蛋白酶活力单位以1g酶粉在37℃、pH 5.5的条件下,每分钟水解酪蛋白释放酪氨酸微克数表示。胰脂肪酶活力是将每分钟从底物中释放出1μg小分子脂肪酸所用酶量定义为一个单位。淀粉酶、蛋白酶、胰脂肪酶活性测定结果运用SPSS16.0(Statistical Program for Social Sciences,SPSS Corporation,Chicago,IL)数理统计分析软件进行单因素方差分析多重比较。酶抑制率计算公式如下:
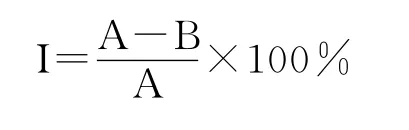
式中,I表示酶活性抑制率(%);A为酶标准活性(U);B为抑制作用下酶活性(U)。
2 结果与分析
2.1 胰脂肪酶抑制剂产生菌的筛选
从土壤中分离1 000余株菌株,发酵后经胰脂肪酶抑制剂筛选模型筛选,每株菌株样品设置三个平行样,用酶标仪测定样品反应前后OD值,计算OD值下降值。最终筛选得到11株胰脂肪酶抑制剂产生菌(表1),其中菌株FIRs-132、FITs-221为细菌,其余均为放线菌。其代谢产物均具有胰脂肪酶抑制能力,其中,菌株FIM-1013、FIB-17、FIL-19和FIMe-3(见图1)的胰脂肪酶抑制能力优于其他菌株。
2.2 菌株的淀粉酶抑制活性
对筛选到的11株胰脂肪酶抑制剂产生菌进行淀粉酶抑制活性的测定,结果如表2所示,其中,菌株FIM-1013对淀粉酶无抑制活性;菌株FIL-19、FIMe-3、FIRs-132和FITs-221对淀粉酶的抑制活性极其微弱;菌株FINe-45、FIGr-116对淀粉酶抑制活性较强,达到50%以上。
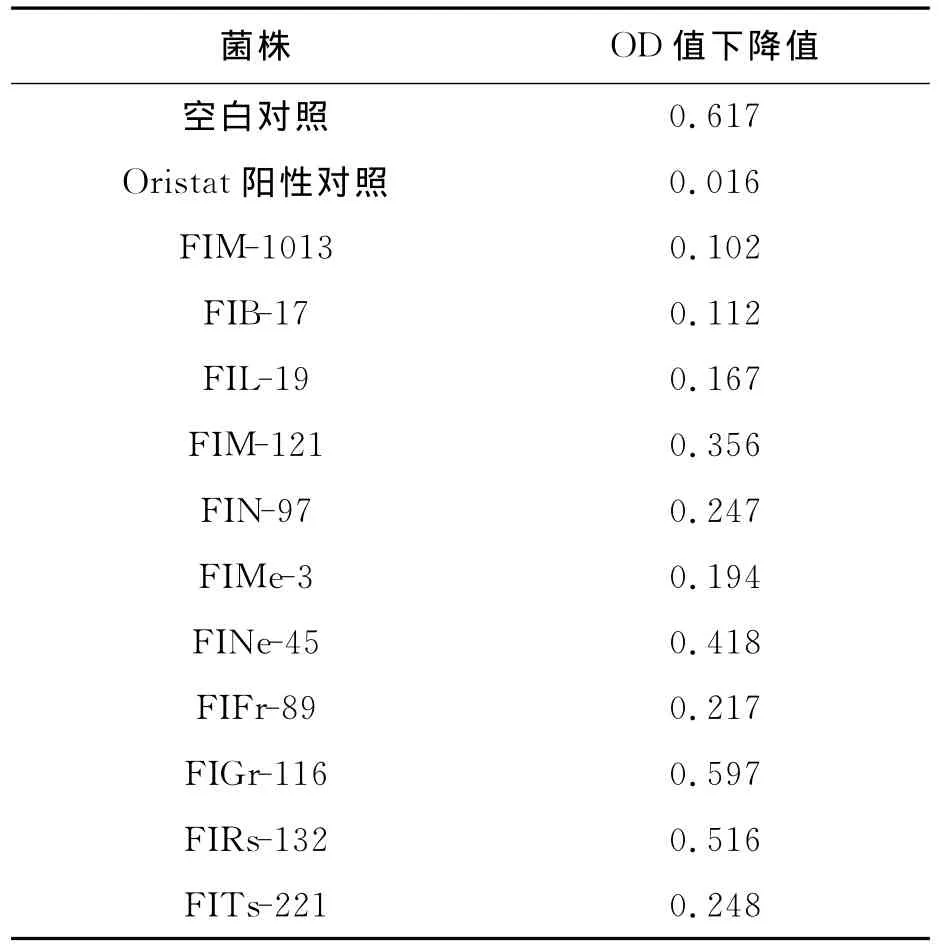
表1 胰脂肪酶抑制剂产生菌的筛选 Table 1 Screening of pancrelipase inhibitor-producing strains.
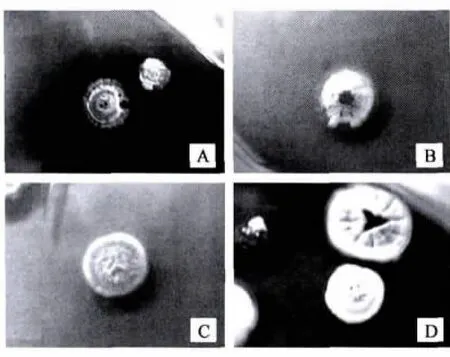
图1 胰脂肪酶抑制剂产生菌菌落形态 Fig.1 The colonial morphology of pancrelipase inhibitor-producing strains.

表2 各菌株淀粉酶抑制活性测定 Table 2 The inhibitory effects of the strains on amylase.
2.3 蛋白酶抑制活性
在对菌株代谢产物进行淀粉酶抑制活性测定的同时进行蛋白酶抑制活性的测定,实验结果(表3)显示,FIMe-3 对蛋白酶无抑制活性;FIM-1013、FIL-19和FIFr-89菌株对蛋白酶有微弱的活性抑制;FIM-121、FIN-97和 FITs-221菌株对蛋白酶活性抑制能力较强;其他菌株对蛋白酶也有一定的抑制能力。
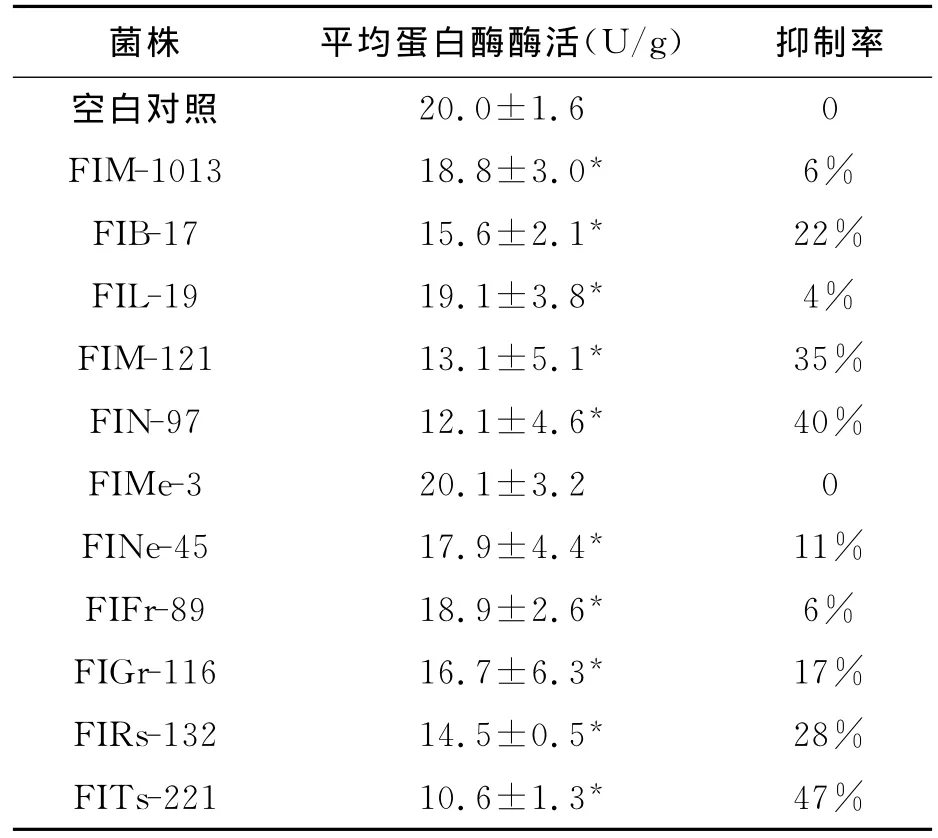
表3 各菌株蛋白酶抑制活性的测定 Table 3 The inhibitory effects of the strains on protease.
2.4 胰脂肪酶抑制活性
对来源于土壤的微生物通过胰脂肪酶抑制剂筛选模型进行筛选,得到11株胰脂肪酶抑制剂产生菌,其中三株放线菌FIM-1013、FIL-19 和FIMe-3具有较强的胰脂肪酶抑制活性,而对淀粉酶、蛋白酶活性无显著抑制活性,符合胰脂肪酶抑制剂减肥药物开发的需求。对此三株菌株进行胰脂肪酶抑制活性的测定,实验结果(表4)显示,FIM-1013、FIL-19和FIMe-3菌株对胰脂肪酶的抑制活性无显著差异,其中FIM-1013菌株对胰脂肪酶的抑制活性最强。

表4 各菌株胰脂肪酶抑制活性的测定 Table 4 The inhibitory effects of the strains on pancrelipase.
3 讨论
本研究根据姚朗等的方法建立胰脂肪酶抑制剂体外筛选模型,该模型灵敏可靠、实用性强。应用此模型对来源于土壤的微生物进行筛选,再结合对菌株淀粉酶、脂肪酶抑制活性的分析,得到三株胰脂肪酶抑制剂产生菌FIM-1013、FIL-19和FIMe-3,具有较强的胰脂肪酶抑制活性,而对淀粉酶、蛋白酶活性无显著抑制能力,其高度选择性与赛尼可相似,具有潜在的应用开发前景,值得更深入地研究。研究将进一步对三个菌株进行发酵工艺的优化,提高菌株产胰脂肪酶抑制剂的能力,并尝试从菌株发酵产物中分离纯化得到胰脂肪酶抑制剂纯品,研究其理化特性并通过有机波谱方法对获得的胰脂肪酶抑制剂进行结构分析,比较本研究获得的胰脂肪酶抑制剂与已知胰脂肪酶抑制剂的生物活性和结构,以期得到新的强效胰脂肪酶抑制剂。
[1] James W P,Caterson I D,Coutinho W,et al..Effect of sibutramine on cardiovascular outcomes in overweight and obese subjects[J].N.Engl.J.Med.,2010,363(10):905-917.
[2] Li M F,Cheung B M.Rise and fall of anti-obesity drugs[J].World J.Diabetes,2011,2(2):19-23.
[3] David J H,Jane G,Sharon L S.Regulatory challenges for new drugs to treat obesity and comorbid metabolic disorders[J].Br.J.Clin.Pharmacol.,2009,68(6):861-874.
[4] 袁 建,肖廷超,朱照静.减肥药物不良反应文献综合分析[J].中国药业,2011,20(12):52-53.
[5] Weibel E K,Hadyary P,Hochuli E.Lipstatin,an inhibitor of pancreatic lipase,produced by Streptomyces toxytrcini.I.Producing organism,fermentation,isolation and biological activity[J].J.Antibiot.,1987,40(8):1081-1085.
[6] Field B C T,Chaudhri O B,Bloom S R.Obesity treatment:novel peripheral targets[J].Br.J.Clin.Pharmacol.,2009,68(6):830-843.
[7] Umezawa H,Aoyagi T,Hazato T,et al..Esterastin,an inhibitor of esterase,produced by actinomycetes[J].J.Antibiot.,1978,31(6):639-641.
[8] Umezawa H,Aoyagi T,Uotani K,et al..Ebelaetone,an inhibitor of ester,produced by actinomycetes[J].J.Antibiot.,1980,33(12):1594-1596.
[9] Kitahara M,Asano M,Naganawa H,et al..Valliactone,an inhibitor of ester,produced by actinomycetes[J].J.Antibiot.,1987,40(11):1647-1650.
[10] Yoshinari K,Aoki M,Ohtsuka T,et al..Panclicins,a novel pancreatic lipase inhibitors:Ⅱ.structure elucidation[J].J.Antibiot.,1994,478(12):1376-1384.
[11] Mutoh M,Nakada N,Matsukuma S,et al..Panclicins,a novel pancreatic lipase inhibitors I. taxonomy,fermentation,isolation and biological activity[J].J.Antibiot.,1994,47(12):1369-1375.
[12] 姜运耀,吕国英,李燕飞,等.植物来源的胰脂肪酶抑制剂研究进展[J].中国生化药物杂志,2012,33(2):199-202.
[13] 陈 锥,陶 益.磁珠富集与液相色谱-质谱联用结合筛选枳壳中脂肪酶抑制剂[J].高等学校化学学报,2012,33(12):2692-2696.
[14] 郑成栋.中药中脂肪酶抑制剂的筛选[D].陕西杨凌:西北农林科技大学,硕士学位论文,2010.
[15] 范婷婷.荷叶生物碱类物质降脂减肥活性研究[D].杭州:浙江大学,硕士学位论文,2013.
[16] 刘 兰,周培华,曾 伟,等.脂肪酶抑制剂产生菌的筛选和鉴定[J].食品与生物技术学报,2013,32(2):219-223.
[17] 钟卫鸿,卢静亚.脂肪酶抑制剂产生菌筛选[J].中国抗生素杂志,2002,27(11):641-643.
[18] 杨志敏,耿 莹,王宏宇,等.减肥药物临床研究评价的考虑要点[J].中国临床药理学杂志,2013,29(7):557-560.
[19] 姚 朗,苏 勇,蒋华良.96孔板比浊法胰脂肪酶抑制剂体外筛选模型的建立[A].见:2004年中国药学会学术年会论文集[C].中国药学会学术年会,昆明,2004.
[20] Bergmeyer H U.(Ed.).Methods of Enzymatic Analysis[M].(2nd Ed.)New York:Verlag Chemie,GmbH,Weinheim/Bergstr.(Germany)and Academic Press,1974.

