高效液相色谱法测定大麦虫磷脂酰胆碱含量
范志影, 石冬冬, 常碧影, 张 萍
中国农业科学院饲料研究所,北京 100080
大麦虫(Zophobsmorio L.)属于节肢动物门、昆虫纲、鞘翅目、拟步甲虫科昆虫,俗称麦片虫、麦谷虫或超级面包虫[1],是国内刚开始试验养殖的新型资源昆虫。大麦虫具有繁殖速度快、食物转化率高的特点,是尚未充分开发的可再生性生物资源[2]。近年来,利用昆虫生产功能性食品、医药品已经形成一定的科研基础,但对蛋白质类,如抗菌肽、昆虫抗冻蛋白等[3]为主体功能性成分的产品体系关注较多,对昆虫油脂、磷脂等脂质类产品的研究相对较少[4,5]。
磷脂酰胆碱(PC)俗称卵磷脂,是生命的基础物质,人类生命自始至终都离不开它的滋养和保护。磷脂酰胆碱存在于每个细胞之中,更多集中在脑及神经系统、血液循环系统、免疫系统等重要器官[6]。大量研究表明,磷脂酰胆碱具有提高记忆[7]、增强免疫、保护肝肺[8~11]、调节血脂、防治糖尿病及延缓机体衰老等多种保健功能[12,13],被誉为与蛋白质、维生素并列的“第三营养素”[6]。大麦虫的干基油脂含量高达48.99%,且富含维生素E和磷脂酰胆碱,无论是在量上还是质上都潜藏着巨大的研究、开发和利用价值。所以建立一种快速、灵敏、有效的测定大麦虫中磷脂酰胆碱含量的方法在大麦虫磷脂酰胆碱产品开发方面有重要意义。
近年来,对保健品中磷脂酰胆碱的分析研究报道较多,主要有分光光度法[14~18]、薄层色谱法[19,20]、荧光分光光度法[21]和高效液相色谱法等[22~24]。但关于大麦虫中磷脂酰胆碱的测定方法的研究还未见报道。本文建立了大麦虫中磷脂酰胆碱含量的高效液相色谱法,可以满足实际样品分析的要求,为开发大麦虫功能性油脂产品提供了方法学基础。
1 材料与方法
1.1 试验材料
从虫卵孵出开始以麦麸和白菜(1∶2)为饲料进行室内养殖,养殖室温度20~27℃,相对湿度45%~55%,日光灯照明12h。从卵孵出后14d开始取样,之后每7d取一次样品,共取出12组样品(即分别取14日龄、21日龄、28日龄、35日龄、42日龄、49日龄、56日龄、63日龄、70日龄、77日龄、84日龄和91日龄的大麦虫幼虫),每组样品设3个重复,每个重复取样量约2g,取出后停食24h后-20℃冷冻待测。
1.2 仪器及主要设备
Waters e2695型高效液相色谱仪(美国)配有二极管阵列检测器(PDA)(Waters 2998)和色谱工作站;超纯水净化仪(611XW-80A,Sartorius公司);超声萃取仪(昆山禾创超声仪器有限公司);0.22μm微孔滤膜(天津津腾科技有限公司)。
1.3 试剂与标准品
磷脂酰胆碱(99%,美国Sigma-Aldrich公司);甲醇(色谱纯);磷酸(分析纯);1% 磷酸溶液。
1.4 标准溶液
标准贮备液:准确称取磷脂酰胆碱标准品,用甲醇溶解,终浓度为25mg/mL。
工作曲线系列溶液:准确量取一定体积的标准储备溶液,用甲醇稀释,得到标准物质质量浓度分别为250、500、1 000、1 500、2 000μg/mL标准系列溶液。
1.5 试验方法
1.5.1 试液制备 准确称取1.000g冷冻大麦虫幼虫于50mL离心管中,加入10mL甲醇于离心管中,然后在10 000r/min转速下高速匀浆2 min后,超声提取10min(超声萃取仪中需放入适量冰块,避免水温升高),于预冷过的4℃下的冷冻离心机中以5 000r/min离心10min,取上清液通过0.22μm滤膜后上机测定。
1.5.2 色谱条件 色谱柱采用zorbox Rx-sil(5μm,150mm×2.1mm i.d);流速为0.5mL/min;柱温为30℃;流动相为 甲醇∶1% 磷酸溶液(50∶1)等度洗脱;检测波长为205nm;进样量为20μL;数据采集时间10min。
2 结果与分析
2.1 色谱条件的选择
通过比较不同色谱柱对目标化合物的保留性,以及色谱锋形状等参数,最终确定选择zorbox Rx-sil(5μm,150mm×2.1mm i.d)色谱柱。流动相选择甲醇∶1% 磷酸溶液(50∶1)等度洗脱,目标化合物有较好的峰形,色谱图如图1所示。

图1 500μg/mL磷脂酰胆碱标准溶液色谱图 Fig.1 The chromatogram of 500μg/mL phosphatidylcholine standard solution.
2.2 仪器方法的精密度实验
选择质量浓度500μg/mL标准溶液重复进样7针,计算保留时间和峰面积的相对标准偏差。结果表明,磷脂酰胆碱保留时间为2.983min,变异小于0.1%,峰面积的变异小于1.5%,说明本方法所选择的仪器条件有较好的测量精密度。
2.3 工作曲线的测定
工作曲线系列溶液按照选定的色谱条件上机,以浓度为横坐标,峰面积为纵坐标绘制标准曲线,线性方程为y=2.784e+5+1.148e+4,相关系数R2=0.999 6。结果表明,在250~2 000 μg/mL浓度范围内呈良好的线性相关(图2)。

图2 磷脂酰胆碱标准曲线图 Fig.2 The standard curve of phosphatidylcholine.
2.4 方法的回收率及精密度试验
选用已知磷脂酰胆碱含量的大麦虫样品,分别以1.0g/kg、4.0g/kg和8.0g/kg质量浓度梯度加入磷脂酰胆碱标准品,每梯度做3个重复,以外标法定量,测定加标回收率及方法的重复性(见表1),色谱图如图3所示。结果表明,加标回收率在97%~109%之间、相对标准偏差小于2.4%,说明此方法的回收效率和精密度可以满足实际样品的检测需求。
2.5 不同生长阶段大麦虫磷脂酰胆碱含量比较
选择幼虫至成虫不同生长阶段的大麦虫,分成12组,每组设3个重复。1组日龄最短,个体重量最小,12组日龄最长,个体重量最大。分别测定12组大麦虫磷脂酰胆碱含量,结果见图4。
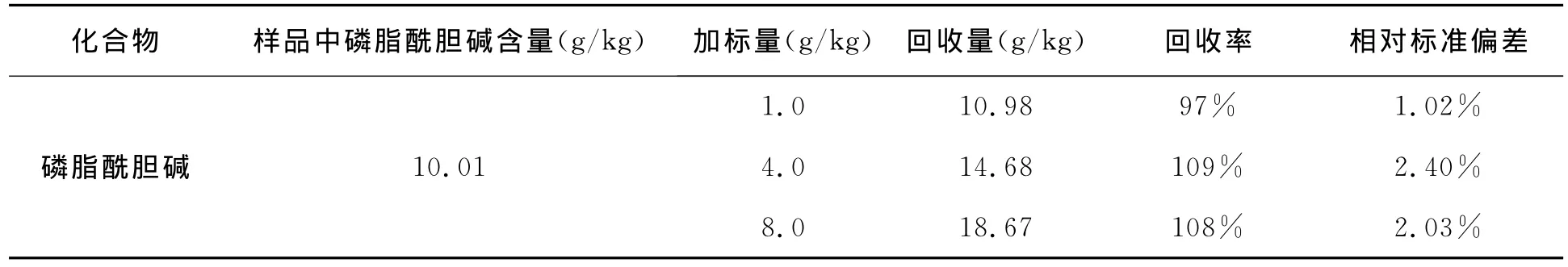
表1 回收率实验结果(n=3) Table 1 The results of the recovery experiment(n=3).

图3 大麦虫样品磷脂酰胆碱色谱图 Fig.3 The chromatogram of phosphatidylcholine in Zophobsmorio L.

图4 大麦虫体重与其体内磷脂酰胆碱含量的关系 Fig.4 The correlation between weight and the phosphatidylcholine levels of Zophobsmorio L.
由实验结果可见,不同个体重量的大麦虫体内磷脂酰胆碱含量在8.65~14.80g/kg之间,在大麦虫幼虫生长的前期和中期,随着日龄的增长、体重的增加,大麦虫体内磷脂酰含量呈降低的趋势,在达到0.64g时磷脂酰胆碱含量最低(8.65g/kg),但在大麦虫幼虫生长的后期,其体内磷脂酰胆碱的含量略有回升。
利用SPSS软件对体重与磷脂酰胆碱含量间的关系进行回归分析结果显示,体重与磷脂酰胆碱含量间呈显著相关,其变化规律符合二项式曲线,相关系数R2=0.865,P<0.01,结果如表2所示。

表2 体重与磷脂酰胆碱含量间的关系回归分析 Table 2 The regression analysis of the relationship between weight and the content of phosphatidylcholine.
3 讨论
大麦虫是一种新型资源昆虫,其体内富含多种功能性成分,日益受到食品、饲料以及医药加工领域的关注。磷脂酰胆碱是大麦虫体内一个功能性活性成分,其检测方法的研究和含量的测定,对大麦虫资源的功能开发是非常必要的。本研究采用高效液相色谱法测定大麦虫体内磷脂酰胆碱的含量。研究中对色谱条件进行了优化,其线性范围、线性相关等参数可满足生大麦虫体内磷脂酰胆碱含量的检测需求,方法的回收率和精密度好,前处理方法简单易行。
本研究采用所建立的方法对不同生长阶段大麦虫体内磷脂酰胆碱含量进行了测定。结果表明,大麦虫体内磷脂酰胆碱含量随个体重量的变化符合二项式曲线的变化规律,相关系数R2=0.865(P<0.01),在体重为0.02g时有最高值14.80g/kg,在体重达到0.64g时磷脂酰胆碱含量最低为8.65g/kg,但在大麦虫幼虫生长的后期略有回升,在体重为0.82g时磷脂酰胆碱含量为9.51g/kg,此时将大麦虫幼虫加工成产品,可以使产品具有较高的磷脂酰胆碱含量。另外,磷脂酰胆碱是重要的生命基础物质之一,监测磷脂酰胆碱在体内含量的变化对于指示大麦虫的生长发育状况也有着重要意义。
[1] 喻锦秀,张 炬,胡拥军.大麦虫的人工繁育技术[J].湖南林业科技,2011,38(1):51-52.
[2] 苗少娟.大麦虫Zophobasmorio的生物学特性及其对塑料降解作用的研究[D].陕西 杨凌:西北农林科技大学,硕士学位论文,2010.
[3] 刘高强,魏美才,王晓玲,等.稀碱法提取昆虫马尾松毛虫幼虫中蛋白质的研究[J].食品科技,2006,(5):57-59.
[4] 吴时敏,裘爱泳.昆虫功能性脂质与油脂的开发[J].天然产物研究与开发,2000,13(1):52-55.
[5] 杨 青,刘高强,魏美才.昆虫油脂的营养和开发研究[J].食品科技,2008,(3):246-249.
[6] 杨文梅,井志胜,马廷军,等.卵磷脂的提取及检测研究进展[J].农产品加工,2012,(10):98-102.
[7] 董翠红,李 密,李永平.壳聚糖磷脂酰胆碱对轻度认知功能障碍患者事件相关电位N270的影响[J].山东医药,2010,50(41):42-43.
[8] 刘保连,张国高,宋忠发,等.卵磷脂与脑磷脂对染尘肺泡巨噬细胞的影响[J].同济医科大学学报,1990,19(19):19-21.
[9] Canty D J,Zeisel S H.Lecithin and choline in human health and disease[J].Nutri.Rev.,1994,52(10):327-339.
[10] Buchman A L.Lecithin increase plasma free choline and decrease hepatic steatosis in long-term total parenteral nutrition patients[J].Gastroenterology,1992,102(4):1363-1370.
[11] Liebe C S,Robins S J,Li J J.Phosphatidylcholine protects against fibrosis and cirrhosis in the baboon[J].Gastroenterology,1994,106(1):152-159.
[12] 马挺军,秦晓健,贾昌喜.大豆卵磷脂的研究概况[J].农产品加工,2009,(10):55-57.
[13] 胡小中.磷脂酰胆碱的生理功能和作用机理[J].粮油食品科技,2011,19(4):42-44.
[14] 关 明,李 燕,赵淑贤.紫外分光光度法测定卵磷脂胶囊中的磷脂酰胆碱[J].中国酿造,2008,(12):95-96.
[15] 庞玉珍,王玉静.速溶奶粉中卵磷脂含量的测定[J].中国乳品工业,1998,26(3):46-47.
[16] 黄岛平,莫建光,劳燕文,等.紫外分光光度法测定脑维营养麦片中的卵磷脂[J].光谱实验室,2001,18(3):298-299.
[17] 刘伟娟,张均媚,薛 刚.乳粉中卵磷脂含量的测定[J].食品研究与开发,2005,26(1):139-140.
[18] 刘鹏莉,张双灵,魏玉良,等.分光光度法测定大豆卵磷脂中磷脂酰胆碱含量[J].食品安全质量检测学报,2013,(4):555-562.
[19] 徐桂云,常理文.大豆磷脂组成的薄层色谱分析[J].分析化学,1998,26(1):81-84.
[20] 马 辰,段宏瑾.大豆磷脂中磷脂类成分的含量测定[J].中国中药杂志,1999,24(11):671-672.
[21] 宋斯贞.四环素-铕与卵磷脂的相互作用及卵磷脂的测定[J].分析试验室,2008,27(5):109-111.
[22] Sala Vila A,Castellote-Bargallo A I,Rodriguez-Palmero-Seuma M.et al..High performance liquid chromatography with evaporative light-scattering detection for the determination of phospholipid classes in human milk,infant formulas and phospholipid sources of long-chain polyunsaturated fatty acids[J].J.Chromatogr.A,2003,1008(1):73-80.
[23] 龚 雁,王巧娥,杨 屹,等.高效液相色谱-蒸发光散射检测法测定蛋黄卵磷脂的含量[J].色谱,2006,24(4):373-375.
[24] 王 飞,农云军,苏流坤,等.高效液相色谱法测定奶粉中卵磷脂的质量分数[J].中国乳品工业,2011,39(3):53-55.

