大鼠脑缺血再灌注损伤后莴苣苷B对皮质Grp78和Caspase-3 mRNA表达的影响
牛秉轩,司艳莉,詹合琴*,闫福林
(1.新乡医学院药学院,河南新乡 453003;2.新乡医学院基础医学院,河南新乡 453003)
缺血性脑血管疾病是临床上的多发病和常见病,目前临床对于缺血性脑血管疾病的治疗主要是通过溶栓疗法来恢复脑血流灌注,但再灌注会引起更大的损伤。高翅果菊Pterocypsela elata,菊科翅果菊属植物,中国大陆很多省份均有分布,其中莴苣芮 B(lactuside B,3β-葡萄糖-14-羟基-11β,13-二氢木香烯内酯)是本类植物中的主要化学成分之一。本研究小组前期从高翅果菊中提取到的莴苣苷B具有明显的抗脑缺血作用[1-2],但国内外对其作用机制研究相对较少。以往报道显示,脑缺血再灌注损伤与Grp78(glucose regulated protein,葡萄糖调节蛋白78)和Caspase-3的激活有关,上调Grp78 mRNA和下调Caspase-3 mRNA的表达水平能有效地保护神经元,那么莴苣苷B对脑缺血再灌注损伤的保护作用是否与Grp78 mRNA和Caspase-3 mRNA的表达有关是本研究拟探讨的问题。
1 材料与方法
1.1 材料 Eppendorf AG PCR扩增仪 (德国Eppendorf公司);DYY-7C型水平电泳仪 (北京市六一仪器厂);TGL-16G-A台式高速低温离心机 (上海安亭科学仪器厂);UV-2102PC紫外分光光度计(尤尼柯上海仪器有限公司);SANYO MDFU4086S超低温冰箱 (日本 SANYO公司);TOCAN240凝胶成像系统 (上海领成生物科技有限公司);莴苣苷B由药物化学教研室闫福林教授提供,为白色粉末状 (纯度>99.9%);阳性对照药尼莫地平注射液 (山东方明药业股份有限公司,4 mg/20 mL,20 mL/支);DL2000DNA Marker(北京天根生化有限公司);Trizol(美国Invertrogen公司);loading buffer和RT-PCR试剂盒 (宝生物工程大连有限公司,TaKaRa Code:DRR014A)。
1.2 动物实验 1)选用清洁级SD(Sprague-Dawiey)雄性大鼠 (郑州大学医学院实验动物中心,体质量260~300 g,动物合格证号 SYXK(豫)2005-0012)。2)大鼠腹腔注射 (大鼠腹腔注射量为0.5~1 mL/100 g)[3],按0.5 mL/100 g计算,称取300 mg莴苣苷B溶入30 mL蒸馏水中,配成莴苣苷B高剂量组所用药液 (50 mg/kg),再抽取高剂量组液体10 mL对倍稀释配成中剂量组所用药液20 mL(25 mg/kg);最后再抽取中剂量组液体10 mL对倍稀释配成低剂量组所用药液(12.5 mg/kg)。3)随机分为6组,即假手术组、模型组、阳性对照组 (1 mg/kg)、莴苣苷B低剂量组 (12.5 mg/kg)、莴苣苷 B中剂量组 (25 mg/kg)、莴苣苷B高剂量组 (50 mg/kg),8只/组。4)制备大脑中动脉缺血再灌注损伤模型。选用1.5号渔线 (DaDong Yang生产)制备阻塞线,每根剪成5~6 cm长,将其一端用火烧成圆形,在1%的肝素溶液中浸泡备用。10%的水合氯醛麻醉动物后,参照Longa[4]线栓法制备大鼠大脑中动脉缺血再灌注损伤模型,每组动物于再灌后按5 mL/kg腹腔注射给药,2次/d。分别于缺血再灌注24 h和72 h后处死动物,收取标本进行实验。
1.3 RNA提取 1)提取组织在液氮中研磨,每100 mg组织加1 mL Trizol进行匀浆处理。2)在裂解液中每1 mL Trizol加入0.2 mL三氯甲烷,剧烈震荡几秒后室温放置10 min。3)5℃下12000×g离心20 min,取上清,每1 mL Trizol加入0.5 mL异丙醇,混匀后室温下放置10 min。4)5℃下12000×g离心10 min,去上清,每1 mL Trizol加入1 mL 75%乙醇洗涤RNA沉淀,25℃干燥约5 min,溶于适量无RNase的水;紫外分光光度法测定RNA的浓度与纯度,-70℃保存。
1.4 RT-PCR法检测Grp78、Caspase-3基因的转录水平 cDNA模板用TaKaRa pimeScript TM RT-PCR试剂盒合成,并进行扩增。PCR反应条件为:95℃ 5 min;95℃ 30 s,55℃ 30 s,72℃ 1 min,30个循环;72℃ 10 min,引物见表1。PCR反应产物进行琼脂糖凝胶电泳。采用Quantity One图像分析系统分析各个条带的灰度值,以扩增后的特异性目的片段灰度值与同时扩增的β-actin片段灰度值相比,其比值作为特异性扩增目的片段的半定量检测值。每组每只动物重复3次求其平均值。
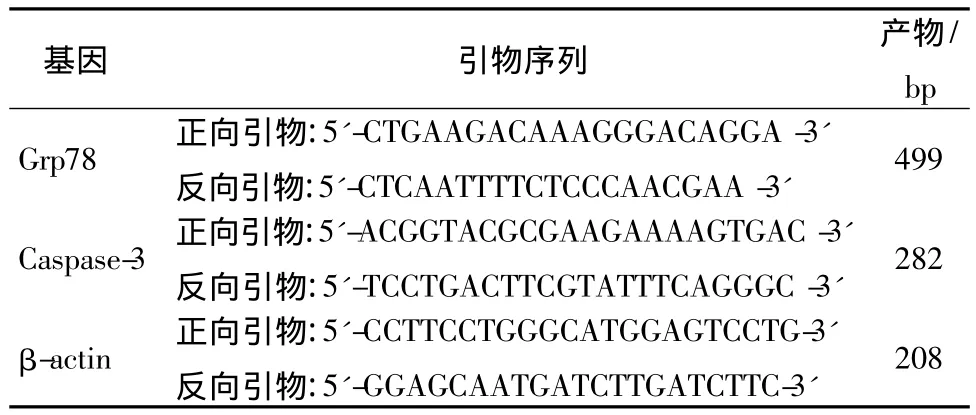
表1 Grp78、Caspase-3和β-actin的上、下游引物Tab.1 Upstream and downstream primers sequence of Grp78,Caspase-3 and β-actin
2 结果
2.1 莴苣苷B对大鼠脑缺血再灌注损伤后不同时间点皮质Grp78 mRNA的影响 结果如表2和图1所示:模型组动物皮质的Grp78 mRNA表达增多,与假手术组比较有显著性差异 (P<0.01);用药后莴苣苷B各剂量组动物皮质的Grp78 mRNA表达明显增多,与模型组和阳性对照药组比较均有显著性差异 (P<0.05,P<0.01),中剂量组作用较其他剂量组好;用莴苣苷B 72 h后Grp78 mRNA在皮质的表达低于用药24 h(P<0.01)。
表2 莴苣苷B对大鼠脑缺血再灌注损伤后皮质Grp78 mRNA的影响 (,n=8)Tab.2 Effects of lactuside B on Grp78 mRNA for cerebral cortex after brain ischemia injury in rats(x ± s,n=8)
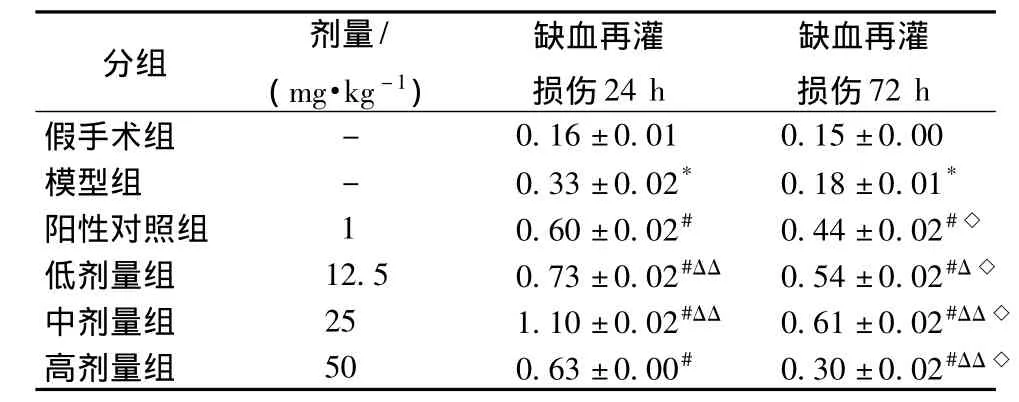
表2 莴苣苷B对大鼠脑缺血再灌注损伤后皮质Grp78 mRNA的影响 (,n=8)Tab.2 Effects of lactuside B on Grp78 mRNA for cerebral cortex after brain ischemia injury in rats(x ± s,n=8)
注:模型组与假手术组比较,*P<0.01;用药组与模型组比较,#P<0.01;再灌72 h与24 h之间的比较,◇P<0.01;莴苣苷B各剂量组与阳性对照药比较,△P<0.05,△△P<0.01
72 h分组 剂量/(mg·kg -1)缺血再灌损伤24 h缺血再灌损伤假手术组0.16±0.01 0.15±0.00模型组 - 0.33±0.02* 0.18±0.01*阳性对照组 1 0.60±0.02# 0.44±0.02#◇低剂量组 12.5 0.73 ±0.02#ΔΔ 0.54 ±0.02#Δ◇中剂量组 25 1.10 ±0.02#ΔΔ 0.61 ±0.02#ΔΔ◇高剂量组 50 0.63±0.00# 0.30±0.02#ΔΔ◇-
2.2 莴苣苷B对大鼠脑缺血再灌注损伤后不同时间点皮质Caspase-3 mRNA的影响 结果如表3和图2所示:模型组动物皮质的Caspase-3 mRNA表达增多,与假手术组比较有显著性差异 (P<0.01);用药后莴苣苷B各剂量组动物皮质的Caspase-3 mRNA表达明显减少,与模型组和阳性对照药比较均有显著性差异 (P<0.05,P<0.01),但低剂量组的作用不如中高剂量组;用莴苣苷B 72 h后Caspase-3 mRNA在皮质的表达低于用药24 h(P<0.01)。
3 讨论
脑缺血再灌注损伤是临床上导致脑细胞凋亡的常见原因。细胞凋亡是基因严格调控而发生的自主性细胞有序死亡,研究发现细胞凋亡主要和内质网应激、线粒体凋亡途径和膜死亡受体通路等有关。
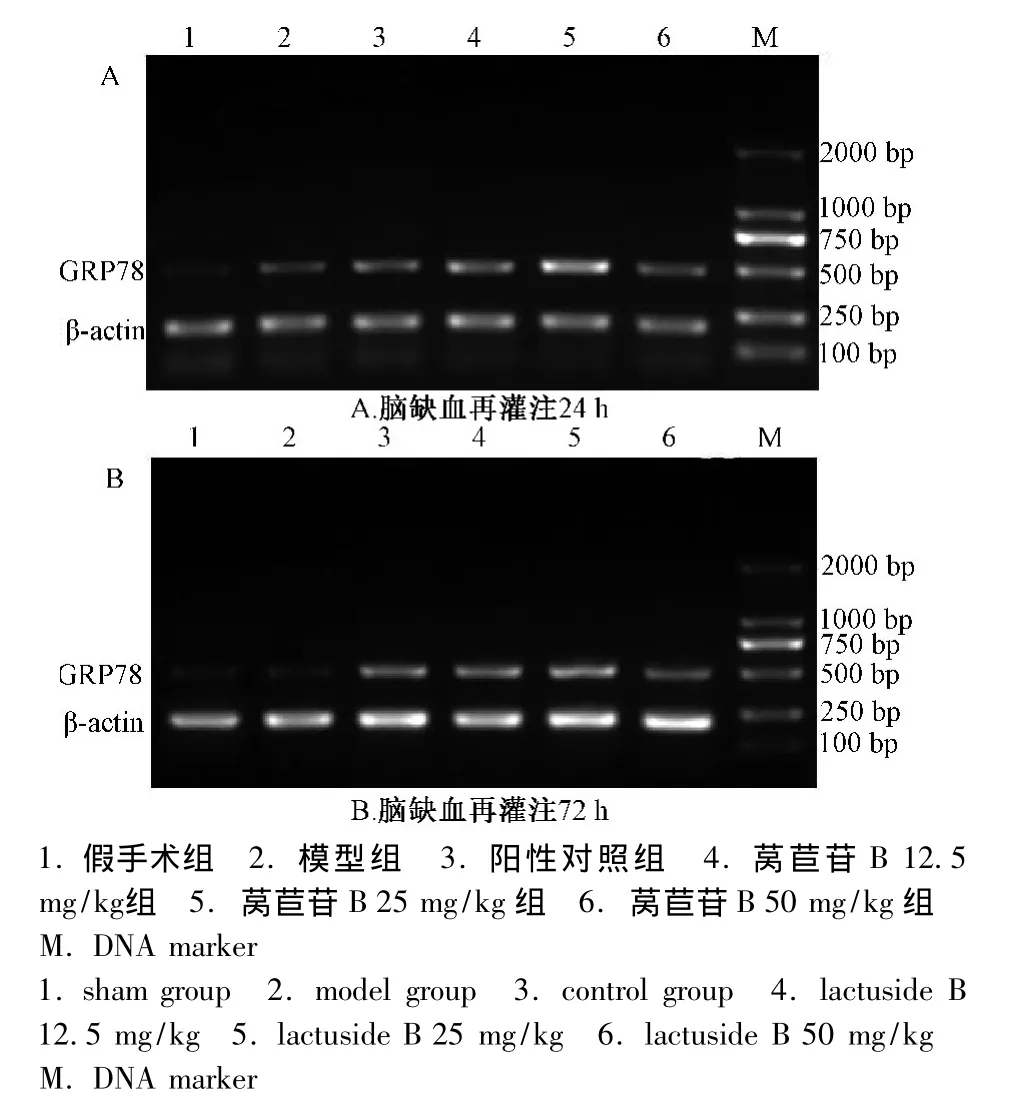
图1 莴苣苷B对大鼠脑缺血再灌注损伤后皮质Grp78 mRNA的影响 (,n=8)Fig.1 Effects of lactuside B on Grp78 mRNA for cerebral cortex after brain ischemia reperfusion injury in rats(,n=8)
表3 莴苣苷B对大鼠脑缺血损伤后皮质Caspase-3 mRNA的影响 (,n=8)Tab.3 Effects of lactuside B on caspase-3 mRNA for cerebral cortex after brain ischemia injury in rats(,n=8)

表3 莴苣苷B对大鼠脑缺血损伤后皮质Caspase-3 mRNA的影响 (,n=8)Tab.3 Effects of lactuside B on caspase-3 mRNA for cerebral cortex after brain ischemia injury in rats(,n=8)
注:模型组与假手术组比较,*P<0.01;用药组与模型组比较,#P<0.05,##P<0.01;莴苣苷B各剂量组与阳性对照药比较,△P<0.05,△△P<0.01;再灌72 h与24 h之间的比较,◇P<0.01
72 h假手术组分组 剂量/(mg·kg -1)缺血再灌损伤24 h缺血再灌损伤- 0.17±0.01 0.18±0.00模型组 - 0.53±0.02* 0.56±0.02*阳性对照组 1 0.46±0.02 0.30±0.01##◇低剂量组 12.5 0.42±0.01# 0.29±0.01##◇中剂量组 25 0.39±0.02##Δ 0.23±0.01##ΔΔ◇高剂量组 50 0.32±0.02##ΔΔ 0.20±0.02##ΔΔ◇
葡萄糖调节蛋白78(glucose regulated protein,Grp78)是热休克蛋白70(Hsp70)的成员之一[5],也是内质网的伴侣蛋白,它对内质网应激(endoplasmic reticulum stress,ERS)有着重要的缓解作用,Grp78可与内质网中的未折叠蛋白或错误折叠蛋白结合,从而恢复蛋白质的正确构象,维持细胞的内环境稳定[6]。有报道,脑缺血后内质网应激的经典标志物Grp78会大量的表达[7-8]。脑缺血损伤时,脑组织中的钙失衡、缺氧和自由基增多等因素可诱发内质网功能障碍,产生内质网应激,激活未折叠蛋白反应,未折叠蛋白反应可使Grp78大量表达[9-10]。Grp78在脑缺血再灌注损伤后脑组织中的大量表达,不仅提示出缺血再灌注损伤可激活神经细胞内质网的应激状态,也提示了Grp78可能在应激状态下对受到损害的神经细胞起着积极的保护作用。

图2 莴苣苷B对脑缺血再灌注损伤大脑皮质Caspase-3 mRNA的影响 (,n=8)Fig.2 Effects of lactuside B on Caspase-3 mRNA for cerebral cortex after brain ischemia reperfusion injury in rats(,n=8)
本实验研究发现,在对大鼠脑部行缺血再灌注术24 h后,模型组大鼠脑皮质的Grp78 mRNA表达均成上升趋势,但随着时间的进一步的延长,表达逐渐减少,在再灌损伤72 h时Grp78 mRNA的表达均出现明显的下降。正常神经细胞内Grp78与Caspase-7,12等蛋白形成大分子复合物,在缺血损伤时,神经细胞内质网发生改变触发应激反应,该反应激活一系列的生化反应,Grp78因此从复合物中分离出来,游离量的增加使得膜蛋白激酶IRE1和PERK的活性增强,这些酶的活性增强对细胞内质网的稳定起到了一定的保护作用[11]。但过长时间或是过大强度的应激反应反而使得内质网稳定性减弱,Grp78的表达量减少,激活细胞内质网凋亡通路,导致神经细胞死亡,缺血损伤症状加重。换言之应激反应的过度表达可引起相关蛋白Grp78的表达减少。
研究结果显示,给实验动物腹腔注射莴苣苷B 24 h和72 h后,大鼠皮质的Grp78 mRNA表达均增加,中剂量组在24 h和72 h时间点的作用均明显超过了阳性对照药组 (P<0.01),低、中、高剂量组在72 h的作用超过阳性对照药组 (P<0.05),因此用药72 h的作用优于24 h且中剂量组优于其他剂量组。但是莴苣苷B各剂量组对皮质Grp78 mRNA表达的作用效果并非完全一致,不同剂量所产生的作用效果也不相同,该单体化合物的中、低剂量对大鼠皮质抗脑缺血作用较好。实验结果提示出脑缺血损伤后Grp78 mRNA在动物脑组织的高水平表达只能维持很短时间,不易对受损的神经细胞起到长时间的保护作用,而给予单体化合物莴苣苷B后,大鼠脑部不同部位的Grp78 mRNA表达均有延时性的增加,从而起到抗脑缺血损伤作用。以往研究显示,Grp78在脑缺血损伤后的脑组织中表达增多,但同种动物如新生鼠和成年鼠的鼠龄差异或在脑内研究部位的差异其达峰时间有较大的不一致性[12-13]。一般情况下,Grp78在脑缺血损伤12 h后达到高峰,此后逐渐下降[14],本实验结果与其报道的基本一致。可见,短时的Grp78高表达能够增强内质网的保护作用,但这种保护作用十分有限,随着脑缺血损伤时间的延长,损伤程度加剧,Grp78表达降低,由此产生的保护作用减弱。本实验中,莴苣苷B可以使Grp78在脑缺血损伤后的皮质中增加表达,且能维持一定的时间,提示了莴苣苷B能够在一定时间内保持脑组织中Grp78的表达处在一个较高的水平,这种持续性的高表达能够调整脑缺血损伤后神经细胞的内质网功能,产生保护作用。
近年来的研究发现,参与细胞凋亡的多种通路中的线粒体细胞色素C通路是其中的一条重要通路,而Caspase-3蛋白在该通路中起到枢纽的作用,是神经细胞缺血损伤发展过程中的一个关键蛋白[6,15]。对于缺血再灌注引起的刺激,神经细胞产生应激反应,这些反应通过信号系统传递给细胞内线粒体,引起细胞色素C的释放,细胞色素C与胞浆中的Apaf-1相互作用,又使得Caspase-9前体活化。多种影响因子的活化以及相互作用,激活了Caspase-3蛋白,最终引起了能够使细胞死亡的级联反应。
本研究结果显示,脑缺血再灌注损伤后,模型组动物皮质的Caspase-3 mRNA表达均增加,说明损伤引发了Caspases级联反应,细胞凋亡增加。动物腹腔注射莴苣苷B 24 h和72 h后,大鼠皮质的Caspase-3 mRNA表达均降低,各剂量组作用超过了阳性对照药,尤其以中、高剂量组作用较好,且用药72 h的作用优于24 h。莴苣苷B各剂量组作用的差异性可能是由于药物剂量设置不够适当所致。莴苣苷B可以抑制脑缺血再灌注引起的Caspase-3 mRNA的表达降低。进一步可以说明莴苣苷B通过抑制脑缺血再灌注损伤引起的脑细胞线粒体凋亡途径来发挥大脑保护作用。
脑缺血再灌注损伤后,大脑皮质细胞死亡不仅影响患者的神经功能,甚至还能威胁患者的生命。以往的研究表明,小鼠和人类细胞死亡过程中内质网应激和线粒体凋亡有协同作用[16-17],Rizzuto等[18]报道内质网与线粒体之间存在很多紧密联系,内质网InsP3/Ca2+通道的开放影响线粒体钙离子的平衡,InsP3/Ca2+通道又是Caspase-3的作用靶标之一。在大脑缺血再灌注损伤中,内质网过度应激也可能涉及与线粒体及细胞色素C的协同作用,从而引发Caspases级联反应和细胞凋亡。莴苣苷B对脑缺血损伤后不同时间点皮质Grp78 mRNA和Caspase-3 mRNA表达改变的结果,进一步说明莴苣苷B可以抑制脑缺血-再灌注引起的内质网应激以及线粒体凋亡。这对于将莴苣苷B作为一种抗脑缺血再灌注损伤的临床治疗药物进行研发有着理论支持和积极意义。
[1]詹合琴,郭兰青,崔建敏,等.高翅果菊化学成分及lactuside B的抗脑缺血活性研究[J].中草药,2010,41(5):692-696.
[2]李生莹,孙 娟,牛秉轩,等.Lactuside B对大鼠脑缺血再灌注损伤大脑皮质bcl-2、bax mRNA及其蛋白表达的影响[J].药学学报,2011,46(11):1314-1320.
[3]陈 奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:106-107
[4]Longa E Z,Weinstein P R,Carlson S.Reversible middle cerebral artery occlusionwithout craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5]Ortiz C,Cardemil L.Heat-shock responses in two leguminous plants:a comparative study[J].Exp Bot,2001,52(361):1711-1719.
[6]Shibata M,Hattori H,Sasaki T,et al.Activation of Caspase-12 by endoplasmic reticulum stress induced by transient middle cerebral artery occlusion in mice[J].Neuroscience,2003,118(2):491-499
[7]Tajiri S,Oyadomari S,Yano S,et al.Ischemia-induced neuronal cell death is by the endoplasmic reticulum stress pathway involving chop[J].Cell Death Differ,2004,11(4):403-415
[8]Li F,Hayashi T,Jin G,et al.The protective effect of dantrolene on ischemic neuronal cell death is associated with reduced expression of endop lasmic reticulum stress markers[J].Brain Res,2005,1048(1/2):59-68.
[9]Raghubir R,Nakka V P,Mehta S L.Endoplasmic reticulum stress in brain damage [J].Methods Enzymol,2011,489:259-275.
[10]Nakka V P,Gusain A,Raghubir R.Endoplasmic reticulum stress plays critical role in brain damage after cerebral ischemia/reperfusion in rats [J].Neurotox Res,2010,17(2):189-202.
[11]Schneeloch E,Wenkel S,Mies G,et al.Spreading depression activates unfolded protein response[J].Neurosci Lett,2004,368(1):37-40.
[12]Luo L L,Xiong Y,Wang H Q.Expression of Grp78 and Caspase-12 in neonatal rats with experimental hypoxic-ischemic white matter damage[J].Chin J Contemp ediatr,2009,11(8):691-694.
[13]宋小燕,赵永波,周晓琳,等.大鼠脑缺血再灌注后Grp78和GADD153的表达变化研究[J].中风与神经疾病杂志,2008,25(2):139-141.
[14]Shibata M,Hattori H,Sasaki T,et al.Activation of Caspase-12 by endoplasmic reticulum stress induced by transien tmiddle cerebral artery occlusion in mice[J].Neuroscience,2003,118(2):491-499.
[15]Hayashi T,Saito A,Okuno S,et al.Damage to the endoplasmic reticulum and activation of apoptotic machinery by oxidative stress in ischemic neurons[J].J Cereb Blood Flow Metab,2005,25(1):41-53.
[16]Wei M C ,Z ong W X,Cheng E H.Proapoptotic BAX and BAK:a requisite gateway to mitochondrial dysfunction and death[J].Science,2001,292(5517):727-730.
[17]Xie Q ,Khaoustov V I,Chung C C ,et al.Effect of taurours odeoxycholic acid on ER stress-induced Caspase-12 activation[J].Hepatology,2002,36(3):592-601.
[18]Rizzuto R ,Pinton P,Carrington W,et al.Close contacts with the endoplasmic reticulum as determinants of mitochondrial Ca2+responses [J]. Science, 1998, 280(5370):1763-1766.

