乙二醇对木瓜蛋白酶催化活性的影响
初志战,巫光宏,黄卓烈
(华南农业大学 生命科学学院,广东省农业生物蛋白质功能与调控重点实验室,广东 广州 510642)
木瓜蛋白酶具有很强的蛋白水解催化活性,提取简便,产量较高,因此被广泛应用于工业、农业、医药等多个行业。非水相酶催化在二十世纪五十年代就开始有相关研究,至八十年代,这一领域的研究受到广泛关注[1]。据统计,二十世纪九十年代初全世界的需求量就已达到650 t/年。研究表明,酶在有机介质中的催化反应有很多优点,为许多研究或生产提供了新的方法和手段[2-5],尤其是在非水介质中定向催化合成酯类反应。水可溶性有机溶剂对木瓜蛋白酶的影响研究不多,在甲醇、乙醇中有报道[6]。目前有关木瓜蛋白酶在乙二醇溶液中的催化活性及构象的变化情况未见报道。本研究对木瓜蛋白酶在乙二醇体系中催化水解酪蛋白的活力变化、动力学参数及构象变化进行探讨分析,以期为酶活力变化与酶空间结构的对应关系研究提供参考。
1 材料与方法
1.1 材料
实验采用的木瓜蛋白酶粗酶(部分纯化)、木瓜蛋白纯酶(结晶)、酪蛋白购于美国Sigma公司;考马斯亮蓝G250购于Fluka公司;L-cys、乙二醇为国产分析纯试剂。
1.2 方法
蛋白质含量测定采用考马斯亮蓝法。木瓜蛋白酶活性测定与动力学测定参考方焕等[7]的方法。一个木瓜蛋白酶活力单位(U)为温度37 ℃,pH 7.0条件下,每分钟分解酪蛋白产生1 µg酪氨酸的酶量。
酶的紫外差示光谱用UV-2401pc紫外光谱仪测定。扫描波长范围为190~300 nm,测定温度37 ℃。荧光发射光谱用F-4500荧光光谱仪测定,天然酶荧光激发波长280 nm,测定温度37 ℃。
2 结果与分析
2.1 乙二醇对木瓜蛋白酶活力的影响
将木瓜蛋白酶在磷酸缓冲溶液(PBS)中预处理10 min,然后在不同浓度乙二醇体系中反应,检测乙二醇对酶活力的影响。从图1可见,乙二醇能强烈抑制酶活性:当反应体系中乙二醇浓度为10%时,木瓜蛋白酶酶活降低约43%,当反应体系中乙二醇浓度达40%时,木瓜蛋白酶酶活仅剩约25%。
2.2 木瓜蛋白纯酶在乙二醇体系中的反应动力学测定
乙二醇使木瓜蛋白酶降解酪蛋白的活力下降明显,在10%乙二醇体系中下降效果就非常明显,因此木瓜蛋白酶结晶纯酶水解酪蛋白的动力学测定选在10%乙二醇体系,结果见图2。
根据双倒数作图法分别求出木瓜蛋白结晶纯酶在10%乙二醇体系中水解酪蛋白的Km=1.0 mg·mL-1,Vmax=909.09 U,与在缓冲溶液中水解酪蛋白的Km=2.6 mg·mL-1, Vmax=2000 U相比,木瓜蛋白酶在乙二醇体系中的Km和Vmax都显著下降。
2.3 木瓜蛋白酶在乙二醇体系的紫外差示光谱
图3显示木瓜蛋白酶在10%乙二醇体系中的紫外差示光谱。据图可见,差示光谱在208 nm左右出现明显的正峰,在240 nm附近出现明显负峰,说明木瓜蛋白酶在乙二醇溶液中构象明显发生改变。
2.4 木瓜蛋白酶在乙二醇体系中的荧光发射光谱
木瓜蛋白酶在 10%乙二醇体系中的荧光发射光谱见图 4。由图可见,木瓜蛋白酶在乙二醇体系中的荧光发射峰峰位(339.4)与缓冲溶液(342.4)中相比略有蓝移,发射峰强度明显提高。

图1 木瓜蛋白酶在不同浓度乙二醇中酶活力变化Fig.1 Activity of papain treated with ethylene glycol

图2 木瓜蛋白酶在10%乙二醇溶液中动力学测定 Fig.2 Kinetics of papain with 10% ethylene glycol and phosphate buffer solution
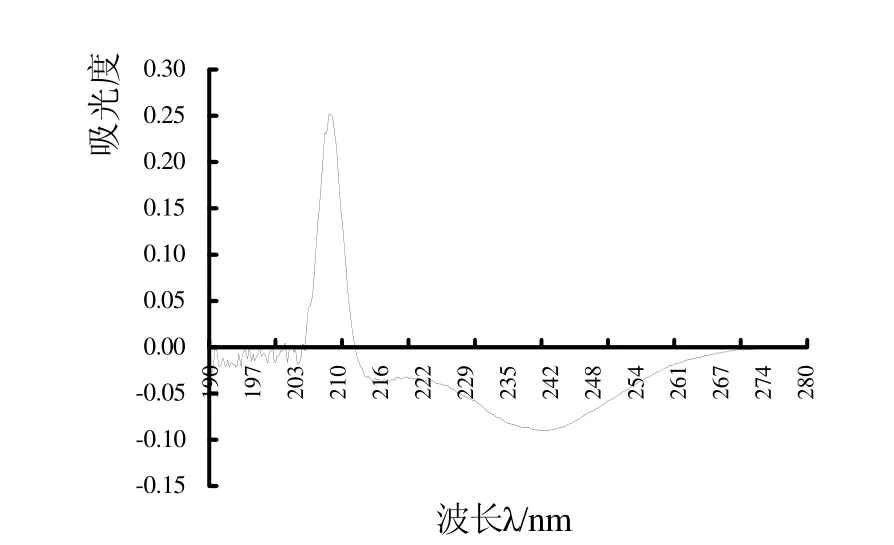
图3 木瓜蛋白酶在10%乙二醇体系的紫外差示光谱Fig.3 Difference ultraviolet spectra of papain with 10% ethylene glycol

图4 木瓜蛋白酶在10%乙二醇体系中的荧光发射光谱 Fig.4 Fluorescence emission spectra of papain with 10% ethylene glycol
3 讨论
木瓜蛋白酶经乙二醇处理后水解酪蛋白活力明显下降,当反应体系中乙二醇浓度达到 40%时,木瓜蛋白酶酶活仅剩大约 25%。经测定动力学参数发现,与磷酸缓冲溶液相比,木瓜蛋白酶在乙二醇体系中的Km和Vmax都显著下降。Km值的下降代表着酶与底物的亲合力提高,但酶活力的降低却表明乙二醇对酶的催化起破坏作用。
木瓜蛋白酶是一单亚基酶,由212个氨基酸残基组成,其二级结构含4个α-螺旋和一个β-折叠,木瓜蛋白酶的酶活性中心由Cys (25)、His(159)和Asp (158)组成。对紫外光的吸收主要是Trp、Tyr、Phe,Trp、Tyr的吸收峰在280 nm;Phe的吸收峰在257 nm。肽基团也可以吸收190~220 nm的紫外光。因此,利用蛋白质中芳香族氨基酸残基具有吸收紫外光从而发射荧光的特性,可研究蛋白质空间构象的改变。陈清西[8]等认为,蛋白质分子的构象变化过程一般包括:⑴寡聚体分子解离为单体;⑵肽链从紧密的三级结构到松散状态;⑶肽链从有序的二级结构(如α-螺旋和β-折叠等)变成无规则线团。由于木瓜蛋白酶为一单亚基酶,因此,酶的构象变化主要表现在后二者的变化过程。
根据蛋白质Trp残基不连续态模型,位于疏水内核的Trp残基发射峰在310 nm附近,位于表面的Trp残基发射峰在350 nm附近。我们用波长280 nm的激发光所得到的340 nm左右的荧光发射光谱主要与Trp残基有关。木瓜蛋白酶在乙二醇中峰位向低波长移动,这表明,木瓜蛋白酶在乙二醇中的Trp残基处于非极性更强的环境中,也可能由于表面 Trp残基在加入有机溶剂后非极性状态有所增加,因此造成发射光谱向低波长移动。由于木瓜蛋白酶中含有很多 Tyr残基,因此,随着有机溶剂的介入可能改变了Tyr、Trp残基的微环境,使得原先Tyr形成的氢键遭到破坏,致使处于淬灭状态的Tyr荧光得以恢复,其量子产率增加。
木瓜蛋白酶在有机溶剂中的差示光谱则进一步解释了构象的变化。Glazer等[9]曾指出,236 nm差吸收的变化可能和蛋白质α-螺旋结构的变化直接相关;许根俊等[10]指出,260、285、292 nm的吸收峰主要与Phe、Tyr和Trp有关。乙二醇体系中木瓜蛋白酶在205~212 nm有强烈正吸收,212~265 nm有明显的负吸收,表明酶主链二级结构在有机溶剂作用下发生了变化。在208 nm左右有强烈正吸收峰,根据陶慰孙[11]的观点,这应表明酶分子趋向无规则卷曲或者β-折叠增加,在240 nm处出现的负峰可能是肽链无规则卷曲减少而α-螺旋增加的结果,但是这些空间构象的改变使酶的催化能力大大降低。
[1] MacNaughtunt M D, Dauglis A D.Importance of enzyme and solvent physical properties for the biocompatibility relationship of A-amino acid ester hydrolase[J].Enzyme Microbial.Technology, 1993,15(2): 114-119.
[2] Bracey E, Stenning R A, Brooker B.Relating the microstructure of enzyme dispersions in organic solvents to their kinetic behavior[J].Enzyme Microbial Technology, 1998,22(3): 147-151.
[3] Diaz-Garcia M E, Valencia-Gonzalez M J.Enzyme catalysis in organic solvents: a promising field for optical biosensing[J].Talanta, 1995,42(11): 1763-1773.
[4] Halling P J.Thermodynamic predictions for biocatalysis in nonconventional media: Theory, tects, and recommendations for experimental design and analysis[J].Enzyme microbial Technology, 1994,16: 178-206.
[5] 卞进发.非水酶催化研究[J].安徽农业科学, 2010,38(8): 3894-3896.
[6] 初志战,黄卓烈,巫光宏,何平,詹福建.甲醇溶液对木瓜蛋白酶催化活性的影响[J].亚热带植物科学, 2005,34(1): 1-4.
[7] 方焕,生吉萍,吴显荣.工业生产中木瓜蛋白酶的活性检测方法比较[J].食品与机械, 2000(6): 27-29.
[8] 陈清西,颜思旭,力政军,乐伟平.果菠萝蛋白酶在有机溶剂中的变性与失活动力学的研究[J].厦门大学学报,1993,32(1): 88-93.
[9] Glazer A N, Smith E L.Studies on the ultraviolet difference spectra of proteins and polypeptides[J].Journal of Biological Chemistry, 1961,236: 2942-2947.
[10] 许根俊,邹承鲁.胰蛋白酶在尿素溶液中的失活与复活的动力学[J].生物化学与生物物理学报, 1963(3): 450-458.
[11] 陶慰孙.蛋白质分子基础[M].北京: 高等教育出版社, 1987: 254-262.

