当归愈伤组织诱导及植株再生研究△
高素芳,张延红
(甘肃中医学院 药学系,甘肃 兰州 730000)
“十二五”国家科技支撑计划课题(2011BAI05B02)
*
张延红,副教授,研究方向:药用植物育种和组织培养;Tel:18909449018,E-mail:hchy456789@163.com
当归愈伤组织诱导及植株再生研究△
高素芳,张延红*
(甘肃中医学院 药学系,甘肃 兰州 730000)
目的探究当归愈伤组织诱导、增殖、胚状体分化和植株再生的条件,为当归工厂化育苗和转基因育种奠定基础。方法以胚轴和子叶为外植体,1/2 MS或MS为基本培养基,添加不同浓度的蔗糖、不同种类和浓度的激素,诱导当归愈伤组织。研究不同的继代方法和次数、ABA、IBA及蔗糖浓度对愈伤增殖和胚状体分化的影响。结果愈伤组织第1~5次的继代及胚状体分化培养基可采用1/2 MS+IBA 2 mg·L-1+3%蔗糖,愈伤组织第6次之后的继代和胚状体分化培养基可采用1/2 MS+IBA 2 mg·L-1+KT 0.2 mg·L-1+3%蔗糖培养基,愈伤组织生长良好,但胚状体的分化量还有待进一步提高。结论建立了较为完善的当归胚状体再生植株的技术体系。
当归;愈伤组织;初代培养;继代培养;胚状体;再生植株
当归是伞形科植物当归Angelicasinensis(Oliv.)Diels的干燥根,是我国常用名贵中药材之一,具有抗缺氧,调节机体免疫、抗癌、护肤美容、补血活血、抑菌、抗动脉硬化等作用[1]。当归喜气候凉爽、湿润的环境,对生长环境有着特殊的要求,其主产地仅为甘肃、云南、青海等省,全国有85%以上的当归产自甘肃[2]。当归生产上常采用育苗移栽,第一年育苗,第二年移栽,第三年进入抽薹开花期,留种。当归育苗要选用生荒地,每年砍林开垦新地,这种育苗方式严重破坏了天然植被,同时还要耗费大量的人力物力。当归的组织培养研究开展较早,已进行了当归不同器官的组织培养得到愈伤组织并再生植株,但仍存在愈伤诱导率和胚状体分化率低或培养方法复杂等问题[3-7]。此外,研究中几乎都采用2,4-D诱导胚性愈伤组织,目前的研究发现2,4-D对人体有毒害作用,应避免使用[8]。本研究首次采用IBA诱导获得当归胚性愈伤组织,诱导率高达100%,胚状体分化量多,再生植株表型正常。因此采用该技术体系可有效地保证用药的安全性。本试验探讨了当归愈伤组织的诱导、增殖和胚状体分化条件,旨在建立良好的当归胚状体再生体系,为当归大规模细胞悬浮培养和工厂化育苗奠定基础。
1 材料与仪器
1.1 材料
采自甘肃岷县的当归种子,经无菌发芽获得小苗。
1.2 试剂
大量元素;微量元素;有机元素;激素及其它化学药品和试剂均为进口或国产分析纯以上。
1.3 仪器
超净工作台(苏州净化SW-SJ-1D);高压灭菌锅(上海申安LDZX-30KBS);人工气候箱(南京贝蒂BD-PGX);酸度计(意大利哈纳HI98127);电子天平(德国赛多利斯BSA623S)。
2 方法
2.1 无菌外植体的获得
将采自岷县的当归种子先用流水冲洗30 min后,置于滤纸上吸干水分后用70%乙醇和0.1%升汞或2%NaClO灭菌不同时间,再用无菌水冲洗3遍,用无菌滤纸吸干种子表面的水分,接种于1/2 MS培养基中,培养30 d后获得当归种子无菌发芽小苗。每处理4瓶,每瓶接种3~4粒种子。
2.2 当归愈伤组织诱导
以2.1项下筛选出的最佳灭菌方法(3号),进行当归种子无菌发芽,以获得的无菌小苗的胚轴和子叶为外植体,MS或1/2 MS为基本培养基,接种到添加IBA、NAA和KT的培养基上诱导获得愈伤组织。每处理4瓶,每瓶接种4~5个外植体,以下试验均与此相同。
2.3 当归愈伤组织的继代培养
将b(MS+IBA 2 mg·L-1+KT 0.2 mg·L-1+蔗糖3%)和a(1/2 MS+IBA 2 mg·L-1+蔗糖3%)培养基中诱导获得的愈伤组织接种于b或a培养基中进行继代培养。
2.4 当归胚状体的分化
以1/2 MS为基本培养基,分别添加不同浓度的蔗糖以及不同浓度ABA和IBA诱导胚状体分化。试验处理:A组:添加1 mg·L-1IBA,设蔗糖浓度3%、5%、7%、9%;B组:蔗糖浓度为3%,添加1 mg·L-1IBA,ABA设定4个浓度梯度:0.5、0.8、1.0、1.5 mg·L-1;C组:蔗糖浓度为3%,IBA设定4个浓度梯度:0.1、0.3、0.5、1.0 mg·L-1;D组:设KT浓度为0.2 mg/L,IBA浓度为0.5 mg·L-1、1.0 mg·L-1和2.0 mg·L-1。培养基中琼脂用量均为7 g·L-1,pH 5.8。对照组:1/2 MS培养基中添加1.0 mg·L-1IBA。
2.5 培养条件
将愈伤组织接种于以上培养基中,放入人工气候箱中进行培养,培养温度为23 ℃,湿度70%,光照时间14 h·d-1,光照强度2 000 lx。
2.3 结果统计
培养30 d后进行观察统计,以污染率、发芽率、愈伤诱导率、愈伤量和颜色、愈伤状态、胚状体分化量等为主要考察指标进行统计。
3 结果与分析
3.1 当归种子无菌发芽
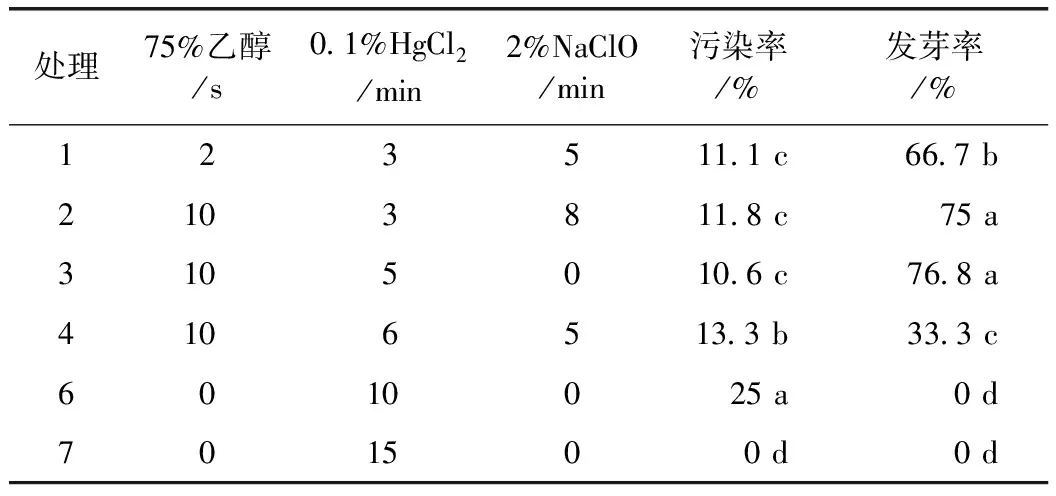
表1 不同灭菌组合对当归种子无菌发芽的影响
注:同列内相同字母表示邓肯氏新复极差检验在P0.05水平上差异不显著。
由表1可知,3号处理效果最好,污染率为10.6%,发芽率高达76.8%,2号处理与3号之间差异不显著。随着HgCl2灭菌时间的延长,种子受到的毒害越大,0.1% HgCl2灭菌15 min,污染率为0,发芽率也为0。因此,当归种子无菌发芽需2种或3种灭菌剂联合使用,否则很难达到理想的灭菌效果。3号处理当归种子约2周后才开始发芽,4周后长成高约4 cm左右,形态正常的小苗,这与普通培养皿发芽相比,开始发芽的时间推迟了一周。
3.2 愈伤组织的诱导(见表2)

表2 不同培养基和外植体类型诱导愈伤和发根的情况
注:愈伤组织量用“+”表示,“+”越多表示量越多;“-”表示无增殖或分化;下同。
由表2可以看出,1/2 MS+IBA 2 mg·L-1或IBA 3 mg·L-1和MS+IBA 2 mg·L-1+KT 0.2 mg·L-1(见图a)培养基中均可诱导产生愈伤组织,较高浓度IBA适于愈伤诱导,愈伤组织量少且呈现土黄色、绵软状。IBA浓度太低,外植体无反应。3 mg·L-1NAA无法诱导外植体产生愈伤。子叶和胚轴相比较,胚轴诱导后产生愈伤和不定根,是较好的外植体,子叶诱导效果普遍不好。

图a 胚轴诱导获得的愈伤组织
3.3 当归愈伤组织的继代培养与胚状体分化(见表3、表4)

表3 当归愈伤组织2次继代后的生长和分化情况
注:“+”代表愈伤量和胚状体的数量,“+”越多,表示数量越多;“-”表示无增殖或分化;下同。

表4 当归愈伤组织3次继代后的生长和分化情况
试验以当归种子发芽小苗为材料来源,以胚轴为外植体,初代培养产生愈伤组织,然后用a或b培养基进行继代培养,结果表明,少量土黄色愈伤组织第一次继代后,普遍生长较缓慢。2次继代后愈伤生长较快,愈伤状态和分化情况差异较大。以当归胚轴为外植体,先在b培养基上诱导产生愈伤组织,然后转入a培养基中继代2次(即b-a-a),产生了一定量的黄白色颗粒状愈伤组织,同时在其表面分化出较多胚状体,并再生植株(见图b)。在b-a-a-a的继代流程中,产生了大量白色颗粒状愈伤组织和胚状体。多数胚状体开始萌发生长,胚根伸长,抽出2~3片绿色真叶,再生试管苗形态和种子发芽小苗相同(见图c)。

图b 2次继代后(b-a-a)的愈伤组织

图c 3次继代后(b-a-a-a)分化出大量的试管苗
在b-b-b和a-a-a的继代流程中,愈伤增殖量不多,呈现白色透明、绵软状。其中a-a-a中有少量胚状体分化。在a-a-a-a的3次继代流程中,愈伤增殖量中等,但胚状体的分化量明显增多。在b-b-b-b的3次继代流程中愈伤增殖量中等,呈现土黄色,疏松颗粒状,并分化出少量芽,无明显的根分化。其原因可能是b培养基中无机盐浓度过高,抑制了根的分化。在愈伤组织培养时普遍表现出培养早期生长速度较慢,随着继代次数的增加,当归愈伤增殖速度加快,约半个月就长满培养基表面,同时胚状体的分化量也明显增多。经过6~7次继代后,愈伤组织颜色由淡黄绿色逐渐转变为淡黄褐色,愈伤增殖速度仍非常快,但胚状体的分化量降低。为了提高胚状体的分化量,又进一步作了以下处理。
3.4 不同蔗糖浓度对当归愈伤组织增殖和胚状体分化的影响(见表5)
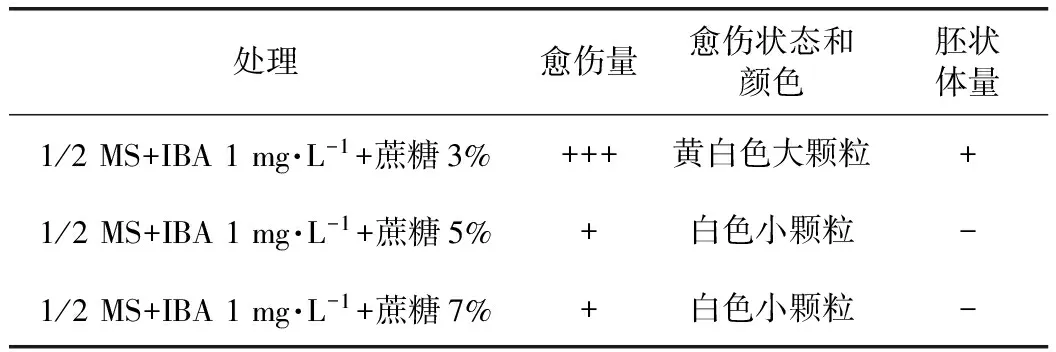
表5 不同浓度蔗糖对当归愈伤组织增殖和胚状体分化的影响
培养基中的蔗糖浓度对当归愈伤组织的增殖和胚状体形成均有显著影响。在高浓度的蔗糖培养基中愈伤颗粒小,增殖量少,未见成熟的胚状体。在3%的蔗糖培养基上,愈伤组织为大颗粒,增殖量多,生长状态良好,同时分化形成了少量胚状体。因此,高浓度的蔗糖浓度反而不利于愈伤组织的增殖和胚状体的诱导分化。
3.5 不同浓度的ABA对当归愈伤组织增殖和胚状体分化的影响(见表6)

表6 不同浓度的ABA对当归愈伤组织增殖和胚状体分化的影响
由表6可知,在添加了IBA的培养基上,同时附加不同浓度的ABA时,当归愈伤组织的增殖量少,呈白色疏松状的颗粒,且均无胚状体的生成。因此,给培养基中加入以上浓度的 ABA并不能促进胚状体的分化,且愈伤组织增殖也受到抑制。
3.6 不同浓度的IBA对当归愈伤组织增殖和胚状体分化的影响(见表7)

表7 不同浓度的IBA对当归愈伤组织增殖和胚状体分化的影响
由表7可知,在添加了3%蔗糖的1/2 MS基本培养基中,加入不同浓度的IBA时,当归愈伤组织的增殖量普遍较多,其中0.3 mg·L-1、0.5 mg·L-1与1.0 mg·L-1IBA培养获得的愈伤量差异不大,呈黄白色疏松颗粒,且生长状况良好,同时也分化形成了少量的胚状体。因此,0.5 mg·L-1和1.0 mg·L-1的IBA有利于当归愈伤组织增殖。
3.7 KT和IBA对当归愈伤组织增殖和胚状体分化的影响(见表8)

表8 KT和IBA对当归愈伤组织增殖和胚状体分化的影响
由表8可知,在添加了0.2 mg·L-1KT的1/2 MS基本培养基中,同时添加不同浓度的IBA,当归愈伤组织的增殖量均很大,呈黄绿色疏松颗粒,生长状态良好。由此说明,0.2 mg·L-1KT能够进一步促进当归愈伤组织增殖,愈伤状态良好,其中1/2 MS+KT 0.2 mg·L-1+IBA 2.0 mg·L-1培养基中愈伤量大,胚状体的分化量相对其它处理较多。愈伤组织第6次之后的继代和胚状体分化培养基可采用1/2 MS+IBA 2 mg·L-1+KT 0.2 mg·L-1+3%蔗糖培养基,但胚状体的分化量还有待进一步提高。
4 结论与讨论
4.1 适宜的种子灭菌方法
将采自岷县的当归种子先用流水冲洗30 min后,置于滤纸上吸干水分,然后先用70%乙醇漂洗10 s,再用0.1%升汞灭菌5 min,最后用无菌水冲洗3遍,用无菌滤纸吸干种子表面的水分。当归种子表面附带有很多霉菌,灭菌的难度很大。通过研究发现,当归种子无菌发芽要获得成功,首先要选用大而干净的种子,其次灭菌时要充分震荡,将种子表面的菌涤荡干净。再次,灭菌时可采用升汞和酒精配合灭菌,才能取得良好的灭菌效果。
4.2 适宜的愈伤诱导外植体和培养基
胚轴适宜于诱导愈伤组织,子叶诱导效果普遍不好。将胚轴接种于MS+IBA 2 mg·L-1+KT 0.2 mg·L-1培养基中,放入人工气候箱中进行培养,培养温度为23℃,湿度70%,光照时间14 h·d-1,光照强度2 000 lx,培养30 d后可诱导获得愈伤组织。
4.3 适宜的愈伤组织继代和胚状体分化培养基
愈伤组织第1~5次的继代及胚状体分化培养基可采用1/2 MS+IBA 2 mg·L-1+3%蔗糖,愈伤组织第6次之后的继代和胚状体分化培养基可采用1/2 MS+IBA 2 mg·L-1+KT 0.2 mg·L-1+3%蔗糖培养基,愈伤组织生长良好,但胚状体的分化量还有待进一步提高。不同的继代程序分化情况不同,在b-a-a-a的继代流程中分化出完整的胚状体,在b-b-b-b的继代流程中仅分化出芽端,在艾鹏飞的论文中也有类似现象[9],其原因可能是培养基中高浓度的无机盐抑制了根的诱导。
4.4 胚性愈伤组织诱导
研究表明植物胚性愈伤组织的诱导生长素是必不可少的,而且多数植物诱导胚性细胞均采用2,4-D,目前的研究发现2,4-D对人体有毒害作用,应避免使用[8]。已报道的有关当归组织培养均是采用2,4-D诱导获得胚性愈伤组织。研究表明植物也可以采用无毒副作用的生长素IBA诱导获得胚性愈伤并分化出胚状体[10]。本研究探索采用IBA诱导当归的胚性愈伤组织,并取得了良好的效果。关于IBA诱导胚性愈伤组织的条件和发生机制还有待更加深入的研究。
4.5本研究从种子无菌发芽到愈伤诱导和增殖及胚状体的分化,直至再生植株,建立了较为完善的当归组织培养技术体系,该技术体系流程简单,可操作性强,为当归工厂化育苗和转基因育种奠定了良好的技术基础。本研究在当归组培中首次采用了无毒副作用的生长素IBA诱导获得愈伤组织,诱导率高达100%,愈伤组织继代15个月后仍保持旺盛的增殖速度(见图d),在1~5代的继代中胚状体的分化量很大,但6代之后胚状体的分化量还有待进一步提高。此外,本研究诱导获得的疏松颗粒状的愈伤组织增殖速度很快,非常适合于大规模细胞悬浮培养,目前课题组正在开展相关研究。

图d 15次继代后仍旺盛生长的愈伤
[1] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010.
[2] 肖培根,杨世林,汤飞宇,等.药用动植物种养加工技术-当归[M].北京:中国中医药出版社,2001.
[3] 顾静文.当归Angelicasinensis(Oliv)Diels.组织培养研究[J].药学学报,1982,17(2):131-137.
[4] 张世瑜,郑国昌.当归愈伤组织诱导和植株再生[J].植物学报,1982,24(6):512-518.
[5] Huang H L,Chen C C,Chen U C,et al.Studies on tissue cultue ofAngelicasinensis(Oliv)Diels.I.Induction and growth of embryogenesis callus from immature embryo [J].J Agric Res China 1996,45:156-163.
[6] 雒晓芳,杨宁,陈学林,等.当归水培苗的组织培养[J].西北师范大学学报,2004,40(4):77-79.
[7] 左利娟,石进朝.当归组织培养技术研究[J].安徽农业科学,2012,4(1):171-173.
[8] 刘蕊,李德红,李玲.2,4-二氯苯氧乙酸的研究进展[J].生命科学研究.2004(4):71-75.
[9] 艾鹏飞.部分柿属植物种质资源离体保存及其遗传稳定性研究[D].2003.
[10] 王蒂.植物组织培养[M].北京:中国农业出版社.2004.
StudyonCallusInductionandPlantRegenerationofAngelicasinensis(Oliv.)Diels
GAOSufang,ZHANGYanhong*
(DepartmentofPharmacy,GansuCollegeofTraditionalChineseMedicine,Lanzhou730000,China)
Objective:To explore the condition of callus induction and proliferation,the embryoid differentiation and plant regeneration,which are the groundwork for factory nursery and transfer-gene breeding ofAngelicasinensis(Oliv.)Diels.MethodsHypocotyl and cotyledon as explants,1/2 MS or MS as basal medium,added different kinds and concentration of phytohormone,which were in order to induce callus.Effects of different subculture ways and concentration of ABA,IBA and sucrose on callus proliferation and differentiation of embryoid were studied.ResultsThe appropriate callus induction medium was MS+IBA 2 mg·L-1+KT 0.2 mg·L-1.The subculture medium of callus and embryoid from first to fifth generation differentiation medium was 1/2 MS+IBA 2 mg·L-1+3% sucrose.After sixth generation the subculture medium of callus embryoid differentiation medium is 1/2 MS+IBA mg·L-1+KT 0.2 mg·L-1+3% sucrose.ConclusionA good technology ofA.sinensisplant regeneration via embryoid way had been established.
Angelicasinensis(Oliv.)Diels;Callus;Primary culture;Subculture culture;Embryoid;Plant regeneration
10.13313/j.issn.1673-4890.2014.05.004
2014-02-08)

