双黄痛风胶囊质量标准提高研究
陈玉棠,黄艺蓉,成金乐,梁燕玲,陈金梅
(1.广州中医药大学 中药资源科学与工程研究中心 岭南中药资源教育部重点实验室,广东 广州 510006; 2.中山市中智药业集团有限公司,广东 中山 528437)
双黄痛风胶囊质量标准提高研究
陈玉棠1,2,黄艺蓉1,2,成金乐2*,梁燕玲2,陈金梅2
(1.广州中医药大学 中药资源科学与工程研究中心 岭南中药资源教育部重点实验室,广东 广州 510006; 2.中山市中智药业集团有限公司,广东 中山 528437)
目的补充优化双黄痛风胶囊的薄层鉴别及含量测定方法,提高其质量标准。方法采用薄层色谱法(TLC)对处方中赤芍、黄芪、秦皮进行定性鉴别;用高效液相色谱-蒸发光散射检测法(HPLC-ELSD)测定黄芪甲苷的含量。色谱条件:Agilent Zobax C18柱(250 mm×4.6 mm,5 μm);流动相乙腈-水(32∶68);蒸发光散射检测器(ELSD)。结果薄层鉴别方法专属性强;HPLC法测得黄芪甲苷在1.123~6.741 μg(r=0.999 9)线性关系良好,平均回收率为99.75%,RSD=1.75%。结论提高后的标准方法简便可行,专属性强,重复性好,可更好地控制双黄痛风胶囊的质量。
双黄痛风胶囊;薄层色谱法;高效液相色谱-蒸发光散射检测法;黄芪甲苷;质量标准
双黄痛风胶囊是正在研制开发的中药第6类新药,由黄芪、秦皮、赤芍、黄柏、茶叶组成,具有益气活血、清热利湿的功效,用于气虚血瘀兼湿毒瘀阻型高尿酸血症。黄芪甲苷为本方君药黄芪的主要活性成分,具有抗心力衰竭、保护心血管、降压、镇痛、调节血液尿酸代谢等作用[1-2]。双黄痛风胶囊原质量标准草案中,鉴别项仅对茶叶所含的表没食子儿茶素没食子酸酯(EGCG)进行薄层鉴别,未对处方中其他药味进行鉴别;含量测定项对黄芪甲苷的检测采用操作繁杂、重复性较差的薄层色谱扫描法,结果准确度不高。实验通过研究,在双黄痛风胶囊原标准的基础上,增加了对赤芍、黄芪和秦皮的薄层色谱鉴别,并改用HPLC方法对黄芪甲苷进行含量测定,提高了双黄痛风胶囊的质量标准,可更好地控制产品的质量。
1 仪器与试药
1.1 仪器
安捷伦1200RRLC快速液相色谱仪(G4218A的ELSD蒸发光检测器);Agilent Chemstation色谱工作站;AUW220D十万分之一电子天平(岛津公司);硅胶G薄层板(青岛海洋化工厂);DK-S24型电热恒温水浴锅(上海森信实验仪器有限公司);KQ-400KOE型高功率数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
黄芪甲苷(批号:110781-200613)、芍药苷(批号:110736-201136)、秦皮甲素(批号:110740-200104)、秦皮乙素(批号:110741-200506)、黄芪对照药材(批号:120974-201110)、赤芍对照药材(批号:121093-200402)、秦皮对照药材(批号:121415-200702),均购自中国食品药品检定研究院;双黄痛风胶囊(批号:110801,210301,310301)、阴性对照品由中山市中智药业集团有限公司提供;乙腈为色谱纯;水为双蒸水;其他试剂均为分析纯。
2 方法和结果
2.1 薄层鉴别
2.1.1 赤芍[3]
2.1.1.1 供试品溶液的制备 取本品内容物约3 g,置具塞锥形瓶中,加50%乙醇50 mL,超声处理20 min,滤过,滤液蒸干,残渣加水30 mL使溶解;用水饱和正丁醇振摇提取3次,每次20 mL,合并正丁醇液,用氨试液充分洗涤2次,每次20 mL,弃去氨液,取正丁醇液30 mL水浴蒸干(剩余30 mL,用于黄芪薄层鉴别供试品的制备),残渣加乙醇1 mL使溶解,即可。
2.1.1.2 对照品溶液的制备 另取芍药苷对照品适量,加乙醇制成2 mg·mL-1的对照品溶液。
2.1.1.3 对照药材溶液的制备 取赤芍对照药材0.5 g,加乙醇10 mL,振摇5 min,滤过,滤液蒸干,残渣加乙醇2 mL使溶解,即可。
2.1.1.4 阴性样品溶液的制备 取不含赤芍的阴性样品,按“供试品溶液制备方法”制成阴性样品溶液。
2.1.1.5 TLC鉴别 按照薄层色谱法[4],吸取上述4种溶液各4 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(40∶5∶10∶0.2)为展开剂,展开,取出,晾干。喷以5%香草醛硫酸溶液,105 ℃加热至斑点显色清晰。供试品色谱中,在与对照品、对照药材色谱相应的位置上,显相同颜色的斑点,且阴性对照无干扰,见图1。
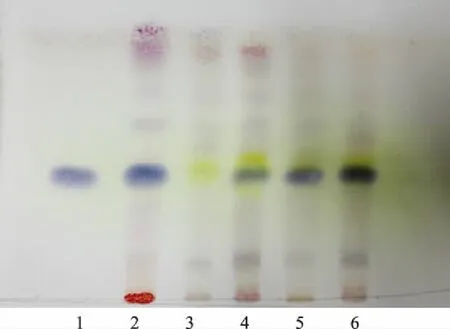
1.芍药苷对照品 2.赤芍对照药材 3.缺赤芍阴性样品 4~6.供试品(批号:110801,210301,310301)图1 双黄痛风胶囊中赤芍TLC图
2.1.2 黄芪[4,5]
2.1.2.1 供试品溶液的制备 取2.1.1赤芍供试品溶液制备项下剩余的30 mL正丁醇液,蒸干;残渣加水5 mL微热使溶解,放冷,通过D101型大孔吸附树脂柱(内径为1.5 cm,柱高为12 cm)依次以50 mL水、30 mL40%乙醇、50 mL 70%乙醇洗脱,收集70%乙醇的洗脱液,蒸干;用甲醇溶解并转移至2 mL量瓶中,加甲醇至刻度,摇匀,即可。
2.1.2.2对照品溶液的制备 取黄芪甲苷对照品适量,加甲醇制得1 mg·mL-1的黄芪甲苷对照品溶液,置于4 ℃保存。
2.1.2.3 对照药材溶液的制备 取黄芪对照药材1 g,加甲醇20 mL,加热回流1 h,滤过,滤液加于中性氧化铝柱(100~120目,5 g,内径10~15 mm)上,用40%甲醇100 mL洗脱,收集洗脱液,蒸干;残渣加水30 mL使溶解,用水饱和的正丁醇振摇提取2次,每次20 mL,合并正丁醇液;用水萃取2次,每次20 mL;弃去水液,正丁醇液蒸干,残渣加甲醇1 mL使溶解,即可。
2.1.2.4 阴性样品溶液 取不含黄芪的阴性样品,按2.1.2.1项下供试品溶液制备方法制成阴性样品溶液。
2.1.2.5 TLC鉴别 按照薄层色谱法[4],吸取上述4种溶液各10 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-水(13∶6∶2)10 ℃以下放置过夜的下层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105 ℃加热至斑点显色清晰。供试品色谱中,在与对照品、对照药材色谱相应的位置上,日光下显相同颜色的斑点,阴性对照无干扰。
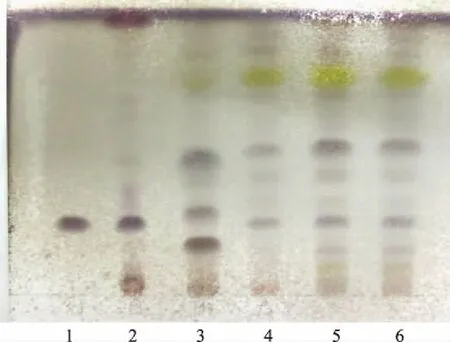
1.黄芪甲苷对照品 2.黄芪对照药材;3.缺黄芪阴性样品 4~6.供试品(批号:110801,210301,310301)图2 双黄痛风胶囊中黄芪TLC图
2.1.3 秦皮
2.1.3.1供试品溶液的制备 取本品内容物约3 g,置具塞锥形瓶中,加乙醇40 mL,加热回流2次,每次30 min,滤过,滤液浓缩至稠膏,加水20 mL溶解,用乙酸乙酯振摇提取3次,每次20 mL,取乙酸乙酯层,浓缩至稠膏。浓缩液加乙醇5 mL溶解,加到聚酰胺柱(内径10~15 mm,柱高15 cm),水洗脱至无颜色,蒸干。用乙醇溶解定容到2 mL量瓶中。
2.1.3.2 对照品溶液制备 取秦皮甲素对照品和秦皮乙素对照品适量,加甲醇制成每1 mL各含2 mg的混合溶液。
2.1.3.3 对照药材溶液的制备 取秦皮对照药材1 g,加甲醇10 mL,加热回流10 min,放冷,滤过,取滤液。
2.1.3.4 阴性样品溶液制备 取不含秦皮的阴性样品,按2.1.3.1项下供试品溶液制备方法制备。
2.1.3.5 TLC鉴别 按照薄层色谱法[4](《中国药典》2010年版一部附录ⅥB)试验,吸取上述8种溶液各10 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-甲酸(10∶2.5∶0.5)为展开剂,展开,取出,晾干,在365 nm下检视。供试品色谱中,在与对照品、对照药材色谱相应的位置上,显相同颜色的荧光斑点,阴性对照样品无干扰。
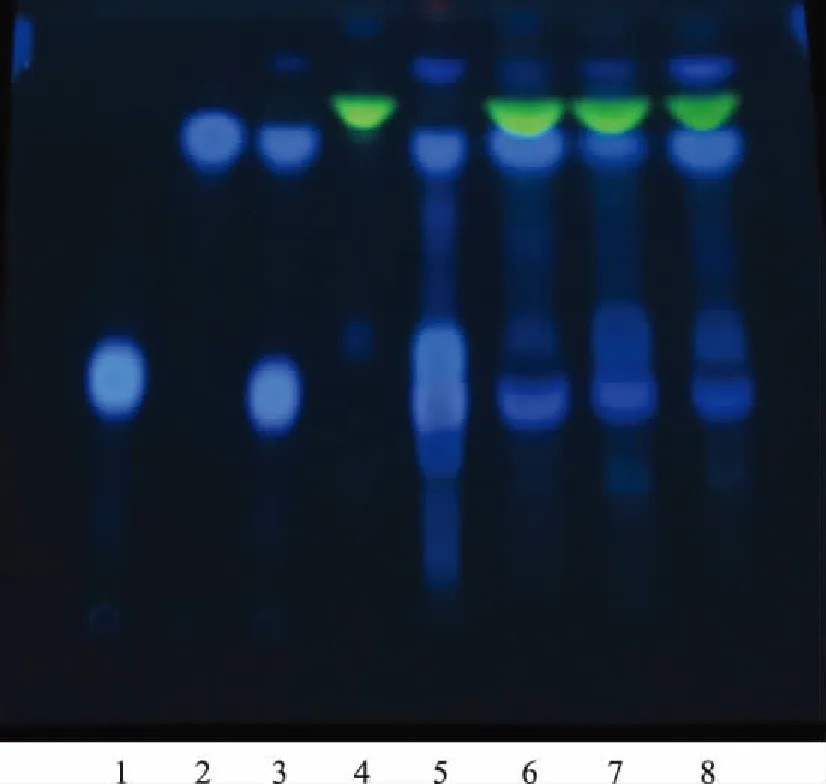
1.秦皮甲素对照品 2.秦皮乙素对照品 3.混合对照品 4.缺秦皮阴性样品 5.秦皮对照药材 6~8.供试品(批号:110801,210301,310301)图3 双黄痛风胶囊中秦皮TLC图
2.2 黄芪甲苷的含量测定[6-9]
2.2.1 色谱条件 色谱柱:Agilent Zobax C18(250 mm×4.6mm,5 μm);流动相:乙腈-水(32∶68);流速:1.0 mL·min-1;柱温:30 ℃;进样量:20 μL;ELSD蒸发光散射检测器参数:漂移管温度40 ℃,载气(氮气)压力3.5 Bar。理论板数按黄芪甲苷峰计算不低于4 000。
2.2.2 对照品溶液的制备 取黄芪甲苷对照品适量,精密称定,加甲醇制成0.1 mg·mL-1的对照品溶液,0.45 μm滤膜滤过,即得。
2.2.3 供试品溶液的制备 取装量差异项下本品内容物研细,取约0.75 g,精密称定,精密移取80%甲醇50 mL于具塞锥形瓶中,称定;超声处理45 min(功率320 W,频率4 kHz),放冷,用甲醇补足损失量,滤过,滤液蒸干。残渣加水15 mL,微热使溶解,用水饱和的正丁醇振摇提取4次,每次40 mL,合并正丁醇液;用氨试液充分洗涤2次,每次40 mL,弃去氨液;正丁醇液蒸干,残渣加甲醇溶解,转移至5 mL量瓶中,加甲醇至刻度,摇匀,0.45 μm滤膜滤过,即得。
2.2.4 阴性样品溶液的制备 取缺黄芪的阴性对照样品,照2.2.3项下供试品溶液的制备制成阴性样品溶液。
2.2.5 专属性试验 精密吸取上述3种溶液各20 μL,分别注入色谱仪,按其色谱条件测定,结果见图3。供试品溶液和对照品溶液在相应保留时间出现相似峰,分离度良好,而阴性样品溶液在黄芪甲苷色谱峰相应的保留时间处无干扰,黄芪甲苷峰与其他组分达到基线分离。
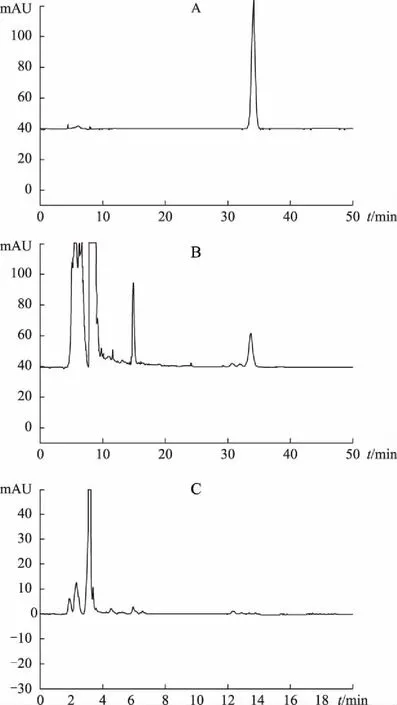
A.黄芪甲苷对照品 B.供试品 C.缺黄芪阴性样品图3 双黄痛风胶囊及对照品HPLC图
2.2.6 线性关系考察 分别精密移取黄芪甲苷对照品溶液(0.5 mg·mL-1)0.5,1.0,1.5,2.0,2.5,3.0 mL,置于5 mL量瓶中,加甲醇定容,摇匀,用0.45 μm滤膜滤过,分别吸取续滤液20 μL注入液相色谱仪测定,以进样量的自然对数为横坐标,峰面积的自然对数为纵坐标,绘制标准曲线,得回归方程:Y=1.611 3X+5.094 5,r=0.999 9。黄芪甲苷在1.123~6.741 μg与峰面积对数值呈良好的线性关系。
2.2.7 精密度试验 精密吸取黄芪甲苷对照品溶液20 μL,重复进样6次,依法测得黄芪甲苷峰面积对数的RSD=0.01%,说明仪器精密度良好。
2.2.8 稳定性试验 取同一份供试品溶液,室温下放置,分别在0,2,4,6,8,10,24 h依法测定,得黄芪甲苷峰面积对数的RSD=0.13%(n=7),说明供试品溶液在24 h内稳定。
2.2.9 重复性试验 分别取同一批样品(批号:310301)5份,按2.2.3项下方法制备供试品溶液,分别进样20 μL,依法测定,结果黄芪甲苷含量的RSD=0.03%,表明方法重现性好。
2.2.10 加样回收率试验 精密称取已知含量的同一批样品(批号:310301)6份,每份约1 g,分别精密加入黄芪甲苷对照品溶液(即0.5 mg·mL-1)0.8,0.9,1.0 mL,按2.2.3项下方法配制供试品溶液,依法测定,进样量为20 μL,记录色谱峰,计算回收率及其RSD值,见表1。
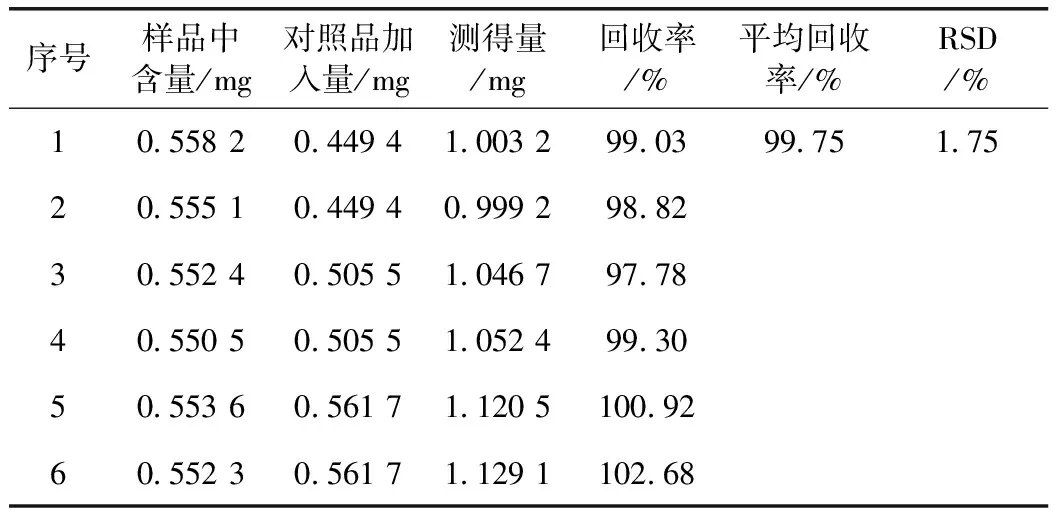
表1 双黄痛风胶囊中黄芪甲苷加样回收率试验
2.2.11 样品含量测定 分别取不同批号样品,按2.2.3项下方法制备供试品溶液,每批取3份,依法测定,结果见表2。

表2 双黄痛风胶囊中黄芪甲苷含量测定
2.2.12 最低检测限试验 精密移取黄芪甲苷对照品溶液(1.123 mg·mL-1)1 mL,置20 mL量瓶中,加甲醇稀释至刻度,摇匀,再精密量取3 μL,注入高效液相色谱仪,按2.2.1项下色谱条件测定,采用信噪比法,测得色谱图中信噪比为3.2,因此黄芪甲苷的检测限为168 ng。
3 讨论
在赤芍的薄层鉴别中,本法制备的供试品溶液,所得的薄层色谱背景杂质干扰小,斑点清晰。同时,该供试品溶液制备方法亦用作黄芪薄层鉴别项供试品前处理的制备,可大大简化操作步骤,提高实验效率。本实验也考察了乙酸乙酯-冰醋酸-水(8∶2∶1)[10]、三氯甲烷-甲醇(5∶1)[11]等不同的展开剂系统,但展开效果不佳,而本文采用的展开系统分离效果好、斑点清晰。
秦皮的薄层鉴别中,曾参考《中国药典》2010年版秦皮药材的供试品制备方法,但受到其他物质的严重干扰,无法显现斑点,经过摸索,本实验的方法经提取纯化后能排除杂质的干扰,更适合本制剂的薄层鉴别。同时也考察不同展开系统,结果存在阴性干扰或与对照品色谱相应的位置上,未显相同颜色的斑点。本展开系统是根据《中国药典》方法通过调整得出的,斑点分离得好,不受杂质干扰。
在黄芪甲苷的含量测定项中,供试品溶液的制备分别考察了不同提取方法(索氏提取和超声提取方法)、不同提取溶剂(水、50%甲醇、80%甲醇、2%氢氧化钾甲醇溶液)对黄芪甲苷含量的影响,结果表明以80%甲醇作溶媒超声提取效果最佳,而2%氢氧化钾甲醇溶液提取黄芪甲苷含量虽高,但长时间处在碱性条件下,可能会导致成分发生变化,故不选用。本实验还考察了不同提取时间(30,45,60 min)和不同纯化方法(过大孔树脂柱和不过树脂柱)对黄芪甲苷含量影响,结果超声45 min和不过大孔树脂柱方法的效果为佳。
实验选用ELSD检测器,能克服DAD检测器对皂苷类成分紫外末端吸收弱的缺点,更好地用于皂苷类成分的检测。
[1] 韩洪.防己黄芪汤加减治疗慢性尿酸性肾病[J].北京中医,2004,23(3):155.
[2] 肖艳,文旺秀,程康林,等.中医药对高血压病血尿酸代谢影响的临床观察[J].天津中医,2002,19(1):17.
[3] 于密密,傅欣彤.小败毒膏质量标准研究[J].中国实验方剂学杂志,2012,18(23):79-82.
[4] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:附录34.
[5] 朱丽萍,安叡,王新宏.糖泰片的质量标准研究[J].成都中医药大学学报,2012,35(3):66-69.
[6] 李晓蒙,李晓莹,徐位良,等.糖康安颗粒质量标准研究[J].广东药学院学报,2002,18(3):169-171.
[7] 邓少荣,曾建武,李靖,等.促孕合剂的质量标准研究[J].中国实验方剂学杂志,2012,18(23):64-66.
[8] 张彤,黄顺旺.HPLC-ELSD测定前列舒乐颗粒中的黄芪甲苷[J].中国实验方剂学杂志,2011,17(7):82-83.
[9] 肖佳尚,朱涛.HPLC-ELSD法测定芪红胶囊中黄芪甲苷的含量[J].广东药学院学报,2007,23(2):138-140.
[10] 王欣美.蚕虫草和复方中药阴道泡腾片的质量研究[D].上海:复旦大学,2003.
[11] 赵珺.舒肝和胃降逆颗粒提取工艺及质量标准研究[D].兰州:兰州大学,2009.
StudiesonImprovingQualityStandardofShuanghuangTongfengCapsules
CHENYutang1,2,HUANGYirong1,2,CHENGJinle2*,LIANGYanling2,CHENJinmei2
(1.ResearchCenterofChineseHerbalResourceScienceandEngineering,GuangzhouUniversityofTraditionalChineseMedicine,KeyLaboratoryofChineseMedicinalResourcefromLingnan(GuangzhouUniversityofChineseMedicine),MinistryofEducation,Guangzhou510006,China; 2.ZhongshanZeusPharmaceuticalGroupCo.,Ltd.,Zhongshan528437,China))
Objective:To impove the quality standard of Shuanghuang Tongfeng Capsules.MethodsThe TLC method was used to identifyPaenoiaeRadixRubra,AstragaliRadixandFraxiniCortex.The study of HPLC-ELSD methodology was carried out to determine the content of Astragaloside Ⅳ in the capsules.Chromatography method was performed on an Agilent Zobax ODS column(250 mm×4.6 mm,5 μm),the mobile phase composition was acetonitrile-water(32∶68).ResultsThis method is good in separation,strong in specificity.The linear range of Astrogaloside Ⅳ was 1.123-6.741 μg(r=0.999 9).The average recovery rate was 99.75%,RSD1.75%.ConclusionThe method is simple,feasible and reproducible.It can be used for the quality control of Shuanghuang Tongfeng Capsules.
Shuanghuang Tongfeng Capsules;TLC;HPLC-ELSD;Astrogaloside Ⅳ;Quality
*
成金乐,主任中药师,研究方向:创新中药开发;Tel:(0760)85312928,E-mail:gdcjl9@126.com
10.13313/j.issn.1673-4890.2014.03.015
2013-09-12)
standard

