肝癌介入治疗后血清缺氧诱导因子和血管内皮生长因子含量变化对预后的影响
管清龙, 纪卫政, 任伟新, 顾俊鹏
肝癌是最常见的恶性肿瘤之一,我国肝癌的死亡率位居各种恶性肿瘤的第2位。肝癌缺少首发症状,发现时患者多处于中晚期,常不能手术根治,5年生存率远低于5%。近年来,随着影像设备的不断发展、微创技术水平的提高,在大型设备数字减影(DSA)机应用下,对不能手术切除的肝癌可采用肝动脉灌注化疗栓塞术 (transarterial chemoembolization,TACE)治疗,现已认为其是标准姑息性治疗晚期肝癌的主要方法[1-3]。TACE治疗的目的是减少、阻断肿瘤血供,使肿瘤缺血、缺氧坏死。相关研究认为,缺氧诱导因子(HIF)-1a作为氧平衡调节的重要因子,影响肿瘤基因和细胞的合成和表达,对肿瘤复发、转移等起重要作用,诱导血管内皮生长因子(VEGF)基因转录,使VEGF mRNA稳定性增加,VEGF及受体表达上调,通过癌细胞和内皮细胞之间相互影响、双向旁分泌促进血管生成[4]。目前,对于TACE治疗后,肝癌患者血清HIF-1a、VEGF含量变化对预后的预测尚少见报道。本文通过检测60例TACE患者治疗前、后血清中HIF-1a、VEGF的含量变化及分析相关因素的生存曲线,评估对预后的影响,为肝癌介入术后的预后评估提供新思路。
1 材料与方法
1.1 一般资料
2007年1月—2012年1月选择60例肝癌患者行TACE治疗,其中男性33例,女性27例;年龄27~78岁(中位年龄54岁)。Child-Pugh分级A级21例,B级35例,C级4例。巴塞罗那临床分期诊断标准(Barcelona clinic liver cancer,BCLC)分级:0级11例,A级22例,B级27例。甲胎蛋白(AFP)>400 μg/L 45例,≤ 400 μg/L 15例。 肿瘤长径 > 5 cm 34例,≤5 cm 26例;单发31例,多发29例。有门脉癌栓12例。KPS评分:100分52例,90~99分8例。血管侵犯17例。乙型肝炎病毒(HBV)阳性38例,丙型肝炎病毒(HCV)阳性14例,其他8例。选择20例正常人作为对照组,检测治疗前、后血清中 VEGF、HIF-1a含量。
1.1.1 纳入标准 ①经CT、超声或两种以上影像学诊断确诊;② 病理确诊;③ 符合BCLC标准;④凝血功能正常。
1.1.2 排除标准 ①KPS评分 <90分;② 腹水(中~大量);③ 凝血异常;④ 转氨酶升高大于正常值3倍以上。
1.2 治疗方案
患者取仰卧位,常规消毒铺巾后,右侧腹股沟处股动脉处局部麻醉,置入导管后,“冒烟”示在动脉内,将导管置于腹腔干内造影示肝内多发异常肿瘤染色,超选择肿瘤供血动脉给予药物灌注化疗,根据肿瘤大小再给予碘油等混合乳剂栓塞治疗。治疗完毕后,肝内碘油沉积良好,异常肿瘤染色基本消失。
1.3 血清HIF-1a、VEGF含量检测
在术前、术后1 d、1周、1个月时,采集清晨空腹外周静脉血液4 ml,置无菌管中,静置30~60 min,3 000 g离心15 min,离心后取血清置于-80℃冰箱待测。采用酶联免疫吸附法(ELISA)测定血清HIF-1a、VEGF含量,按说明书操作,全自动酶标仪450 nm波长处测吸光度(A)值,进行双孔检测,获得标本血清中HIF-1a、VEGF的含量。
1.4 计算血清HIF-1a、VEGF中位值
测出术前、术后血清HIF-1a、VEGF含量,计算术后1 d和1周的血清HIF-1a、VEGF中位值,根据中位值划分血清HIF-1a、VEGF含量的高低,评价其含量对预后的影响。
1.5 多因素分析
根据影像学、实验室检查及随访情况,对相关临床数据进行分类及统计,对常见影响肝癌预后的因素进行分析,如KPS评分、Child-Pugh分级、门脉癌栓、血管侵犯、肝内外转移等因素对生存时间的影响。
1.6 统计学方法
采用SPSS17.0统计软件对数据进行分析。用Log-Rank等级检验进行比较,以均数±标准差s)表示。用Cox回归模型分析对KPS评分、Child-Pugh分级、门脉癌栓、血管侵犯、肝内外转移等因素对生存时间的影响。用Kanplan-Meier分析TACE术后血清HIF-1a、VEGF含量对预后的生存曲线。P<0.05为差异有统计学意义。
2 结果
60例患者中,因不能行手术切除而首次行TACE治疗33例,27例为术后再次复发,基本行2~3次TACE术,平均治疗间隔时间为1~6个月。47例在TACE治疗1个月后病灶内碘油沉积良好,病灶内未见肿瘤血供;所有患者基本情况满足:KPS评分≥90分。
2.1 治疗前、后血清HIF-1a、VEGF含量变化
60例患者治疗前、后血清HIF-1a、VEGF含量呈现不同的变化。TACE组患者术前HIF-1a、VEGF含量明显高于对照组,差异有统计学意义 (P<0.001)。与术前相比,TACE组患者术后第1天血清内HIF-1a含量明显升高(P<0.001),而血清VEGF含量与术前相比差异无统计学意义 (P>0.05);术后1周和1个月时血清内HIF-1a、VEGF含量明显下降(P < 0.05,表 1)。

表2 肝癌患者术前、术后血清HIF-1a、VEGF含量
2.2 术后血清HIF-1a、VEGF含量与临床特点关系
肝癌患者TACE术后不同时间血清HIF-1a、VEGF含量指标与门脉癌栓、Chid-Pugh分级、KPS评分、BCLC分期及血管侵犯等相关 (P<0.05);而与年龄、AFP含量、肝炎及肿瘤大小等无相关性(P>0.05,表 2)。

表2 术后血清HIF-1a、VEGF含量与临床特点的关系
2.3 相关因素对生存时间的影响
经Log-rank检验,本组患者中位生存时间为36个月,5年累积生存率为43.3%。Cox回归分析回归系数对风险度的变化,发现肝癌合并门脉癌栓及血管侵犯者的生存时间短于无门脉癌栓及血管侵犯者,同时不同的分级、分期及评分标准对生存时间有较大影响,差异有统计学意义(P<0.05),见表3。
2.4 血清内HIF-1a、VEGF变化对生存时间的影响
肝癌患者在TACE治疗后,血清内HIF-1a、VEGF含量与肝癌伴有门脉癌栓、Child-Pugh分级、KPS评分、BCLC分期及血管侵犯等因素有明显相关性。按术后1d、1周血清HIF-1a、VEGF含量中位值 (HIF-1a=588.2 pg/ml,VEGF=296.3 pg/ml)为界划分高值或低值,经Kanplan-Meier分析预后的生存曲线,发现血清内HIF-1a、VEGF的含量高于中位值,其5年生存率较差,表明术后血清HIF-1a、VEGF含量的高低对预后有明显影响 (P<0.05,图
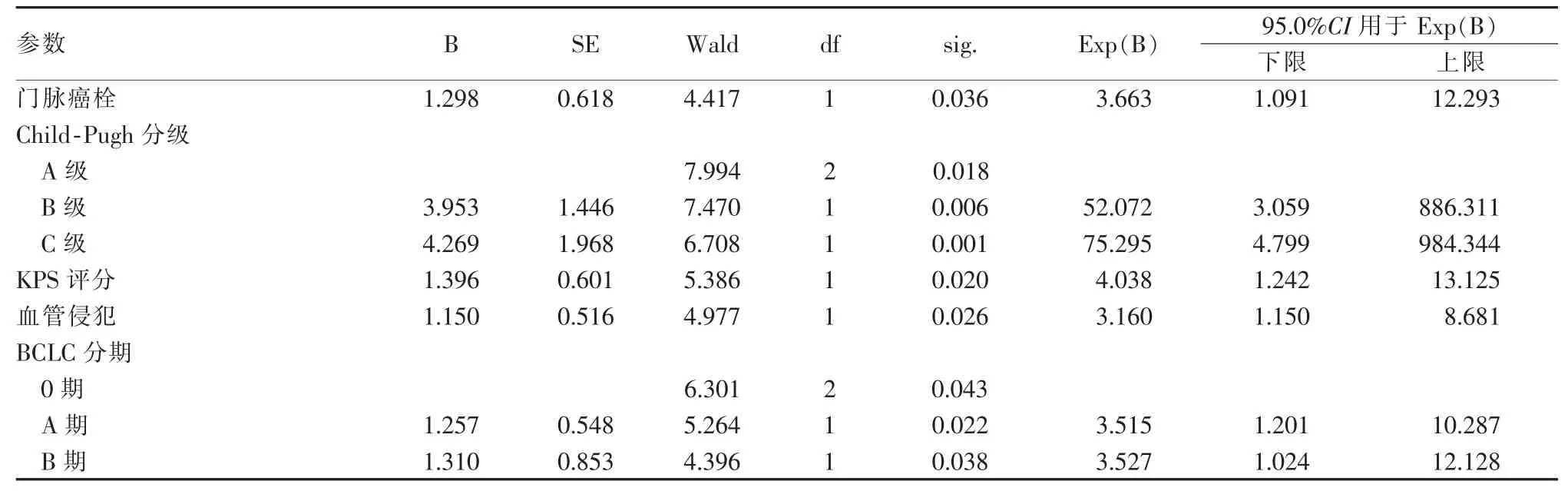
表3 Cox回归分析多因素对生存时间的影响

图1 术后血清HIF-1a含量高低对生存时间的影响

图2 术后血清VEGF含量高低对生存时间的影响
3 讨论
肝癌血供的75%~80%来自于肝动脉,TACE阻断供血动脉后,导致肿瘤组织缺氧。在缺氧状态下,HIF-1a是调节细胞内氧代谢的关键因子之一,通过诱导多种血管生长因子表达刺激新生血管发生,促进肿瘤生长,其中以 VEGF 最为明显[5-6]。Ryan等[7]发现在恶性肿瘤中HIF-1a水平高,可能是因为组织氧浓度降低,导致HIF-1a的表达增高。同时有文献报道,血清HIF-1a、VEGF含量变化主要是术后癌细胞缺氧、坏死[8-10],促使 HIF-1a 释放,诱导VEGF表达,促进癌组织生长、浸润、转移,因此,在缺氧状态下VEGF诱导新生血管的形成,可作为对肿瘤经TACE治疗后预测预后的一项重要指标。国内有文献报道,TACE术后肝细胞从缺氧到肿瘤新生血管生成过程中血清HIF-1a、VEGF含量会发生较大变化[11],由于 VEGF诱导血管的生长晚于HIF-1a的变化,根据本文所得患者的基本数据发现,与术前相比,术后1 d的HIF-1a含量达到高峰(P < 0.001),而血清 VEGF含量无差异(P > 0.05);术后1周VEGF含量较术前明显下降 (P<0.05)。TACE治疗后血清HIF-1a、VEGF含量变化主要因为栓塞后病灶组织缺血、缺氧,术后急性诱导HIF-1a的快速表达与释放,随着肿瘤组织缺血、缺氧,肿瘤细胞坏死及肿瘤对氧耐受性增加,术后1周血清VEGF含量较术后1 d变化较大,表明肿瘤新生血管生成。因此,测量血清HIF-1a、VEGF含量变化可作为介入术后评估疗效的良好指标。
肝癌生长依赖新生血管生成,病灶 >0.5 mm时诱导血管内皮细胞增殖。有研究证实VEGF有自分泌功能,能刺激癌细胞扩增,促使肿瘤新生血管生长加快,同时观察到癌组织VEGF呈高表达状态,与肿瘤进展及转移明显相关[12-13]。文献报道在许多动物及人类肿瘤细胞中VEGF均呈高表达,且VEGF的表达还可作为预后的一项预测指标。本研究对肝癌的Child-Pugh分级、KPS评分、BCLC分期及伴有门脉癌栓、血管侵犯等因素进行分析,发现不同的分级、评分及分期HIF-1a、VEGF含量在TACE术后有不同变化(P<0.05);同时伴有门脉癌栓、血管侵犯者血清HIF-1a、VEGF含量明显高于无伴有门脉癌栓及血管侵犯者(P<0.05);而与年龄、AFP含量、肝炎及肿瘤大小等对预后的影响差异无统计学意义(P>0.05)。多因素分析发现血清HIF-1a、VEGF含量变化对预后起重要作用。本研究证实肿瘤供血动脉栓塞后,组织缺氧,诱导HIF-1a产生,经过细胞一系列的反应,促使VEGF表达增强。本研究通过COX回归模型观察TACE术后回归系数对风险度的影响,发现主要相关因素在5年累计生存时间呈不同变化,肝癌合并门脉癌栓及血管侵犯者的生存时间较无门脉癌栓及血管侵犯者差,同时不同的分级、分期及评分标准对生存时间有较大影响,差异有统计学意义(P<0.05)。
有文献报道,对TACE治疗患者术前血清VEGF含量进行分析,得出中位值(VEGF=285 μg/L),根据中位值分阴性、阳性,根据分组情况证实血清VEGF含量高于中位值,其预后较差[14]。在TACE治疗后,是否可以在缺氧状态下使HIF-1a表达下调,增加组织对缺氧的耐受性,使VEGF表达减少,减少肿瘤新生血管形成,是否可以根据HIF-1a表达高低提出参考值,对预后进行预测仍有待进一步研究。本文尝试性提出TACE术后中位值概念,期望能在TACE术后按血清HIF-1a、VEGF含量变化对预后进行有效预测。本文不足之处是病例数较少,尚需扩大样本进行临床分析及研究。
[1] Lewandowski RJ, Mulcahy MF, Kulik LM, et al.Chemoembolization for hepatocellular carcinoma:comprehensive imaging and survival analysis in a 172-patient cohort[J].Radiology, 2010, 255: 955-965.
[2] Bruix J,Sala M,Llovet JM.Chemoembolization for hepatocellular carcinoma [J].Gastroenterology, 2004, 127 (5 Suppl): S179-188.
[3] Bruix J, Sherman M.American Association for the Study of Liver Diseases.Management of hepatocellular carcinoma:an update[J].Hepatology, 2011, 53: 1020-1022.
[4] Mathonnet M, Descottes B, Valleix D, et al.Quantitative analysis using ELISA of vascular endothelial growth factor and basic fibroblast growth factor in human colorectal Cancer,liver metastasis of colorectal Cancer and hepatocellular carcinoma[J].World J Gastroenterol, 2006, 12: 3782-3783.
[5] Zhong H,De Marzo AM,Laughner E,et al.Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases[J].Cancer Res, 1999, 59: 5830-5835.
[6] Cao D,Hou M,Guan YS,et al.Expression of HIF-1alpha and VEGF in colorectal cancer:association with clinical outcomes and prognostic implications[J].BMC Cancer, 2009, 9: 432.
[7] Ryan HE,Poloni M,McNulty W,et al.Hypoxia-inducible factor-lalpha is a positive factor in solid tumor growth[J].Cancer Res, 2000, 60: 4010-4015.
[8] 黄清玲,郑大利,张 声,等.原发性肝癌中结构型一氧化氮合酶mRNA的表达及其意义 [J].中华肿瘤杂志,2003,25:250-254.
[9] 郑延波,徐 克.缺氧诱导因子-1A在兔VX2肝癌模型TACE术后的表达及其临床意义 [J].介入放射学杂志,2007,16:334-338.
[10] Zagzag D,Zhong HJ,Scalzitti JM,et al.Expression of hypoxiainducible factorlalpha in brain tumors: association with angiogenesis, invasion, and progression[J].Cancer, 2000, 88:2606-2618.
[11] 肖恩华,李锦清,黄洁夫.术前经动脉化疗栓塞对肝癌细胞增殖的影响[J].介入放射学杂志, 2004, 13: 31-34.
[12] Liu Y, Poon RT, Li Q, et al.Both antiangiogenesis-and angiogenesis - independent effects are responsible for hepatocellularcarcinoma growth arrestby tyrosine kinase inhibitor PTK787/ZK222584[J].Cancer Res, 2005, 65: 3691-3699.
[13] Zhao J, Hu J, Cai J, et al.Vascular endothelial growth factor expression in serum of patients with hepatocellular carcinoma[J].Chin Med J(Engl), 2003, 116: 772-776.
[14] Guo JH, Zhu X, Li XT, et al.Impact of serum vascular endothelial growth factor on prognosis in patients with unresectable hepatocellular carcinoma after transarterial chemoembolization[J].Chin J Cancer Res, 2012, 24: 36-43.

