二溴二氟甲烷的合成及应用
金杭丹 徐卫国 李 华
(1.浙江省化工研究院有限公司,浙江杭州 310023)
0 前言
氟是最活泼也是电负性最大的非金属元素,其形成的C-F键的键能为485.7 kJ/mol,比C-H键的键能410.3 kJ/mol要大得多,且氟原子的体积很小,是所有元素中与氢原子最为接近的元素,范德华半径为1.35 Å,仅为氢的1.13倍。由于这些特性,氟原子的引入能引起化合物电子效应和理化性质的变化,从而增加有机氟化合物的稳定性及生理活性[1]。含氟化合物通常具有优良的耐温性能、化学稳定性和表面活性等特点[2]。
二溴二氟甲烷(CF2Br2)在反应中能提供一溴二氟甲基(-BrCF2)和二氟亚甲基(=CF2)基团参与到大分子的杀虫剂、活性药物中间体、除草剂等的合成中,因这些基团具有强吸电子性和C-F键稳定性,将其引入有机分子中是一种有效的修饰生物活性化合物的方法[3],且使这些物质具有某些特定官能团的作用。
二溴二氟甲烷(Dibromodifluoromethane)哈龙命名法命名为Halon1202,其分子式为CBr2F2,分子量为209.82,是无色气体/液体,不溶于水,可溶于乙醚、丙酮、乙醇和苯。其他物理性质:密度8.7 kg/m3(气态)、2.27 g/cm3(液态),熔点 -101.1 ℃,沸点22.8℃,蒸气压83 kPa(20℃),分配系数logP=1.99,臭氧破坏潜势 (ODP)为 0.4(CCl3F=1)。CBr2F2会消耗大气臭氧层中的臭氧而对环境造成破坏性影响。故不能直接使用也不能将其废液倾倒入水池,应收集后集中处理。
1 CBr2F2的制备方法
1.1 二氟甲烷的热溴化[4]
将CH2F2通入液溴中,液溴保持52~58℃,产生的混合气为Br2∶CH2F2=1.9∶1,在石英管中反应,热溴化温度为500℃,接触时间为15 s,转化率为85%,产品选择性为93.4%。

CH2F2热溴化时,如果在Br2中混配Cl2可以大大降低反应的温度,在350℃即可发生反应。
1.2 二氟二氯甲烷的催化溴化[5]
二氟二氯甲烷的催化溴化反应中所用催化剂为活性炭负载溴化铬或溴化锌,如催化剂上负载40%的溴化锌,原料为 CCl2F2、CF2Br2和 HBr,物质的量比为1∶1∶1,反应温度为320℃,接触时间为16 s,得到的粗品中 CBr2F2的质量分数可达到41%,CF2ClBr的质量分数为28%,CF2Cl2的质量分数为31%。

1.3 二氟化合物的溴氧化[6]
二氟化合物的溴氧化反应,需要O2参与,而且CF2Br2主要是作为副产物出现。

上述3种制备二溴二氟甲烷的方法中,主要采用以二氟甲烷为原料通过热溴化方法制备。采用溴素作为溴化剂,但所需的反应温度较高,温度很高时有可能导致部分产品分解、结焦,对反应设备耐腐蚀的要求比较高。溴化方法中还包括光溴化和催化溴化,它们的特点是反应温度较低、选择性较高,但关于二溴二氟甲烷的光制备法和催化溴化法的报道很少。
2 CBr2F2的应用
2.1 制备一溴二氟甲基(-BrCF2)化合物
2.1.1 与烯烃和炔烃的加成反应
1)CF2Br2与烯烃的加成反应
CF2Br2与烯烃和炔烃加成的基本条件是由辐射[7]、金属[8-11]、硼[12]、过氧化氢[13-14]引发反应,得到相应的加合物。反应中与CF2Br2加成的烯烃化合物可以是任意比例参与加成反应,通常烯烃化合物与CF2Br2的投料物质的量比是10~0.1∶1,优选条件是 1∶1[15],CF2Br2与烯胺发生水解反应(没有任何引发剂),生成了 α -CBrF2酮[16]。

2)CF2Br2与炔烃的加成反应
传统中将CF2Br2加成到双键或三键化合物上的方法仍在广泛使用[17-19]。Yoshida 等人[20]报道称,当锡介导的自由基CF2Br2加成到C60单元上时,铈盐和过硫酸铵可用于引发各种炔烃反应[21]。

2.1.2 与亲核试剂反应
CF2Br2与亲核试剂反应,如CF2Br2与碳负离子[(EtO2C)2CR]-[22]、RC≡C-[23]、[PhCH=NC(Me)CO2Me]-[24]反应得到了具有 -CBrF2基团的相应化合物。CF2Br2与膦或亚磷酸酯的反应能提供一溴二氟甲基磷盐和一溴二氟甲基磷酸盐[25-26]。CF2Br2还能与硫和氧亲核试剂反应,得到二氟溴甲基硫化物[27-29]和醚[30]。吡唑与 CF2Br2和 NaH 反应得到N'-一溴二氟甲基吡唑[31]。

2.1.3 制备二氟卡宾
CF2Br2是二氟卡宾的前驱体。其应用范围有合成 β - 受体阻滞剂[32]、二氟甲基丙烯酸甲酯[33]、氟代环丙烷[34]、二溴二氟亚甲基酰亚胺手性烯醇化物[35],最终反应显示的是继续进行所示的卡宾机制,而不是通过直接位移。

二氟卡宾也可以由CF2Br2与铁四羰基二价阴离子反应生成[36],但这些卡宾配合物不稳定,通常为自凝结状态。
2.2 制备二氟亚甲基(=CF2)化合物
2.2.1 制备6,6-二氟-5-甲基-5-己烯酸苄酯[37]
制备杀虫剂和杀螨剂的卤代链烯烃,将三(二甲基氨基)膦逐滴加到含有二溴二氟甲烷的二甘醇二甲醚溶液中,再加入5-氧代己酸苄酯得到目标产物6,6-二氟-5-甲基-5-己烯酸苄酯,产率为86%,其沸点为145~152℃/1.8 kPa,Rf=0.50(己烷/乙酸乙酯=8/2)=1.4760。

此杀虫剂对广泛范围幼小的节肢动物都具有活性,因此不仅能用来防治植物害虫,也能用来消灭人体和家畜的寄生虫,特别是能用来消灭对其他物质具有抵抗力的寄生虫。杀虫剂可使用的浓度为0.0005% ~5%,优选0.001% ~1%(以每100 mL组合物中活性组分的克数计算)。包括动物体外寄生虫在内的能用此杀虫剂消灭的昆虫有:鳞翅目,例如棉铃虫和大粉蝶;双翅目,例如家蝇、地中海实蝇和丝光绿蝇等。
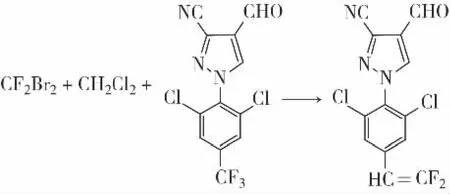
2.2.2 制备3-腈基-1-(2,6-二氯-4-三氟甲基苯基)-4-(2,2-二氟乙烯基)吡唑
将3-腈基-1-(2,6-二氯-4-三氟甲基苯基)-4-甲酰基吡唑、二溴二氟甲烷和二氯甲烷置于不锈钢反应器中加热、搅拌。将反应混合物蒸发并将残余物在硅胶上用二氯甲烷 ∶己烷洗脱进行柱色谱纯化。合并并蒸发适当的馏份得到产物3-腈基-1-(2,6-二氯-4-三氟甲基苯基)-4-(2,2-二氟乙烯基)吡唑,为白色固体,熔点为75 ~77 ℃[38]。
2.2.3 维蒂希反应中的应用
CF2Br2在维蒂希反应(Wittig reaction)中是引入=CF2基团到有机分子中的前驱体。存在CF2Br2与六甲基亚磷酰三胺或三苯基膦的条件下,醛和酮可以被转换为相应的1,1-二氟烯烃[39-41]。此外,存在膦或金属(锌或镉)的条件下,鏻盐[R3PCF2Br]+Br-与醛和酮反应也得到了相应的1,1- 二氟烯烃[42-43]。

1997年,蔡米氏阿尔布佐夫报告了霍纳尔-沃兹沃斯-埃蒙斯过程(Horner-Wadsworth-Emmons process)的变化[44],亚磷酸三乙酯与CF2Br2反应得到二乙基(二氟溴甲基)膦酸二乙酯。在锌的作用下,可以用各种酰氯酰化,得到二乙基-2-氧代-1,1-二氟磷酸盐,后与格氏试剂反应得到1,1-二氟烯烃。

2.3 CF2Br2作为卤化剂的应用
2.3.1 CF2Br2在兰堡-巴克伦反应中的应用
近年来,CF2Br2最显著的用途之一是在兰堡-巴克伦反应(Ramberg–Bäcklund Reaction)中被用作卤化剂[45-47]。迈耶首次于1974年报道了烯烃的合成[48],但1994年陈等人[49]就对其在兰堡–巴克伦反应中的应用发表了详细的研究,自此被用于合成各种各样的复杂体系[50-52]。兰堡-巴克伦反应中经常用到CF2Br2试剂,主要是因为可以在室温或低于室温的条件下进行反应,且沸点较低,在反应结束时可以较容易地除去试剂。此外,减少了初始砜类物质的过卤化作用,且在标准迈耶斯条件(CCl4/KOH)下的持续性问题和低反应性的二氟卡宾说明没有多余的卡宾在烯烃产品上发生反应。
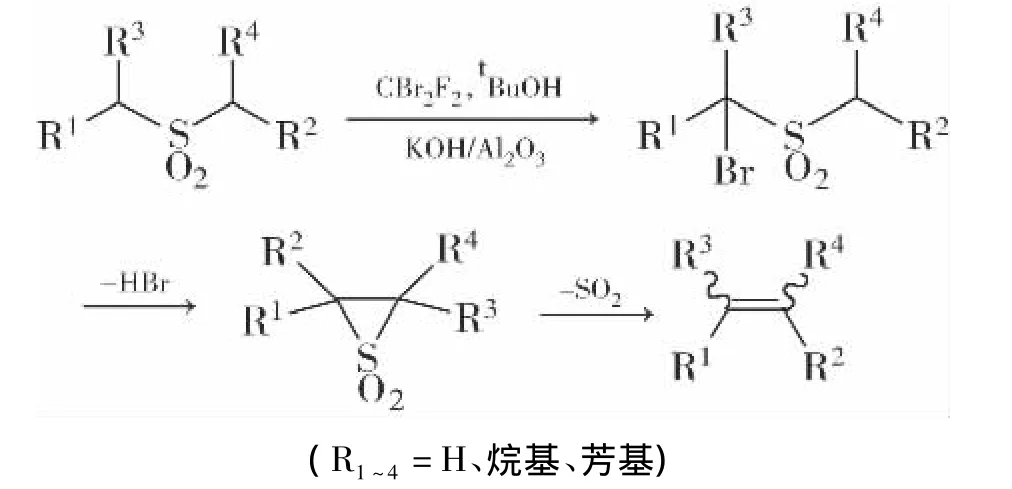
2.3.2 合成烯二炔和多烯中的应用
曹等使用此改性兰堡-巴克伦反应与CF2Br2合成了一系列的共轭烯二炔[53-54]、己三炔和辛四烯[55-56]。

2.3.3 合成外烯糖和C-连接二糖中的应用
近年来,Taylor[57-58]和 Franck[59]的研究小组利用CF2Br2作为卤化剂,使其在兰堡-巴克伦反应中有了新的应用,报道了使用二氧化硫苷试剂合成外烯糖的研究[60]。
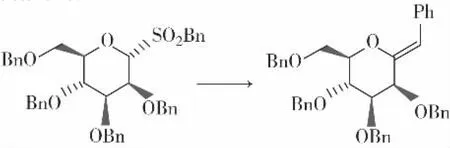
Taylor还报告了CF2Br2在合成C-连接的氨基酸[61]和二糖中的应用[62],Franck 也用这种方法合成了抗生素阿托霉B的一个片段。
2.3.4 制备三氟甲基化合物CF3Cu
由CF2Br2制备 CF3Cu是比较容易的,处理CF2Br2和DMF中的Zn或Cd可形成CF3ZnX或CF3CdX。CuX和CF3ZnX或CF3CdX复分解得到CF3Cu试剂、芳基和乙烯基碘、烯丙基氯[63]和活化的芳基氯[64]。

3 展望
随着有机氟化学的兴起和发展,二溴二氟甲烷作为多类型反应的试剂原料在医药、农药等领域的应用越来越广泛,药物性能上相对具有用量少、高效、低毒、代谢能力强的优点,因此吸引了更多学者进行研究,预示着在今后的生产生活中将有更广泛的实际应用。
[1]Ma J A,Dominique C.UPdate:Asymmetric fluorination,trifluoromethylation and perfluoroalkylation reactions[J].Chem.Rev.,2008,108:1-43.
[2]Smart B E.Fluorine substituent effects on bioactivity[J].J.Fluorine Chem.,2007,109:3-11.
[3]卿凤翎,邱小龙.有机氟化学[M].北京:科学出版社,2007.
[4]方飞.二氟二溴甲烷(CBr2F2)的制备研究[J].有机氟工业,2010(3):35-36.
[5]Bohm H,Rudolph W,Massonne J.Process for preparing bromine-and fluorine-containing halogenated hydrocarbons:US,4359371[P].1982-11-16.
[6]RuhRobert P,DavisRalph A.Oxybromination of chlorodifluoromethane.US,2908724[P].1959.
[7]Tarrant P,Stump Jr E C.Free-radical additions involving fluorine compounds.VII.1 The addition of perhaloalkanes to vinyl ethyl ether and vinyl 2,2,2-trifluoroethyl ether[J].The Journal of Organic Chemistry,1964,29(5):1198-1202.
[8]Burton D J,Kehoe L J.The copper(I)chloride-ethanolamine catalyzed addition of polyfluorinated alkanes to olefins[J].Tetrahedron Letters,1966,7(42):5163-5168.
[9]Elsheimer S,Michael M,Landavazo A,et al.Unexpected products from the reactions of 1-(bromodifluoromethyl)-2-bromocyclohexanes with potassium hydroxide[J].The Journal of Organic Chemistry,1988,53(26):6151-6153.
[10]Nohair K,Lachaise I,Paugam J P,et al.Mn(III)-Mediated electrochemical C,C-bond formation:radical addition of polyhalomethanes to olefins[J].Tetrahedron letters,1992,33(2):213-216.
[11]Hu C M,Chen J.Preparation of β -bromodifluoromethyl-functionalized esters,nitrile and ketones via addition of dibromodifluoromethane to electron-deficient alkenes initiated by a CrCl3/Fe bimetal redox system[J].J.Chem.Soc.,Chem.Commun.,1993(1):72-73.
[12]Sugimoto J,Miura K,Oshima K,et al.Triethylborane induced radical reaction of ketene silyl acetals with polyhalomethanes.Synthesis of 3,3-Dihalo-and 3-Haloacrylates[J].Chemistry Letters,1991,20(8):1319-1322.
[13]Tarrant P,Lovelace A M.Free Radical Additions Involving Fluorine Compounds.I.The Addition of Dibromodifluoromethane to Hydrocarbon Olefins[J].Journal of the American Chemical Society,1954,76(13):3466-3468.
[14]Tarrant P,Stump Jr E C.Free-radical additions involving fluorine compounds.VII.1 The addition of perhaloalkanes to vinyl ethyl ether and vinyl 2,2,2-trifluoroethyl Ether[J].The Journal of Organic Chemistry,1964,29(5):1198-1202.
[15]Ketley A D.Dibromodifluoromethane addition to olefines:US,3310589[P].1967-03-21.
[16]Wakselman C,Tordeux M.Fr.Demande 84080101984 to Rhone-Poulenc.I.Rico,D.Cantacuzene and C.Wakselman[J].Tetrahedron Lett,1981,22:3405.
[17]Tanner D D,Zhang L,Hu L Q,et al.Formation of three-membered rings by SHi displacement.Reverse of cyclopropyl ring opening[J].The Journal of Organic Chemistry,1996,61(20):6818-6824.
[18]Li A R,Chen Q Y.Lead tetraacetate induced addition reaction of difluorodiiodomethane to alkenes and alkynes.synthesis of fluorinated telechelic compounds[J].Synthesis,1997,1997(12):1481-1488.
[19]Aubke F,Bach C,Baker A W,et al.Abboud,KA 111 AmeÂduri,B.253 Amii,H.215[J].Journal of Fluorine Chemistry,2000,102(377):378.
[20]Yoshida M,Suzuki D,Iyoda M.Convenient synthesis of 1-fluoroalky1-2-hydro[60]fullerene using fluoroalkyl halide with tributyltin hydride under radical conditions[J].Chemistry Letters,1996,1996(12):1097-1098.
[21]Qing F L,Wan D P.The addition of dibromodifluorometh-ane to(trimethylsilyl)acetylene and transformation of the products[J].Tetrahedron,1998,54(47):14189-14200.
[22]Everett T S,Purrington S T,Bumgardner C L.Preparation of alpha.-trifluoromethyl esters from malonic esters[J].The Journal of Organic Chemistry,1984,49(20):3702-3706.
[23]Rico I,Cantacuzene D,Wakselman C.Reactivity of the perhalogenoalkanes CF2BrX(X=Cl,Br)with nucleophiles.Part 4.Condensation with carbanions[J].Journal of the Chemical Society,Perkin Transactions 1,1982:1063-1065.
[24]Bey P,Vevert J P.New approach to the synthesis of α -halogenomethyl- α -amino acids[J].Tetrahedron Letters,1978,19(14):1215-1218.
[25]Naae D G,Kesling H S,Burton D J.Reversible equilibrium in tertiary phosphine-fluorohalomethane reactions[J].Tetrahedron Letters,1975,16(44):3789-3792.
[26]Burton D J,Flynn R M.Michaelis-Arbuzov preparation of halo-F-methylphosphonates[J].Journal of Fluorine Chemistry,1977,10(4):329-332.
[27]Rico I,Wakselman C.Synthese decomposes aromatiques comportant les groupements OCF2Br et SCF2Br-II:Action de CF2Br2et de CF2BrCl sur des thiophenates et phenates de potassium diversement substitues[J].Tetrahedron,1981,37(24):4209-4213.
[28]Burton D J,Wiemers D M.Synthesis of bromodifluoromethyl phenyl sulfide,sulfoxide and sulfone[J].Journal of Fluorine Chemistry,1981,18(4):573-582.
[29]Suda M,Hino C.Preparation of bromodifluoromethyl sulfide and its conversion to trifluoromethyl sulfide[J].Tetrahedron Letters,1981,22(21):1997-2000.
[30]Rico I,Wakselhan C.Synthese de composes aromatiques comportant les groupements OCF2Br et SCF2Br[J].Tetrahedron Letters,1981,22(4):323-326.
[31]Tisler M,Stanovnik B.Advances in pyridazine chemistry[J].Advances in Heterocyclic Chemistry,1990,49:385-474.
[32]Bermudez J L,Delcampo C,Sinisterra J V,et al.A new route to amino-2-propanol structures with adrenergic β-blocker activity using low valent titanium[J].Tetrahedron Letters,1997,38(23):4137-4140.
[33]Botteghi C,Paganelli S,Sbrogi F,et al.New synthetic approaches to ethyl 3,3-difluoro-2-methylacrylate[J].Tetrahedron Letters,1999,40(48):8435-8437.
[34]Baxter P J,Garton K,Kharasch E D.Mechanistic aspects of carbon monoxide formation from volatile anesthetics[J].Anesthesiology,1998,89(4):929-941.
[35]Iseki K,Asada D,Takahashi M,et al.Diastereoselective bromodifluoromethylation and difluoromethylation of chiral imide enolates via insertion of difluorocarbene[J].Tetrahedron:Asymmetry,1996,7(4):1205-1215.
[36]Petz W,Weller F,Barthel A,et al.Preparation,spectroscopic properties,and crystal structures of Fe2(CO)6(μ-CO)(μ -CF2)2,Fe2(CO)6(μ -CO)2(μ -CF2),and Fe2(CO)6(μ-CF2)(PPh3)2-theoretical studies of methylenic vs.carbonyl bridges in diiron complexes[J].Zeitschrift für anorganische und allgemeine Chemie,2001,627(8):1859-1869.
[37]Arnim K,Gunter H B,Hartmut Y P,等.卤代链烯烃的制备方法及其作为杀虫和杀螨剂的应用:CN,1053054[P].1991-07-17.
[38]班克斯 B J.杀寄生虫化合物:CN,1192735 A[P].1998-09-09.
[39]Naae D G,Burton D J.Fluoride-ion-free difluoromethylene olefination reactions[J].Journal of Fluorine Chemistry,1971,1(1):123-125.
[40]Naae D G,Burton D J.Stable difluoromethylene olefination solutions[J].Synthetic Communications,1973,3(3):197-200.
[41]Damon D B,Hoover D J.Synthesis of the ketodifluoromethylene dipeptide isostere[J].Journal of the American Chemical Society,1990,112(17):6439-6442.
[42]Hayashi S,Nakai T,Ishikawa N,et al.Convenient procedures for conversion of carbonyl compounds to gem-difluoroolefins and their selective reductions to monofluoroolefins[J].Chemistry Letters,1979(8):983-986.
[43]Burton D J,Kesling H S,Naae D G.Metal dehalogenation route to reactive fluoroolefins[J].Journal of Fluorine Chemistry,1981,18(3):293-298.
[44]Tsai H J.Preparation and synthetic application of diethyl 2-oxo-1,1-difluorophosphonates[J].Phosphorus,Sulfur,and Silicon and the Related Elements,1997,122(1):247-259.
[45]Taylor R J K,Casy G.The Ramberg-Bäcklund Reaction[J].Organic Reactions,2003,62:357.
[46]Taylor R J K,Vilar R,Mingos D M P,et al.Chemical communications-information point[J].Chem.Commun,1999,217:227.
[47]Wang X L,Cao X P,Zhou Z L.Application of rambergbacklund reaction in construction of carbon-carbon double bond[J].Chinese Journal of Organic Chemistry,2003,23(2):120-128.
[48]Meyers,C Y,Matthews W S,Malte A M.Reactions involving carbon tetra-halides with sulfones:US.3830862[P].1974-08-20.
[49]Chan T L,Chow H F,Fong S,et al.Stereo-and oligocontrolled synthesis of oligo[p-phenylene-(E)-vinylene]-p-benzoic acid derivatives:basic building blocks for oligo[p-phenylene-(E)-vinylene][J].J.Chem.Soc.,Chem.Commun.,1994(17):1919-1920.
[50]Chan T L,Hung C W,Man T O,et al.A new route to optically active paracyclophanes[J].J.Chem.Soc.,Chem.Commun.,1994(17):1971-1972.
[51]Kwong C Y,Leung M,Lin S C,et al.Synthesis and characterization of oligo(2,7-biphenylenylene-(E)-vinylene)[J].Tetrahedron Letters,1996,37(33):5913-5916.
[52]Cao X,Yang Y,Wang X.A direct route to conjugated enediynes from dipropargylic sulfones by a modified oneflask Ramberg – Bäcklund reaction[J].J.Chem.Soc.,Perkin Trans.1,2002(22):2485-2489.
[53]Chan T L,Fong S,Li Y,et al.A new one-flask Ramberg-Bäcklund reaction[J].Journal of the Chemical Society,Chemical Communications,1994(15):1771-1772.
[54]Cao X P,Chan T L,Chow H F,et al.Stereoselective synthesis of substituted 1,3,5-hexatrienes from diallylic sulfones[J].Journal of the Chemical Society,Chemical Communications,1995(12):1297-1299.
[55]Cao X P,Chan T L,Chow H F.Direct conversion of dipropargylic sulfones into(E)-and(Z)-hex-3-ene-1,5-diynes by a modified one-flask Ramberg-Bäcklund reaction[J].Tetrahedron Letters,1996,37(7):1049-1052.
[56]Cao X P.Stereoselective synthesis of substituted all- <i> trans< /i> 1,3,5,7-octatetraenes by a modifiedRamberg-Bäcklund reaction[J].Tetrahedron,2002,58(7):1301-1307.
[57]Griffin F K,Murphy P V,Paterson D E,et al.A Ramberg-Bäcklund approach to exo-glycals[J].Tetrahedron Letters,1998,39(44):8179-8182.
[58]Alcaraz M L,Griffin F K,Paterson D E,et al.Synthetic applications of Ramberg-Bäcklund derived exo-glycals[J].Tetrahedron Letters,1998,39(44):8183-8186.
[59]Pasetto P,Chen X,Drain C M,et al.Synthesis of hydrolytically stable porphyrin C-and S-glycoconjugates in high yieldsElectronic supplementary information(ESI)available:experimental details[J].Chemical Communications,2001(1):81-82.
[60]Griffin F K,Paterson D E,Murphy P V,et al.A new route to exo-glycals using the ramberg-Bäcklund rearrangement[J].European Journal of Organic Chemistry,2002,2002(7):1305-1322.
[61]Campbell A D,Paterson D E,Taylor R J K,et al.Exoglycal approaches to C-linked glycosyl amino acid synthesis[J].Chemical Communications,1999(16):1599-1600.
[62]McAllister G D,Paterson D E,Taylor R J K.A simplified Ramberg-Bäcklund approach to novel C-glycosides and C-linked disaccharides[J].Angewandte Chemie International Edition,2003,42(12):1387-1391.
[63]Wiemers D M,Burton D J.Pregeneration,spectroscopic detection and chemical reactivity of(trifluoromethyl)copper,an elusive and complex species[J].Journal of the American Chemical Society,1986,108(4):832-834.
[64]Clark J H,Denness J E,McClinton M A,et al.The trifluoromethylation of chloroaromatics using the copper-CF2Br2-dialkylamide reaction system[J].Journal of Fluorine Chemistry,1990,50(3):411-426.

