频域相干光断层扫描对PASCAL光凝治疗糖尿病性黄斑水肿后视网膜微结构观察△
刘卫 张勇进 徐格致
糖尿病性黄斑水肿(diabetic macular edema,DME)可发生于糖尿病视网膜病变的任何时期,是导致糖尿病视网膜病变患者视力损害的首要原因。美国威斯康星流行病学研究表明,糖尿病10年后DME的发病率为 13.9% ~25.4%[1]。
早期治疗糖尿病视网膜病变研究(the Early Treatment Diabetic Retinopathy Study,ETDRS)研究表明,黄斑区光凝治疗可使DME患者3年内视力严重丧失风险下降50%或更多,一直以来黄斑区光凝成为治疗DME的金标准[2]。近年来玻璃体腔注射抗血管内皮 生 长 因 子 (vascularendothelialgrowth factor,VEGF)、激素等药物成为治疗DME的新方法,尽管如此,玻璃体腔药物注射存在需多次注射、易复发、全身及局部并发症以及经济负担等众多限制因素,黄斑区光凝仍在DME的治疗中发挥重要作用。尽管如此,黄斑光凝治疗DME的作用机制尚不完全清楚,如何选择正确的光凝参数尚存争议。
相干光断层扫描(optical coherence tomography,OCT)成像具有模拟活体组织病理的作用,无创、简便,近年来成为DME诊断的金标准。频域OCT(spectraldomain OCT,SD-OCT)轴向分辨率达到 5 μm,横向分辨率为20 μm,可以观察活体视网膜微结构的细节信息。SD-OCT独特的eye-tracking技术可以精确观察视网膜上的特定部位在不同时间点的变化。本研究通过SD-OCT观察弥漫性DME经PASCAL格栅激光治疗后3个月内黄斑区视网膜微结构变化,以探讨格栅激光治疗DME的机制。
1 资料与方法
1.1 资料 共13例糖尿病患者于我院门诊按照ETDRS诊断标准确诊为有临床意义DME,其中男性5例(6眼),女性8例(9眼);年龄56~73岁,平均(59.7±5.3)岁。所有患者均为2型糖尿病,糖尿病史5~20年,目前血糖控制稳定。治疗前眼部检查包括ETDRS视力检查,散瞳后检眼镜(眼底镜)检查,眼底照相,荧光素眼底血管造影及SD-OCT。治疗后2 h、1周、1个月、3个月分别行眼底照相、SD-OCT检查。除治疗后2 h外,其余随访时间患者均接受ETDRS视力检查。排除标准包括:屈光间质浑浊(角膜、晶状体、玻璃体)影响眼底检查及成像,增生型糖尿病视网膜病变、其他疾病累及黄斑区如黄斑前膜或黄斑部牵引等。
1.2 方法 所有患者OCT均在充分散瞳下采用SD-OCT(Spectralis software version 4.0;Heidelberg Engineering,Germany)完成。扫描方式包括经中心凹线性扫描和黄斑区体积(volume)扫描,体积扫描范围以中心凹为中心进行39线或49线B-扫描。所有病例随访均采用follow-up模式,确保分析的精确性和可重复性。采用SD-OCT自带软件计算黄斑中心凹1 mm平均视网膜厚度代表黄斑中心视网膜厚度。
PASCAL激光:所有13例(15眼)黄斑区激光均由笔者在模式扫描激光(PASCAL;OptiMedica Corporation,Santa Clara,CA)下一次完成。采用532 nm倍频掺钕钇铝石榴石(neodymium-yttrium aluminum garnet,Nd:YAG)激光,通过预置黄斑格栅激光模式(光斑直径100 μm,曝光时间10 ms,光斑距中心凹至少1000 μm)进行C型、环形格栅或局灶性光凝。激光能量以100 mW为滴定点,上调至呈现轻度灰色光斑所需最低能量(光斑间距1~1.5光斑直径)。所有激光均在0.5%托吡卡胺和0.5%盐酸去氧肾上腺素混合液充分散瞳、盐酸奥布卡因表面麻醉后三面镜下操作。
1.3 统计学处理 本研究采用配对t检验比较治疗前后视力、黄斑区中心凹视网膜厚度的变化,P<0.05为差异有统计学意义。
2 结果
2.1 PASCAL激光后的临床疗效观察 所有患者采用的激光能量为145~245 mw,平均(202±33)mw,光斑数56~132(平均105)。15眼治疗后3个月平均ETDRS视力为(50.5±18.0)字母(27~78字母),较治疗前平均视力47±18字母(27~80字母)略有提高,治疗前后视力差异无统计学意义(P=0.22)。治疗前黄斑中心视网膜厚度平均为(409 ±100)μm(311~643 μm),激光治疗后1周为(404±98)μm,治疗后1个月黄斑中心凹视网膜厚度降低至(374.5±107.0)μm。治疗后3个月黄斑区中心凹厚度为(359.9 ±155.0)μm(275 ~478 μm),较治疗前显著降低(P=0.009)。
2.2 激光治疗后视网膜微结构在SD-OCT上的表现激光治疗后2 h,激光灶表现为边界相对清晰、柱状中高反射带,病灶范围从光感受器层延伸至外核层。所有患者视网膜内层结构均未见改变。激光灶处光感受器内外节连(inner segment/outer segment,IS/OS)光带破坏,轻度抬高,光感受器OS宽度增加,下方视网膜色素上皮(retinal pigment epithelium,RPE)变化不显著。有趣的是,部分柱状反射带(病灶)在光感受器层均呈垂直方向,而在外界膜(external limiting membrane,ELM)平面径路改变,表现为向心性倾斜而非垂直径向(图1A,2)。激光治疗后1周,柱状高反射带逐渐变得模糊,病灶范围明显缩小,与同步近红外眼底照相中激光病灶的直径变小一致,表明病灶开始修复。激光灶处RPE内表面出现颗粒状高反射灶(图3B、4B)。所有外核层高反射灶在激光后1个月完全消失。部分RPE颗粒状高反射灶随时间推移逐渐缩小甚至完全消失,伴ELM光带及IS/OS光带逐渐修复,至激光后3个月激光病灶在OCT上的改变完全消失。尽管如此,同步近红外眼底照相仍可清晰显示激光病灶形态(图1C、1D)。部分RPE颗粒病灶持续存在,少数颗粒病灶甚至较前扩大,根据颗粒病灶大小分别伴有ELM及IS/OS光带的不完全修复(图3C、3D、4C)。
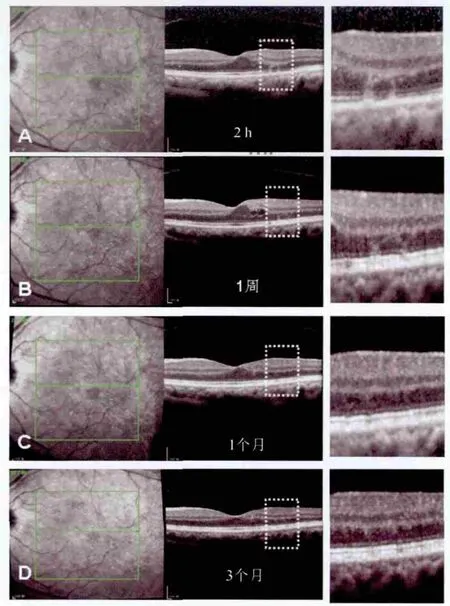
图1.病例1左眼DME患者经PASCAL激光治疗后2 h、1周、1个月及3个月黄斑区谱域OCT扫描(follow-up模式),右侧为左侧白框部分放大图A.激光治疗后2 h,激光灶表现为向心性倾斜柱状中高反射带,范围从光感受器层延伸至外核层;B.激光治疗后1周,柱状高反射带逐渐变得模糊;C.激光治疗后1个月,激光灶处ELM、IS/OS光带连续但局部略细;D.激光治疗后3个月,激光灶在OCT上改变消失,ELM、IS/OS光带连续,同步近红外眼底照相仍可见激光斑

图2.病例6右眼DME患者激光治疗后2 h黄斑区谱域OCT图像,右侧为左侧白框部分放大图A.经黄斑中心凹OCT显示激光灶向心性倾斜现象;B.位于中心凹下方扫描线显示激光病灶高反射灶与RPE垂直

图3.病例3右眼DME患者激光治疗后2 h、1周、1个月及3个月谱域OCT扫描显示激光灶处RPE变化,右侧为左侧白框部分放大图A.激光治疗后2 h,RPE光带在OCT上无明显变化;B.激光治疗后1周,激光灶处RPE内表面颗粒状高反射(红箭头);C.激光治疗后1个月,颗粒状高反射持续存在,ELM、IS/OS中断;D.激光治疗后3个月,右侧RPE颗粒灶明显增大,左侧RPE颗粒灶逐渐吸收,ELM修复,IS/OS仍中断(红箭头)
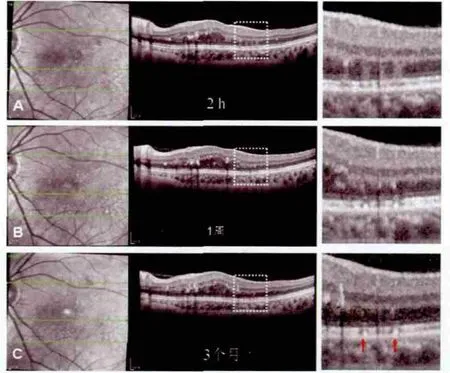
图4.病例10左眼DME患者激光治疗后2 h、1周、3个月激光灶处RPE不同OCT表现,右侧为左侧白框部分放大图A.激光治疗后2 h,OCT显示4处激光病灶,RPE光带完整;B.激光治疗后1周,激光灶处RPE内表面大小不一颗粒状高反射;C.激光治疗后3个月,2处RPE颗粒持续存在伴有OS/OS不连续(红箭头),其余2处RPE颗粒消失,IS/OS完全修复
3 讨论
本次研究通过SD-OCT观察活体DME患者经PASCAL激光后黄斑区视网膜微结构的变化。我们观察到激光治疗后2 h,激光病灶在OCT图像上均表现为特征性局限于外层视网膜的柱状高反射灶,病灶范围累及光感受器层、IS/OS光带、外界膜及外核层,视网膜内层无明显改变。Paulus等[3]病理研究显示,兔视网膜经7 ms脉冲激光1 h后,激光损伤主要位于视网膜外层,表现为外核层染色增强,光感受器内外节肿胀、破坏。因此,OCT上柱状高反射灶可能代表激光热能导致迅速水肿破坏的光感受器,这和细胞性水肿在OCT上常常表现为高反射表现是一致的。我们还观察到,部分激光灶在外核层表现为向心性倾斜,而在ELM平面方向及光感受器层改为垂直径向,这和以往视网膜全光凝时激光灶表现为和RPE垂直不一致。Bolz等[4]首次报道了激光治疗后24 h激光灶倾斜现象,认为倾斜的发生和人类黄斑区特殊的解剖结构有关,即除视锥细胞和视杆细胞垂直外,其余各层均向外侧倾斜。光凝后RPE和光感受器层产生热效应后,沿着视网膜内细胞结构传导导致倾斜现象发生。本研究中,我们在激光治疗后2 h也观察到部分激光病灶向心性倾斜现象,和以往报道一致。然而,我们发现倾斜现象并非发生在所有的激光病灶,在黄斑区volume扫描中,倾斜激光病灶多出现于扫描线经过中心凹的OCT图像中,远离中心凹扫描OCT图像中激光灶则为垂直径向(图2)。
传统激光热量对激光灶周围视网膜组织损伤造成视网膜下瘢痕、激光瘢痕扩大、中心暗点等潜在并发症使视力恢复受到很大限制。随着抗VEGF、激素等玻璃体腔注射药物的出现,黄斑区光凝作为DME的传统标准治疗方法面临严峻挑战。如何优化激光参数,在最大可能获得激光疗效的同时使激光热量对邻近正常视网膜神经组织损伤达到最小,减少激光的不良反应成为目前激光治疗的发展趋势。在能量、波长等众多激光参数中,优化脉冲持续时间一直以来成为关注的焦点。理论上,较短的脉冲时间持续大大减少了弥散到富含感觉神经的深层脉络膜的热量,减轻患者的疼痛不适,更为重要的是较短的脉冲意味着较少的激光热量向病灶周围弥散。有限的病理研究[5]比较不同脉冲时间激光对动物视网膜影响,结果显示较短的脉冲较传统脉冲对邻近的视网膜组织损伤更小,激光病灶较小,恢复更快,最终的病灶直径亦较小。本次研究运用PASCAL预置格栅激光脉冲时间仅为10 ms,经OCT证实所有激光病灶仅局限于外层视网膜,视网膜内层包括内核层、神经纤维层均未见累及;不仅如此,所有激光灶两侧IS/OS光带完整,意味着邻近光感受器无明显累及,而激光灶修复正是通过邻近部位正常光感受器迁移来实现的[6]。因此从减少视网膜损伤及激光病灶修复的角度,我们的研究表明10 ms脉冲是较为理想的激光参数。
视网膜色素上皮因富含黑色素可吸收50%的绿光,是激光治疗的主要靶组织,在修复内外血视网膜屏障方面起了重要作用。Paulus等[3]发现即使7 ms不可见光斑,激光治疗后1 h亦可观察到RPE细胞塌陷排列紊乱。本研究激光治疗后2 h,RPE光带在OCT上并无明显变化。一方面可能是由于受到分辨率限制,SD-OCT对于RPE细胞内细节变化尚不能显示;另一方面也说明短脉冲激光对RPE细胞的损伤相对较轻。激光治疗后1周,病灶处RPE内表面出现局灶性颗粒状高反射灶,部分颗粒病灶随时间推移逐渐吸收甚至消失,同时伴有ELM、IS/OS结构的恢复,但仍有部分颗粒病灶可保持至3个月甚至更为突出,并伴有IS/OS的不完全修复。对于RPE颗粒病灶的组成及产生尚不明确。最近,Lammer等[7]运用极性敏感性OCT技术发现激光后RPE表面颗粒病灶与RPE细胞极性增强有关。极性敏感性OCT技术的原理是通过监测特异性组织去极化的变化,从而对RPE组织和其他表现为高反射组织(如瘢痕)进行鉴别,RPE细胞去极化增强表明RPE细胞内黑色素颗粒浓度增高[8]。由此研究者推测颗粒病灶更多可能是由于激光损伤及微环境改变导致RPE细胞或富含色素的巨噬细胞移行或增殖,而不是以往认为的胶质瘢痕反应。通过本次研究,我们认为由于短脉冲对RPE细胞造成轻、中度损伤而非重度损伤,从而导致RPE细胞激活,因此激光后早期RPE内表面颗粒病灶可能是RPE代谢增强、细胞内脂褐素增加所致。这与以往研究显示激光后光斑自发荧光信号增强一致[9]。RPE激活后移行增殖不但有助于激光病灶处视网膜结构修复,而且通过RPE代谢激活后所介导的生物学效应如VEGF、TGF-β等细胞因子的变化也可促进DME的吸收[10]。后期没有吸收甚至增生的颗粒病灶则可能代表纤维瘢痕组织增殖,瘢痕形成可阻止光感受器向病灶部位移行,最终导致病灶的不完全修复。因此,理想的激光参数应该导致RPE细胞激活,而不是RPE细胞的瘢痕增殖。
本研究不足之处是小样本研究,观察病例数较少,随访时间较短。尽管如此,本研究通过SD-OCT观察PASCAL激光后DME患者视网膜微结构形态及变化特征,短脉冲产生的激光损伤局限于外层视网膜,对周围视网膜组织损伤小。SD-OCT是观察黄斑区激光前后视网膜微结构变化的有用工具,对于优化激光参数,探讨激光治疗的作用机制具有积极意义。
[1]Klein R,Klein BE,Moss SE,et al.The Wisconsin epidemiologic study of diabetic retinopathy.ⅩⅤ.The long-term incidence of macular edema[J].Ophthalmology,1995,102(1):7-16.
[2]Early Treatment Diabetic Retinopathy Study Research Group.Photocoagulation for diabetic macular edema.ETDRS report no.1[J].Arch Ophthalmol,1985,103:1796-806.
[3]Paulus YM,Jain A,Gariano RF,et al.Healing of retinal photocoagulation lesions[J].Invest Ophthalmol Vis Sci,2008,49(12):5540-5545.
[4]Bolz M,Kriechbaum K,Simader C,et al.In vivo retinal morphology after grid lasertreatmentin diabetic macularedema [J].Ophthalmology,2010,117(3):538-544.
[5]Jain A1,Blumenkranz MS,Paulus Y,et al.Effect of pulse duration on size and character of the lesion in retinal photocoagulation[J].Arch Ophthalmol,2008,126(1):78-85.
[6]Busch EM1,Gorgels TG,Van Norren D.Filling-in after focal loss of photoreceptors in rat retina [J].Exp Eye Res,1999,68(4):485-492.
[7]Lammer J,Bolz M,Baumann B,Pircher M,et al.Imaging retinal pigment epithelial proliferation secondary to PASCAL photocoagulation in vivo by polarization-sensitive optical coherence tomography[J].Am J Ophthalmol,2013,155(6):1058-1067.
[8]Baumann B,Baumann SO,Konegger T,et al.Polarization sensitive optical coherence tomography of melanin provides intrinsic contrast based on depolarization[J].Biomed Opt Express,2012,3(7):1670-1683.
[9]Muqit MM,Gray JC,Marcellino GR,et al.Fundus autofluorescence and Fourier-domain optical coherence tomography imaging of 10 and 20 millisecond Pascal retinal photocoagulation treatment[J].Br J Ophthalmol,2009,93(4):518-525.
[10]Ogata N,Ando A,Uyama M,et al.Expression of cytokines and transcription factorsin photocoagulated human retinalpigment epithelial cells[J].Graefes Arch Clin Exp Ophthalmol,2001,239(2):87-95.

