大麻素受体在大鼠视网膜中的表达和分布△
汪书越 李玲竹 苗艳颖 王中峰
大麻因具有治疗和精神作用而被吸食应用达上千年之久。大麻是桑科植物大麻(cannabis sativa)的提取物,其有效活性成分是四氢大麻酚(Δ9-tetrahydrocannabinol,Δ9-THC)。自从发现Δ9-THC后,一系列与其功能相似的化合物被合成,这些化合物统称为大麻素(cannbinoids)。在大麻素的研究过程中,一个重要的进展是在动物组织中发现大麻素的受体(cannbinoid receptor)。大麻素受体主要有CB1和CB22个亚型,均是7次跨膜的G蛋白耦联受体,二者的氨基酸序列有44%的同源性[1]。CB1受体主要分布在中枢神经系统,而CB2受体主要分布在免疫系统[2]。大麻素研究历程中的另一个重要进展是内源性大麻素(endocannbinoid,eCB),即大麻素受体的内源性配体的发现。有代表性的内源性大麻素有2类:N-花生四烯酸氨基乙醇(arachidonylethablamide,anandamine,AEA)和 2-花生四烯酸甘油(2-arachidonyl glycerol,2-AG)。已有文献[3-4]表明,广泛表达在中枢神经系统的内源性大麻素系统,通过作用于大麻素受体,调控多种生理功能,如影响学习记忆、痛觉感知、突触传递和突触可塑性等。
越来越多的证据[5-6]表明,大麻素受体信号系统在脊椎动物视网膜中有广泛分布。通过种属特异的多克隆抗体,在人、猕猴、小鼠、大鼠、鸡、金鱼和虎螈的视网膜中均发现有CB1受体的表达[7-8]。大麻素受体的内源性配体AEA[9]和内源性大麻素水解酶脂肪酸酰胺水解酶(fatty acid amide hydrolase,FAAH),在多种视网膜细胞上和内网状层上均有表达[7-8,10]。这些结果提示,内源性大麻素可能调控多种视网膜神经元的功能,并且在视觉信息处理的多种神经回路中起作用。神经节细胞是视网膜的唯一输出神经元,它整合视网膜的视觉信息,以动作电位的方式将信息输送至视觉中枢。尽管有研究[5-6]发现,多种动物视网膜神经节细胞有大麻素受体的表达,但对于CB1和CB2受体在大鼠视网膜神经节细胞上的分布特征和意义尚没有完全阐释清楚。本研究应用免疫组织化学等方法研究大麻素CB1、CB2受体在出生后1周、4周和12周大鼠视网膜组织,尤其是神经节细胞上的表达和分布情况,为进一步研究大麻素信号系统在视网膜网络组织的功能奠定基础。
1 材料与方法
1.1 实验动物 出生后1周、4周和 12周雄性Sprague-Dawley大鼠,购自上海斯莱克实验动物中心,清洁级。本实验所有动物实验均遵守美国眼科与视觉研究协会(ARVO)和复旦大学实验动物饲养管理及动物使用规定。实验中尽量减轻动物疼痛和不适,饲养温度维持在21℃,12 h光照/黑暗循环照明,给予充足的水、饲料和活动空间。
1.2 视网膜神经节细胞的上丘逆行追踪标记 参照先前的实验[11]进行。采用了在上丘注射霍乱毒素B亚基(cholera toxin subunit B,CTB)(List Biological Laboratories,USA)作为追踪物的方法来逆行标记视网膜神经节细胞。具体操作如下:大鼠后肢肌内注射氯氨酮(25 mg/kg)和甲苯噻嗪(10 mg/kg)混合剂全身麻醉后,上好耳杆,然后将其头部固定在立体定位仪(SR-6R,Narishige,Tokyo,Japan)上,全程注意监测其呼吸和体温。用0.5%聚维酮碘消毒皮肤,于正中切开皮肤,向下分离达颅骨,暴露颅骨,在骨缝交合处寻找Bregma点,然后以Bregma点向后6 mm、旁开2 mm、4~5 mm深度的位置定位上丘。用骨钻在双侧上丘相对应颅骨处小心打孔。用微量注射器在上丘位置分别注入2 μL 1%的 CTB溶液。缓慢注射,在6 min内完成。然后,缓慢取出微量注射器,用凝胶海绵堵塞颅骨上的钻孔,消毒并缝合颅顶皮肤。在逆行标记第5~6天处死动物,取出眼球,固定后切片。
1.3 视网膜标本制备 参考之前的工作[11-12]进行。用25%乌拉坦腹腔注射深度麻醉大鼠,迅速摘取眼球,浸入4%多聚甲醛溶液中,4℃固定2 h。依次在10%和20%蔗糖溶液中分别浸泡2 h,30%蔗糖溶液中4℃过夜梯度脱水。最后在角巩膜缘下约2 mm处环形切开,眼科剪环剪1周。弃去角膜、晶状体以及玻璃体的前半部分,将眼杯用最佳切削温度(optimal cutting temperature,OCT)(Miles Inc.,Elkhart,IN,USA)包埋剂包埋,再在冰冻切片机(Leica,Nussloch,Germany)沿垂直方向进行连续切片,片厚14 μm,依次收集于经预处理的玻片(Fisher,USA)上,储存于-20℃冰箱备用。
1.4 免疫荧光组织化学 将切片从-20℃冰箱取出,恢复至室温后用0.01 mol/L磷酸盐缓冲液(phosphatebuffered saline,PBS)漂洗5 min×3次。之后,置于含有3%正常驴血清、0.5%小牛血清和0.2%Triton X-100的PBS置于室温孵育2 h,以降低非特异性背景染色。然后加入一抗反应液,置于4℃冰箱孵育过夜。次日,用PBS漂洗10 min×3次以充分洗去未结合的一抗,加入对应的二抗,室温孵育2 h后,PBS漂洗3×15 min后,加入DAPI(1∶1000,Sigma)封片剂封片。在实验中用到的一抗有:羊抗 CTB多克隆抗体 (1∶2000,List Biological Laboratories,USA),小鼠抗Brn3单克隆抗体(1∶100,Santa Cruz,USA),兔抗 CB1 受体多克隆抗体(1∶300,Abcam,USA)和兔抗CB2受体多克隆抗体(1∶200,Sigma,USA)。二抗有488-耦联的驴抗羊或驴抗 鼠 IgG (1∶800,Jackson Immuno Research Laboratories,USA)和 Cy3-耦联的驴抗兔 IgG(1∶200,Jackson Immuno Research Laboratories,USA)。
经过免疫荧光反应的视网膜切片在共聚焦激光扫描显微镜下观察(Olympus,放大400倍)。对准备好的标本进行单层光学切片扫描并数字化记录,数据保存到电脑上。为了避免由于重塑产生叠加伪迹的可能性,在双标实验中对单层光学切片进行次第扫描。所得到的图片用Adobe Photoshop软件加以适当的调整和标注。
1.5 Western印迹法分析 迅速分离大鼠视网膜或者脑组织,加适量RIPA裂解液及蛋白酶抑制剂和含有磷酸酶抑制剂的 cocktail(Roche Applied Science,Mannheim,Germany)。经超声破碎仪(ultrasonic cell prosessor,Ningbo,China)破碎细胞后,以相对离心力15294×g,4℃ 离心30 min。收集离心后蛋白上清液,按4∶1加入5×上样缓冲液,煮沸6 min后,迅速放冰上冷却后于-40℃备用。将已制备好的蛋白样品加到10%SDS-PAGE上的梳孔中,然后利用Mini-PROTEAN 3电泳系统(Bio-Rad,Hercules,CA,USA)在120 V恒压条件下电泳90 min左右,从而将视网膜蛋白按相对分子质量大小在PAGE上依次分离开,在分离胶左上角做标记。之后再用 Mini Trans-Blot电转系统(Bio-Rad,Hercules,CA,USA)在恒流300 mA条件下转膜2 h,将蛋白从 PAGE上转印到 PVDF膜(Immobilon-P,Millipore,Billerica,Massachusetts,USA)上。待转印完成之后,用封闭液(含5%脱脂奶粉和0.05%Tween 20的TBS)室温下封闭转移后的 PVDF膜1 h。用1×TBST溶液适当漂洗之后,将PVDF膜转移到待检目的蛋白的抗体反应液中,置4℃孵育过夜。次日,用1×TBST溶液漂洗3次之后,加入二抗并在室温下孵育2 h。将二抗在1×TBST溶液漂洗3次,每次15 min后,将 PVDF膜用 Alpha凝胶成像仪 FluorChemE(ProteinSimple,USA)进行扫描并且获得图像。实验中用到的一抗为单克隆鼠抗β-actin(1∶1000,Sigma,USA);兔抗CB1受体多克隆抗体 (1∶300,Abcam,USA);兔抗 CB2受体多克隆抗体 (1∶250,Sigma,USA);二抗为IRDye 800CW 驴抗兔IgG(1∶10000;LI-COR Biosciences,USA)和 IRDye 800CW 驴抗鼠IgG(1∶10000;LI-COR Biosciences,USA)。
2 结果
2.1 CB1受体在成年大鼠视网膜的表达与分布 在成年(4周龄)大鼠视网膜垂直切片的免疫组织化学染色结果显示,CB1受体的免疫荧光信号(红色)广泛分布于视网膜(图1A)。在外核层(outer nuclear layer,ONL)、内核层(inner plexiform layer,INL)和神经节细胞层(ganglion cell layer,GCL),CB1受体阳性信号较强,且与细胞核的DAPI信号(蓝色)重叠,说明这些CB1受体表达在细胞上;在突触丰富的外网状层(outer plexiform layer,OPL)和内网状层(inner plexiform layer,IPL)也有较多的CB1受体阳性信号,说明在视网膜的细胞突起上也有CB1受体分布(图1A)。当CB1受体的抗体被相应的免疫抗原(Abcam,Cambridge,MA,USA)预先结合后,则检测不到任何阳性荧光信号(图1B),表明我们所用CB1受体的抗体是特异的。
在CTB逆行标记的大鼠视网膜垂直切片中,利用免疫荧光双标技术发现,GCL的CTB阳性神经节细胞(绿色,图1C)均被CB1受体的抗体所共标(红色,图1D)。从叠加后的图中可以清楚地看到,CTB所标记的视网膜神经节细胞全都是CB1受体免疫阳性的(如图1E中的4个小箭头所示)。此外,我们也观察到,有些CTB阴性的神经细胞也同样是CB1受体阳性的(如图1E中的大箭头所示),这些细胞可能是异位的无长突细胞。
为了进一步验证CB1受体在大鼠视网膜的表达,我们利用Western印迹法检测了大鼠视网膜CB1受体蛋白的表达。如图1F所示,视网膜组织抽提蛋白的Western印迹法结果呈单一条带(约45×103)。同时,我们用大鼠的大脑皮质蛋白提取物进行同样的实验,也得到了相同的单一条带。这些结果证明了大鼠视网膜组织表达CB1受体,而且也证明了我们所用的CB1受体抗体的特异性。
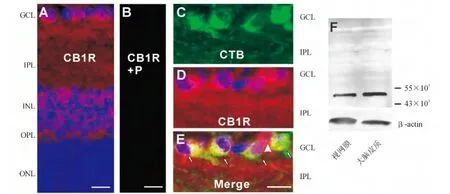
图1.大麻素CB1受体在大鼠视网膜的表达和分布
2.2 CB2受体在成年大鼠视网膜的表达与分布 大鼠视网膜垂直切片的免疫组织化学染色结果显示,CB2受体的免疫荧光信号(红色)在视网膜各层均有分布(图2A),其中在GCL、INL和ONL的细胞膜上有丰富的阳性信号,而且OPL和IPL也有广泛的CB2受体阳性信号。此外,在Müller胶质细胞的终足和突起上也观测到CB2受体的阳性信号(图2A)。当用相应的免疫抗原(Abcam,Cambridge,MA,USA)预吸附CB2受体的抗体,则在视网膜组织检测不到任何CB2受体的阳性荧光信号(图2B),证明了所用的CB2受体抗体的特异性。
在CTB逆行标记的大鼠视网膜垂直切片上,利用免疫荧光双标技术发现,在GCL所有CTB标记的神经节细胞(绿色,图2C),均可被CB2抗体标记(红色,图2D)。图2E显示两者叠加后的图像,可清楚看到,CTB所标记的视网膜神经节细胞全都是CB2受体免疫阳性的(如图2E中的小箭头所示)。在GCL中个别CTB阴性的细胞也可被CB2受体抗体标记,这些细胞可能是异位的无长突细胞。
Western印迹法结果显示,大鼠视网膜和大脑皮质组织均有CB2受体蛋白的表达,而且呈单一的条带,证明了其抗体的特异性(图2F)。
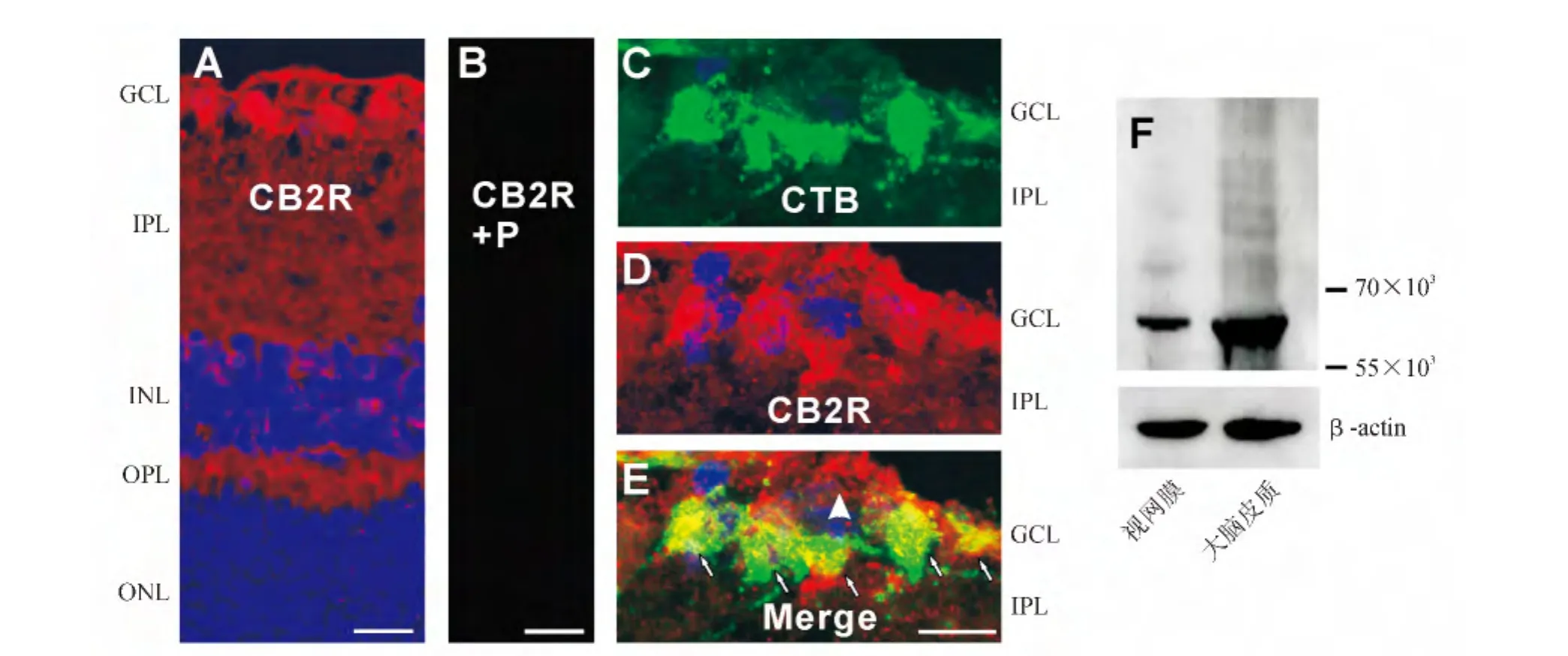
图2.大麻素CB2受体在大鼠视网膜的表达和分布
2.3 CB1和CB2受体在幼年和老龄大鼠视网膜的表达与分布 进一步观察了CB1和CB2受体在幼年(1周龄)和老龄(12周龄)大鼠视网膜组织的表达分布。如图3A和3E所示,1周龄大鼠视网膜垂直切片的免疫组织化学染色结果显示,CB1和CB2的免疫荧光信号(红色)在视网膜各层均有分布,包括GCL、INL和ONL的细胞膜,以及OPL和IPL。由于在新生低龄大鼠的上丘注射CTB逆行标记视网膜神经节细胞存在困难,我们用神经节细胞的特异标记物Brn3取代CTB来标记视网膜神经节细胞。利用免疫双标技术,在1周龄大鼠视网膜垂直切片上发现,GCL的Brn3阳性神经节细胞(绿色,图3B和3F)均被CB1或CB2受体的抗体所共标(红色,图3C和3G)。图3D和3H显示的是叠加后的图片,可以清楚地看到Brn3所标记的视网膜神经节细胞几乎都是CB1或CB2受体免疫阳性的(如图3D和3H中的小箭头所示)。
在视网膜垂直切片的免疫组织化学染色结果显示,CB1/CB2受体在老龄大鼠视网膜的表达分布与幼年和成年大鼠的相似,即在视网膜各细胞层(GCL、INL和ONL)以及突触层(IPL和OPL)广泛表达(红色信号)(图4A和4E)。在CTB逆行标记的12周龄大鼠视网膜垂直切片上,免疫荧光双标结果发现,在GCL几乎所有CTB标记的神经节细胞(绿色,图4B和4F),均可被CB1或CB2抗体标记(红色,图4C和4G)。从两者叠加的图4D和4H可清楚看到,CTB所标记的视网膜神经节细胞几乎都是CB1或CB2受体免疫阳性的(如图4D和4H中的小箭头所示)。

图3.大麻素CB1和CB2受体在幼年(1周龄)大鼠视网膜的表达和分布

图4.大麻素CB1和CB2受体在老龄(12周龄)大鼠视网膜的表达和分布
3 讨论
本文的研究结果发现,大麻素受体的2个亚型(CB1和CB2)在幼年、成年和老龄大鼠视网膜组织丰富表达和分布,几乎所有的神经节细胞均表达2种受体亚型,提示大麻素系统可能对神经节细胞的功能活动有重要的调控作用。
CB1受体在视网膜中最早的细胞定位是通过原位杂交方法在胚胎大鼠视网膜实现的,CB1受体mRNA在多种视网膜细胞上均有表达[13],之后,在鸡胚胎视网膜也发现有CB1受体mRNA的表达。通过种属特异的多克隆抗体发现,CB1受体表达在人、猕猴、小鼠、大鼠、鸡、金鱼和虎螈的视网膜大多数细胞及OPL和IPL。针对神经节细胞,CB1受体在除了鱼以外的其他几个物种视网膜上均有表达[7]。然而,关于CB1受体在大鼠视网膜神经节细胞表达的报道不尽一致。Yazulla等[8]报道,成年大鼠视网膜GCL细胞的胞体没有检测到CB1阳性信号,尽管在IPL的远端有点状阳性信号,但无法分辨细胞类型;其他实验室则发现,CB1受体在从新生到成年的大鼠神经节细胞均有表达[6-7],与此一致,我们利用免疫荧光双标技术,在幼年、成年和老龄大鼠视网膜神经节细胞的胞体和突起上发现CB1受体的表达,而且在GCL,一些异位的无长突细胞也表达CB1受体。造成这种差异的原因可能是他们所用的抗体不同。Yazulla等[8]所用抗体是识别胞外C1-C14序列,而Zabouri等[6]的抗体是识别C1-C77序列。在本文中,我们所用的抗体是识别胞内416-472序列。
关于CB2受体在视网膜表达和分布的研究相对较少。尽管利用原位杂交技术在胚胎大鼠视网膜没有检测到CB2受体 mRNA的存在[13],但后续的研究利用反转录聚合酶链反应(RT-PCR)和原位杂交技术在成年小鼠和大鼠视网膜检测到广泛分布的CB2受体mRNA[14]。最近,利用免疫组织化学技术研究发现,在大鼠视网膜色素上皮、光感受器细胞内侧片段、水平细胞、无长突细胞、GCL中的细胞和IPL的纤维上都有CB2受体的存在[15]。与此一致,我们也发现在幼年、成年和老龄大鼠视网膜有广泛分布的CB2受体,而且从出生到老龄,其表达和分布相似,提示在出生后早期这些受体的发育已经基本完成。鉴于视网膜GCL细胞有较多的异位无长突细胞,我们利用CTB逆行标记或Brn3标记神经节细胞,并利用免疫荧光双标技术,观察到几乎所有的大鼠视网膜神经节细胞均表达CB2受体。
已有的研究[5]表明,在视网膜广泛分布、激活的CB1受体对多种神经元的离子通道有抑制作用,可以调控视网膜对光信号的加工和处理。然而,有关CB1受体对视网膜神经节细胞功能的调控,目前资料还不多。利用膜片钳技术在培养的大鼠神经节细胞上发现,CB1受体激动剂浓度依赖性压抑高电压激活的钙离子通道电流[10]。此外,激活CB1受体也对视网膜产生神经保护作用。例如:大麻素抑制人眼活化状态的Müller细胞促炎症细胞因子的产生和释放,并提高抗炎介质的产生[16];CB1受体激动剂可以保护神经节细胞免受谷氨酸毒性的侵害以及由高眼压造成的缺血和神经节细胞数目的减少[17]。因此,进一步研究大麻素受体对视网膜神经节细胞功能的调控,将有助于理解视觉信息在视网膜的加工和处理,以及该受体系统对视网膜神经元保护的机制。
[1]Howlett AC,Barth F,Bonner Tl,et al.International Union of Pharmacology.XXVII.Classification of cannabinoid receptors[J].Pharmacol Rev,2002,54(2):161-202.
[2]Munro S,Thomas KL,Abu-Shaar M.Molecular characterization of a peripheral receptor for cannabinoids[J].Nature,1993,365(6441):61-65.
[3]Wilson RI,Nicoll RA.Endogenous cannabinoids mediate retrograde signalling at hippocampal synapses [J].Nature,2001,410(6828):588-592.
[4]Chevaleyre V,Takahashi KA,Castillo PE.Endocannabinoid-mediated synaptic plasticity in the CNS[J].Annu Rev Neurosci,2006,29(1):37-76.
[5]Yazulla S.Endocannabinoids in the retina:from marijuana to neuroprotection[J].Prog Retin Eye Res,2008,27(5):501-526.
[6]Zabouri N,Bouchard J F,Casanova C.Cannabinoid receptor type 1 expression during postnatal development of the rat retina[J].J Comp Neurol,2011,519(7):1258-1280.
[7]Straiker A,Stella N,Piomelli D,et al.Cannabinoid CB1 receptors and ligands in vertebrate retina:localization and function of an endogenous signaling system[J].Proc Natl Acad Sci USA,1999,96(25):14565-14570.
[8]Yazulla S,Studholme KM,Mcintosh HH,et al.Immunocytochemical localization of cannabinoid CB1 receptor and fatty acid amide hydrolase in rat retina[J].J Comp Neurol,1999,415(1):80-90.
[9]Devane WA,Hanus L,Breuer A,et al.Isolation and structure of a brain constituent that binds to the cannabinoid receptor[J].Science,1992,258(5090):1946-1949.
[10]Lalonde MR,Jollimore CA,Stevens K,et al.Cannabinoid receptormediated inhibition of calcium signaling in rat retinal ganglion cells[J].Mol Vis,2006,12:1160-1166.
[11]Chen J,Miao Y,Wang XH,et al.Elevation of p-NR2A(S1232)by Cdk5/p35 contributes to retinal ganglion cell apoptosis in a rat experimental glaucoma model[J].Neurobiol Dis,2011,43(2):455-464.
[12]Ji M,Miao Y,Dong LD,et al.Group I mGluR-mediated inhibition of Kir channels contributes to retinal Müller cell gliosis in a rat chronic ocular hypertension model[J].J Neurosci,32(37):12744-12755.
[13]Buckley NE,Hansson S,Harta G,et al.Expression of the CB1 and CB2 receptor messenger RNAs during embryonic development in the rat[J].Neuroscience,1998,82(4):1131-1149.
[14]Lu QJ,Straiker A,Lu QX,et al.Expression of CB2 cannabinoid receptor mRNA in adult rat retina[J].Vis Neurosci,2000,17(1):91-95.
[15]López EM,Tagliaferro P,Onaivi ES,et al.Distribution of CB2 cannabinoid receptor in adult rat retina[J].Synapse,2011,65(5):388-392.
[16]Krishnan G,Chatterjee N.Endocannabinoids alleviate proinflammatory conditions by modulating innate immune response in muller glia during inflammation[J].Glia,2012,60(11):1629-1645.
[17]Nucci C,Gasperi V,Tartaglione R,et al.Involvement of the endocannabinoid system in retinal damage after high intracellular pressure-induced ischemia in rats[J].Invest Ophthalmol Vis Sci,2007,48(7):2997-3004.

