吸脂组织中脂肪干细胞分离和定向分化的研究
白晓东, 柳晓杰, 刘贤华, 王佳哲, 刘维维
实验研究
吸脂组织中脂肪干细胞分离和定向分化的研究
白晓东, 柳晓杰, 刘贤华, 王佳哲, 刘维维
目的探讨吸脂组织中的干细胞分离和体外诱导分化为表皮样细胞、成骨细胞及脂肪细胞的可能性。方法通过电动负压吸引获取1例行吸脂手术的30岁女性腹部脂肪组织,酶消化法获取脂肪来源干细胞,体外培养扩增,通过流式细胞仪检测表面抗原的表达。取生长良好的第3代人脂肪来源干细胞,分别应用成表皮诱导培养液(70%培养液A+30%成纤维细胞培养基上清液+10 ng/L表皮生长因子),成骨诱导培养基(DMEM/10%FBS,0.1 μmol/L地塞米松,50 μmol/L维生素C,10 mmol/Lβ-甘油磷酸钠, 100 U/ml 青霉素, 100 U/ml链霉素)和成脂肪细胞诱导培养基(DMEM+10%FBS+500 μmol/L 1-甲基-3-异丁基黄嘌呤+1 μmol/L吲哚美辛)诱导20 d后,分别对成表皮诱导组进行免疫组化检测CK19表达,成骨诱导组进行碱性磷酸酶检测,成脂诱导组进行油红O检测。结果流式细胞仪鉴定结果示,人脂肪来源干细胞CD44和CD49d为阳性,CD34为阴性。诱导20 d后,成表皮诱导组示免疫组织化学鉴定结构显示有CK19的表达;成骨诱导组示细胞碱性磷酸酶染色阳性;成脂肪细胞诱导组示油红O染色,胞质内脂滴均被染成红色,证实为脂性液体。结论从吸出的脂肪组织中分离出脂肪来源干细胞,在体外进行了脂肪干细胞的扩增和传代,所分离的脂肪来源干细胞具备多向分化能力。
脂肪来源干细胞; 分化; 吸脂
吸脂是常见的整形手术,脂肪来源干细胞(adipose derived stem cells, ADSCs)是成体间质干细胞之一[1],存在于脂肪组织中,具备多项分化能力,可以分化为脂肪细胞以及其他类型细胞[2-4]。自2012年12月至2013年12月,我们对吸脂术中吸出的脂肪进行分离,制备出具备扩增和多向分化的脂肪干细胞,为解释吸脂术后局部脂肪增生和利用脂肪干细胞修复组织提出依据。
1 对象与方法
1.1 ADSCs的体外分离培养
脂肪组织来自1例在武警总医院烧伤整形科就诊的30岁健康女性,已签署知情同意书。电动负压吸引获取腹部脂肪组织20 ml,用D-Hank′s液反复冲洗脂肪组织3次以上,尽量去除脂肪组织中肉眼可见的纤维及血管成分,剪碎脂肪组织,加入3倍体积的0.1%Ⅰ型胶原酶溶液,37 ℃振荡消化60 min后液面分为3层,吸出下层液体,过滤,1000 r/min离心5 min,制成细胞悬液,加入红细胞裂解液,静置后离心5 min,以充分去除胶原酶及残余红细胞裂解液。所得细胞按2×107/L浓度接种于25 cm×25 cm培养瓶中,置于37 ℃、5%CO2培养箱中,生长至70%~80%融合时进行传代,按照1∶3比例重新接种至培养瓶中[5]。
1.2 分离ADSCs的鉴定
加入CD34、CD49d及CD44的一抗,悬浮细胞,37 ℃孵育30 min,离心,弃上清。 PBS 1 ml,重新悬浮细胞,离心,弃上清,洗去多余一抗。按1∶100比例加入结合FITC的二抗,37 ℃孵育30 min,离心,弃上清。将细胞悬液移入流式细胞仪专用试管,上机检测。CellQuest软件分析结果。
1.3 干细胞的诱导分化
取生长良好,达到90%融合的第3代人ADSCs,分别应用成表皮诱导培养液(70%培养液A+30%成纤维细胞培养基上清液+10 ng/L 表皮生长因子),成骨诱导培养基(DMEM/10%FBS,0.1 μmol/L地塞米松, 50 μmol/L维生素C, 10 mmol/L β-甘油磷酸钠, 100 U/ml 青霉素, 100 U/ml链霉素),成脂肪细胞诱导培养基(DMEM+10% FBS+500 μmol/L 1-甲基-3-异丁基黄嘌呤+1 μmol/L吲哚美辛),各自设置对照组,对照组用基础培养基。置培养箱中培养,传代,诱导20 d后分别对成表皮诱导组进行免疫组化检测CK19表达,成骨诱导组进行碱性磷酸酶检测,成脂诱导组进行油红O检测。各自对照组也进行相应检测。
1.4 诱导后细胞的测定
1.4.1 成表皮诱导组免疫细胞化学染色 取诱导20 d后的细胞,加入鼠抗人CK19一抗(阴性对照组加入PBS),4 ℃孵育过夜。次日取出,加入辣根过氧化物酶标记羊抗鼠二抗室温孵育30 min,加入DAB显色。对照组进行相同处理。
1.4.2 成骨诱导组碱性磷酸酶染色(钙钴法) 取诱导20 d后的细胞,加入95%乙醇固定30 min,干燥,加入37 ℃碱性磷酸酶孵育液2 h(pH 9.2~9.4,2%巴比妥钠5 ml,3%β-甘油磷酸钠5 ml,2%硝酸钙10 ml,2%硫酸镁5 ml,蒸馏水25 ml)。对照组进行相同处理。
1.4.3 成脂诱导组油红O染色 取诱导20 d后的细胞,1×104/ml接种于6孔培养板,培养2 d后去除孔内培养基, 用预冷的10%甲醛固定10 min, 油红O染液室温染色30 min, 苏木素复染5 min。倒置显微镜下观察并及时拍照。对照组进行相同处理。
2 结果
2.1 吸脂组织中ADSCs的分离和培养
接种24 h后,多数已贴壁,呈短梭形或小多角形。接种48 h后,细胞体积增大,开始分裂增殖,细胞渐呈长梭形,高倍镜下可见单个细胞的胞浆较丰富,核较大且居中,核仁、核膜明显。传代24 h后,人ADSCs开始贴壁、伸展,恢复梭形形态,大小较一致,增殖迅速,一般7、8 d即可形成单层汇合(图1)。 所分离ADSCs的表面抗原特性, CD44、CD49d阳性,CD34阴性。
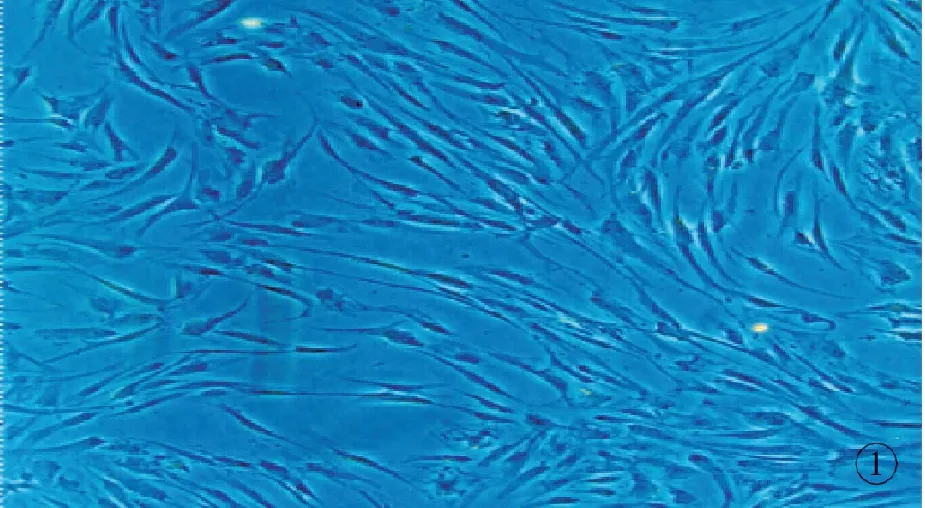
图1 第3代脂肪干细胞 (×100)
Fig1 ADSCs at 3rd passage (×100).
2.2 ADSCs定向分化
2.2.1 ADSCs向表皮样细胞诱导分化结果 经诱导后,诱导组细胞由原来的长梭形成纤维细胞状结构逐渐变短,细胞紧密排列成片,而对照组细胞未见变化,仍为原来的长梭形成纤维细胞状。诱导培养20 d后的细胞化学鉴定结构显示,有CK19阳性结果(图2)。对照组未见CK19阳性细胞。
2.2.2 人ADSCs成骨诱导分化结果 诱导组诱导20 d后,部分细胞形态发生明显变化,由梭形转化为多角形,胞核变大变圆,细胞体积增大,突起增多,胞浆中可见细小黑色颗粒,细胞常围绕集落中央呈岛状分布。对照组细胞未出现相应变化,仍为长梭形成纤维细胞状。碱性磷酸酶染色显示,诱导组存在阳性结果,细胞呈灰黑色,提示ADSCs有向成骨细胞分化的趋势(图3)。对照组示阴性结果。
2.2.3 人ADSCs成脂诱导分化结果 成脂诱导20 d后,倒置显微镜下可见部分细胞的胞浆内出现多个高折光性的圆形小脂滴,细胞形状也由原来的梭形逐渐变圆。随诱导时间的延长,出现脂滴的细胞逐渐增多。油红O染色示细胞内出现亮红色的颗粒,证明胞浆内容物确为脂肪滴(图4)。对照组无明显变化,仍为梭形细胞,未见胞浆内脂滴。
3 讨论
有些患者吸脂术后出现明显的复发,普遍认为与脂肪内存在干细胞有很大关系。目前分离常用酶消化法来提取ADSCs,本研究通过电动负压吸引获取脂肪组织20 ml,用眼科剪尽量去除脂肪组织中肉眼可见的纤维及血管成分,剪碎脂肪组织,加入Ⅰ型胶原酶溶液,消化60 min后,吸出最下面含细胞层液体,裂解红细胞后贴壁培养,生长至70%~80%融合时进行传代,我们所看到的细胞形态一致,很少有杂质细胞。ADSCs不表达造血细胞表面抗原如造血前体细胞标志抗原CD34、白细胞标志抗原CD45、淋巴细胞表面抗原CD11a 等,只表达CD29、CD44、CD105、CD166和CD49d。
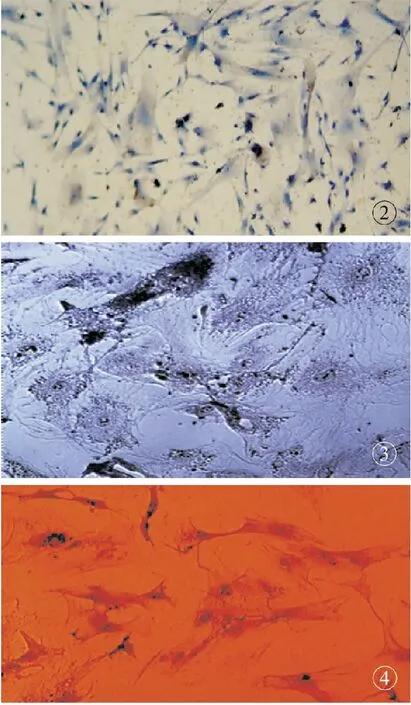
图2 免疫组化示CK19 阳性 (×100)图3 碱性磷酸酶阳性 (×100)图4 油红染色阳性(×200)
Fig2 Positive expression of CK19 (IHC×100).Fig3 Positive expression of ALP (IHC×100).Fig4 Positive expression of human ADSCs by oil red staining (×200).
为证明所分离细胞具有多向分化潜能,选取第3代的细胞,分别采用表皮细胞诱导液、骨细胞诱导液和脂肪细胞诱导液进行定向诱导,证实可以出现相应的标志,表皮表型CK19阳性,骨样细胞的碱性磷酸酶阳性和脂肪油红O染色阳性。
术中,我们为提出ADSCs,采用的是单纯肿胀负压吸脂,未采用超声吸脂;在所吸出的20 ml脂肪液,经过分离贴壁培养24 h,即可分离出ADSCs,连续传代细胞活性没有改变,说明在人体脂肪中大量存在干细胞,在体内环境下可以分化为脂肪细胞,也可说明为什么吸脂术后有些患者效果不明显,即所谓的“反弹”。
干细胞研究的快速发展,为组织工程技术构建人体组织、器官提供了充足可靠的种子细胞[6-7]。根据干细胞的来源不同可分为胚胎干细胞(embryonic stem cell, ESC)和来源于出生后器官或成年个体组织的干细胞或成体干细胞(adult stem cell, ASC)。近年研究表明,ADSCs的多向分化潜能和方便获取使其受到广泛关注[8-9],ADSCs可通过负压抽吸获取,取材较易又避免了伦理问题,脂肪干细胞具有高度自我更新能力、免疫源性低等优点,是理想的组织工程学种子细胞[10-13],并分泌多种细胞因子[14-15]。若将此干细胞诱导分化为表皮细胞,作为创面修复的理想种子细胞将成为治疗创面缺损的新思路。
[1] 陶 凯. “循证”脂肪来源干细胞[J]. 中国美容整形外科杂志, 2013,24(10):577-579.
[2] Shojaei S, Tafazzoli-Shahdpour M, Shokrgozar MA, et al. Effects of mechanical and chemical stimuli on differentiation of human adipose-derived stem cells into endothelial cells[J]. Int J Artif Organs, 2013,36(9):663-673.
[3] Liu Y, Zhang Z, Qin Y, et al. A new method for Schwann-like cell differentiation of adipose derived stem cells[J]. Neurosci Lett, 2013,551:79-83.
[4] Zhang K, Zhang Y, Yan S, et al. Repair of an articular cartilage defect using adipose-derived stem cells loaded on a polyelectrolyte complex scaffold based on poly(l-glutamic acid) and chitosan[J]. Acta Biomater, 2013,9(7):7276-7288.
[5] 雷永红, 付小兵, 盛志勇, 等. 诱导脂肪干细胞向表皮细胞表型的转分化研究[J]. 中华实验外科杂志, 2006,23(12):1536-1538.
[6] Ramas TV, Wang T, Maci CB, et al. Adipose stem cell side population in the mouse[J]. J Tissue Eng Regen Med, 2009,3(6):430-441.
[7] 张 健, 杨 晶, 杨光艳, 等. 脂肪干细胞与人工骨混合后的成骨作用研究[J]. 组织工程与重建外科杂志, 2012,8(3):135-139.
[8] Banas A, Teratani T, Yamamoto Y, et al. Adipose tissue-derived mesenchymal stem cells as s source of human hepatocytes[J]. Hepatology, 2007,46(1):219-228.
[9] Zhu LH. Progress in stem cell research news[J]. Chin J Cell Biol, 2012,34(2):197-200.
[10] Gimble JM. Adipose tissue-derived therapeutics[J]. Expert Opin Biol Ther, 2003,3(5):705-713.
[11] Hsu VM, Stransky CA, Bucky LP, et al. Fat grafting′s past, present,and future:why adipose tissue is emerging as acritical link to the advancement of regenerative medicine[J]. Aesthet Surg J, 2012,32(7):892-899.
[12] Choi J, Minn KW, Chang H. The efficacy and safety ofplatelet-rich plasma and adipose-derived stem cells:anupdate[J]. Arch Plast Surg, 2012,39(6):585-592.
[13] Ren ML, Peng W, Yang ZL, et al. Allogeneic adipose-derived stem cells with low immunogenicity constructingtissue-engineered bone for repairing bone defects in pigs[J]. Cell Transplant, 2012,21(12):2711-2721.
[14] Lee JH, Lee KH, Kim MH, et al. Possibility of undifferentiated human thigh adipose stem cells differentiating into functional hepatocytes[J]. Arch Plast Surg, 2012,39(6):593-599.
[15] Uysal CA, Tobita M, Hyakusoku H, et al. Adipose-derived stemcells enhance primary tendon repair: biomechanical and immunohistochemical evaluation[J]. J Plast Reconstr Aesthet Surg, 2012,65(12):1712-1719.
Researchofisolationanddirectionaldifferentiationofadiposederivedstemcellsaftersuctionlipectomy
BAIXiao-dong,LIUXiao-jie,LIUXian-hua,etal.
(DepartmentofBurnandPlasticSurgery,theGeneralHospitalofChinesePeopleArmedPoliceForce,Beijing100039,China)
ObjectiveTo observe the formation possibility of epidermic cells, skeletogenous cells and adipose cells by isolation and directional differentiation of adipose derived stem cells (ADSCs) in vitro.MethodsHuman abdominal adipose tissues were obtained by vacuum aspiration technique of suction lipectomy surgery from a 30-year-old woman. ADSCs were gotten by digestion and amplification. CD antigen was detected by flow cytometry. The ADSCs at 3rd passage were induced in epidermic cells′ culture solution (70% culture solution A+30% supernatant fluid from fibroblast medium+10 ng/LEGF) , skeletogenous cells′ culture solution (DMEM/10%FBS,0.1μmol/L desacort, 50μmol/L vitamin C, 10 mmol/L sodium β-glycerophosphate, 100 U/ml penicilin, 100 U/mlphytomycin)and adipose cells culture solution (DMEM+10% FBS+500 μmol/L IBMX+1 μmol/L antinfan) respectively. the expression CK19 in the group which was induced into epidermic cells was detected by IHC, ALP in the group which was induced into skeletogenous cells was detected and the rathonum red in the third group was checked.ResultsThe expression of CD44 and CD49 was positive and CD34 was negative by flow cytometry. The expression of CK19 in the group which was induced into epidermic cells was positive at 20 days after induction, ALP in the group which was induced into skeletogenous cells was positive and the rathonum red in the third group was positive.ConclusionHuman adipose derived stem cells can be obtained from human adipose tissue after suction lipectomy. The ADSCs can be differentiated into epidermic cells, skeletogenous cells and adipose cells in vitro.
Adipose derived stem cells; Differentiation; Suction lipectomy
武警部队资助项目(WZ2006006)
100039 北京, 武警总医院 (烧伤整形科:白晓东,柳晓杰,王佳哲,刘维维;医疗科:刘贤华)
白晓东(1969-),男,山西太原人,主任医师,博士.
10.3969/j.issn.1673-7040.2014.07.022
R622.9
A
1673-7040(2014)07-0443-04
2014-03-25)

