猪乳铁蛋白在4种重组乳杆菌中的表达及抑菌活性比较
于慧,姜艳平,崔文,武啸,何佳,乔薪瑗,李一经,唐丽杰,
1 东北农业大学生命科学学院,黑龙江 哈尔滨 150030
2 东北农业大学动物医学学院,黑龙江 哈尔滨 150030
近年来,随着人们对食品安全问题关注度的提高,抗生素作为饲料添加剂的乱用问题也日益受到人们的重视。长期连续使用抗生素会导致出现耐药性[1]以及畜牧产品中抗生素残留[2],寻找安全有效的抗生素替代品已经成为畜牧业关注的热点。
乳铁蛋白 (Lactoferrin, LF)是哺乳动物体内一种天然的铁结合糖蛋白,主要由中性粒细胞分泌,广泛存在于动物的乳汁 (初乳)、胆汁、唾液、胃液和小肠液等分泌液中[3-4]。乳铁蛋白具有很多重要的生理功能,它不仅能抗微生物,为每天大量病原微生物入侵的黏膜系统提供了第一道也是非常重要的防线[5-7],还具有免疫调节、抗感染、抑制肿瘤生长等功能[8-9]。近年来,乳铁蛋白被广泛应用于饲料添加剂、免疫调节剂和高效补铁剂等方面[10]。乳铁蛋白已经在许多原核表达系统,如大肠杆菌、酵母菌和干酪乳杆菌表达系统中获得了表达[11-16]。
然而,传统的从初乳中提取纯化乳铁蛋白存在着很多弊端,如原料来源有限、工艺繁琐、耗资高,而大肠杆菌、酵母菌等基因工程的宿主菌或是动物细胞,表达的外源蛋白大多需纯化,而纯化工艺复杂,这就成为乳铁蛋白用于生产实践的障碍。然而乳酸菌是食品级益生菌,由于其营养价值高、生长迅速、操作简单等优点成为表达外源蛋白、作为活载体疫苗的理想选择[17-18]。另外乳酸菌对铁的需求量低,不会被乳铁蛋白抑制。
本研究优化合成了猪乳铁蛋白(Porcine lactoferrin, Plf)成熟肽编码序列,并将其克隆到乳杆菌表达载体中,构建了 4种表达猪乳铁蛋白的重组乳杆菌,并对 4种重组乳杆菌表达产物的体外抑菌活性进行了比较,为筛选最佳生物学活性的重组猪乳铁蛋白以及其进一步在生产中应用奠定了基础。
1 材料与方法
1.1 菌种和质粒
戊糖乳杆菌 Lactobacillus pentosus KLDS1.0413、植物乳杆菌Lactobacillus plantarum KLDS1.0344;副干酪乳杆菌 Lactobacillus paracasei KLDS1.0652分离自乳品科学教育部重点实验室;大肠杆菌Escherichia coli JM109、金黄色葡萄球菌 Staphylococcus aureus CVCC26003、鼠伤寒沙门氏菌 Salmonella typhimurium SL1344、李氏杆菌 Listeria CVCC0586、巴氏杆菌 Pasteurella multocida P1059均为致病菌,分离自东北农业大学动物医学院菌种保藏室;干酪乳杆菌 Lactobacillus casei ATCC393、乳酸菌穿梭表达分泌型载体质粒pPG612.1由荷兰Jos Seegers博士惠赠。
1.2 培养基、工具酶和主要试剂
标准 LB培养基,MRS培养基(蛋白胨10.0 g,牛肉膏8.0 g,酵母膏5.0 g,柠檬酸氢二铵2.0 g,葡萄糖20.0 g,无水乙酸钠5.0 g,磷酸氢二钾2.0 g,硫酸镁0.58 g,硫酸锰0.25 g,吐温80 1.0 mL,蒸馏水900 mL。调pH 至6.4,定容至1 000 mL,121 ℃灭菌15 min)。固体培养基在此基础上加琼脂15.0 g。
兔抗 Plf兔血清 (实验室自制)[19],辣根过氧化物酶标记的山羊抗兔IgG、限制性核酸内切酶、DNA 聚合酶、T4 DNA 连接酶、ExTaq酶、DL 8 000 DNA marker均购自TaKaRa公司;小量质粒提取试剂盒与小量DNA胶回收试剂盒购自中科瑞泰生物有限公司;溶菌酶、氯霉素购自Sigma公司。
1.3 基因优化合成与引物
根据GenBank上已经公布的猪乳铁蛋白氨基酸序列 (登录号L77887),分析其同源序列和保守区域,结合运用 ExPASY网站进行分析,根据乳杆菌的密码子偏嗜性[20],将序列中的稀有密码子改为乳杆菌优势密码子,由生工生物工程 (上海)有限公司优化合成 2 016 bp的猪乳铁蛋白基因序列 (GenBank Accession No.KJ003838)。
根据优化合成的基因序列,用Primer软件设计一对引物,由北京博仕生物技术有限公司合 成 , 引 物 序 列 为 : 上 游 引 物 (5′–3′):GGATCCTCCTAAGAAGGGGGTTC;下游引物(5′–3′):CTCGAGCTATTACGTGGCGATAG。
1.4 表达猪乳铁蛋白重组乳杆菌的构建和鉴定
1.4.1 重组质粒的构建与鉴定
pPG612.1质粒用BamHⅠ和XhoⅠ双酶切,酶切反应体系37 ℃水浴2 h,用1%琼脂糖凝胶电泳分离后回收3 290 bp的片段,用0.8%琼脂糖凝胶电泳鉴定,鉴定正确的线性化 pPG612.1与Plf成熟肽编码序列进行连接,体系于连接仪中16 ℃连接过夜。连接产物转化大肠杆菌TG1,在10 µg/mL的LB氯霉素选择性培养基平板上37 ℃培养12 h。挑取单菌落,37 ℃振荡培养10 h,用小量质粒DNA提取试剂盒提取重组质粒,通过单、双酶切和 PCR方法鉴定,并将提出的阳性克隆命名为pPG612.1-plf (图1)。
1.4.2 重组乳杆菌的构建和鉴定
干酪乳杆菌 ATCC393、戊糖乳杆菌KLDS1.0413、植物乳杆菌 KLDS1.0344和副干酪乳杆KLDS1.0652分别制备感受态细胞[21]。
电转化(根据美国BTX公司Transformation Apparatus BTX EC399 使用说明书进行):将鉴定正确的 pPG612.1-plf质粒分别与 4种乳杆菌的感受态细胞混合,冰浴5 min;将混合物转入无菌预冷的2 mm电转化杯中;选择2 200 V电压,立刻电击;之后迅速加入1 mL冰预冷的含有20%蔗糖的MRS液体培养基;37 ℃静置培养2 h;取100 µL菌液涂布于含有10 µg/mL氯霉素的MRS琼脂培养基上,37 ℃培养36 h。
挑取单个菌落,接种于含10 µg/mL氯霉素的MRS培养基中,37 ℃培养16 h,用小量质粒DNA提取试剂盒提取重组质粒。对重组质粒pPG612.1-plf进行单、双酶切鉴定和PCR鉴定。鉴定正确后保存重组菌菌种。
图1 pPG612.1-plf质粒图谱Fig. 1 The schematic structure of pPG612.1-plf.
1.5 重组乳杆菌的诱导表达和表达产物的鉴定
1.5.1 重组乳杆菌的诱导表达
分别取 4种鉴定正确的重组乳杆菌菌种在10 µg/mL的氯霉素抗性的 MRS平板上划线活化培养,挑取单菌落接种于5 mL含10 µg/mL氯霉素抗性的MRS液体培养基中,37 ℃静置、厌氧培养16 h。取培养菌液按1∶100比例接种于氯霉素抗性的MRS液体培养基中,待培养液OD600值大于1,将菌液在无菌条件下离心,收集菌体沉淀,用MRS (不含葡萄糖)液体培养基悬起,并加入适量的诱导剂木糖,37 ℃诱导24 h。以转化pPG612.1质粒的重组乳杆菌作为对照,同时用同样的方法诱导。
1.5.2 重组乳杆菌表达产物的 Western blotting鉴定
方法如下[22]:三氯乙酸(TCA)沉淀法浓缩处理样品。
配制12% SDS-PAGE凝胶,每孔上样量为20 μL,上样时保证每孔蛋白总量一样,初始电压为80 V,待指示剂进入分离胶时,电压提高至120 V,至电泳结束。
SDS-PAGE 结束后,切下用于Western blotting检测的凝胶,50 A恒流转印55 min,结束后,将NC膜浸入20 mL 5%脱脂乳的PBS封闭液中室温摇动封闭2 h,用PBST洗膜3次;接着将NC膜放入用上述封闭液 1∶200稀释的一抗 (兔抗 Plf血清)溶液中,37 ℃作用1.5 h,用PBST洗膜3次;再将NC膜转入用上述封闭液1∶2 000倍稀释的酶标二抗 (HRP标记的羊抗兔IgG)溶液中,37 ℃作用2 h,取出NC膜,用PBST洗膜3次,洗去二抗后ECL显色,曝光2 min,显影30 s,定影2 min。
1.5.3 激光共聚焦检测重组菌菌体表达蛋白
分别取0.5 mL诱导后的重组菌,5 000 r/min离心3 min;菌体沉淀用PBS缓冲液洗3次,加入5 mL PBS 1∶100 稀释的兔抗Plf血清作为一抗,37 ℃孵育1 h;5 000 r/min离心3 min,弃上清,用无菌PBS洗3次,加入5 mL PBS 1∶200稀释的FITC标记的山羊抗兔IgG作为二抗,37 ℃孵育1 h;5 000 r/min离心3 min,弃上清,用无菌PBS洗3次;在避光条件下:用500 μL PBS 1∶1 000稀释的DAPI染料充分悬起细菌,室温避光作用15 min;5 000 r/min离心3 min,弃上清,用无菌PBS洗5次;菌体用200 μL PBS悬起,取10 μL涂片,待其干燥,用共聚焦显微镜观察。
1.6 ELISA方法比较4种重组乳杆菌猪乳铁蛋白表达量
采用间接ELISA方法检测表达上清中的目的蛋白,分别设带有pPG612.1空载体的重组乳杆菌上清液作为阴性抗原对照,未免疫重组猪乳铁蛋白的兔血清作为阴性抗体对照,以不同倍比稀释的Plf标准品作为阳性抗原对照。
以4种重组乳杆菌在同样诱导条件下诱导表达上清为抗原,包被96孔ELISA反应板,每孔加入300 μL上清液,4 ℃包被过夜。用PBST洗板3次;每孔加300 μL含5%脱脂乳的PBS封闭液,37 ℃封闭2 h,用PBST洗板3次;分别用PBS缓冲液1∶200稀释的兔抗Plf血清作为一抗,每孔100 μL,孵育1 h,用PBST洗板3次;接着每孔加入100 μL封闭液1∶3 000稀释的酶标二抗(HRP标记的羊抗兔IgG),37 ℃孵育1 h,用PBST洗板3次;再每孔加100 μL OPD-H2O2显色液,37 ℃避光显色15 min,然后加入50 μL终止液(2 mol/L H2SO4),终止反应;最后测定OD值:酶标仪于490 nm处检测每孔吸光度 (OD490值)。根据阳性对照的OD值和浓度,绘制标准曲线,从而得出4种重组菌上清中重组猪乳铁蛋白的表达量。
1.7 重组乳杆菌表达产物体外抑菌活性比较
无菌条件下取大肠杆菌、金黄色葡萄球菌、鼠伤寒沙门氏菌、李氏杆菌和巴氏杆菌菌种划线于固体琼脂平板上,37 ℃培养,挑取单个菌落,连续传代2次,取活化后的不同菌种接种于相应的培养基中,其中大肠杆菌、金黄色葡萄球菌接种于LB培养基中,37 ℃摇床培养至对数生长期。鼠伤寒沙门氏菌、李氏杆菌、巴氏杆菌接种于LB培养基中 (加入5%的血清),37 ℃摇床培养至对数生长期。取 OD600约为 1的各种细菌200 μL,涂于琼脂平板,待菌液稍干后,在每个平板中打两个孔,其中一个加入 200 μL转入pPG612.1-plf质粒的重组乳杆菌诱导后的浓缩200倍的菌液上清,另一个加入等量的转入pPG612.1空载体的重组乳杆菌诱导后浓缩 200倍菌液上清作为对照,每种菌做3个重复,加入的重组菌上清均调pH为7,且经过滤除菌处理。
将琼脂平板放入37 ℃温箱中培养,细菌长满平板后测量清晰的抑菌圈直径。
2 结果
2.1 重组乳杆菌的构建和重组猪乳铁蛋白的Western blotting鉴定
将重组质粒 pPG612.1-plf转化 4种乳杆菌后,构建了4种重组乳杆菌。4种重组菌的重组质粒经PCR扩增,BamHⅠ和XhoⅠ双酶切分析均获得与预期片段大小一致的结果,证实已获得转化了plf基因的4种重组乳酸菌,分别命名为pPG612.1-plf/L. casei、pPG612.1-plf/L. pentosus、pPG612.1-plf/L. plantarum 和pPG612.1-plf/L. paracasei。
4种重组乳杆菌诱导表达后,进行Western blotting分析,在73 kDa位置均出现了特异的反应带,说明目的蛋白在 4种重组乳酸菌诱导后的上清和菌体中均得到了表达 (图2)。
2.2 激光共聚焦检验重组菌表达
用激光共聚焦显微镜检验4种重组乳酸菌表达。从 pPG612.1-plf/L. casei、pPG612.1-plf/L. pentosus、pPG612.1-plf/L. plantarum、pPG612.1-plf/L. paracasei四种重组菌均观察到较强绿色荧光,表明重组猪乳铁蛋白在4种重组乳杆菌的菌体表面亦获得表达 (图3)。

图2 四种重组乳杆菌的Western blotting鉴定结果Fig. 2 Western blotting identification of four species of recombinant Lactobacillus. (A)Recombinant Lactobacillus casei.(B)Recombinant Lactobacillus pentosus. (C)Recombinant Lactobacillus plantarum. (D)Recombinant Lactobacillus paracasei. 1: induced total cell protein of pPG612.1/Lactobacillus; 2: induced total cell protein of pPG612.1-plf/Lactobacillus; 3: induced supernatant of pPG612.1/Lactobacillus; 4: induced supernatant of pPG612.1-plf/Lactobacillus.
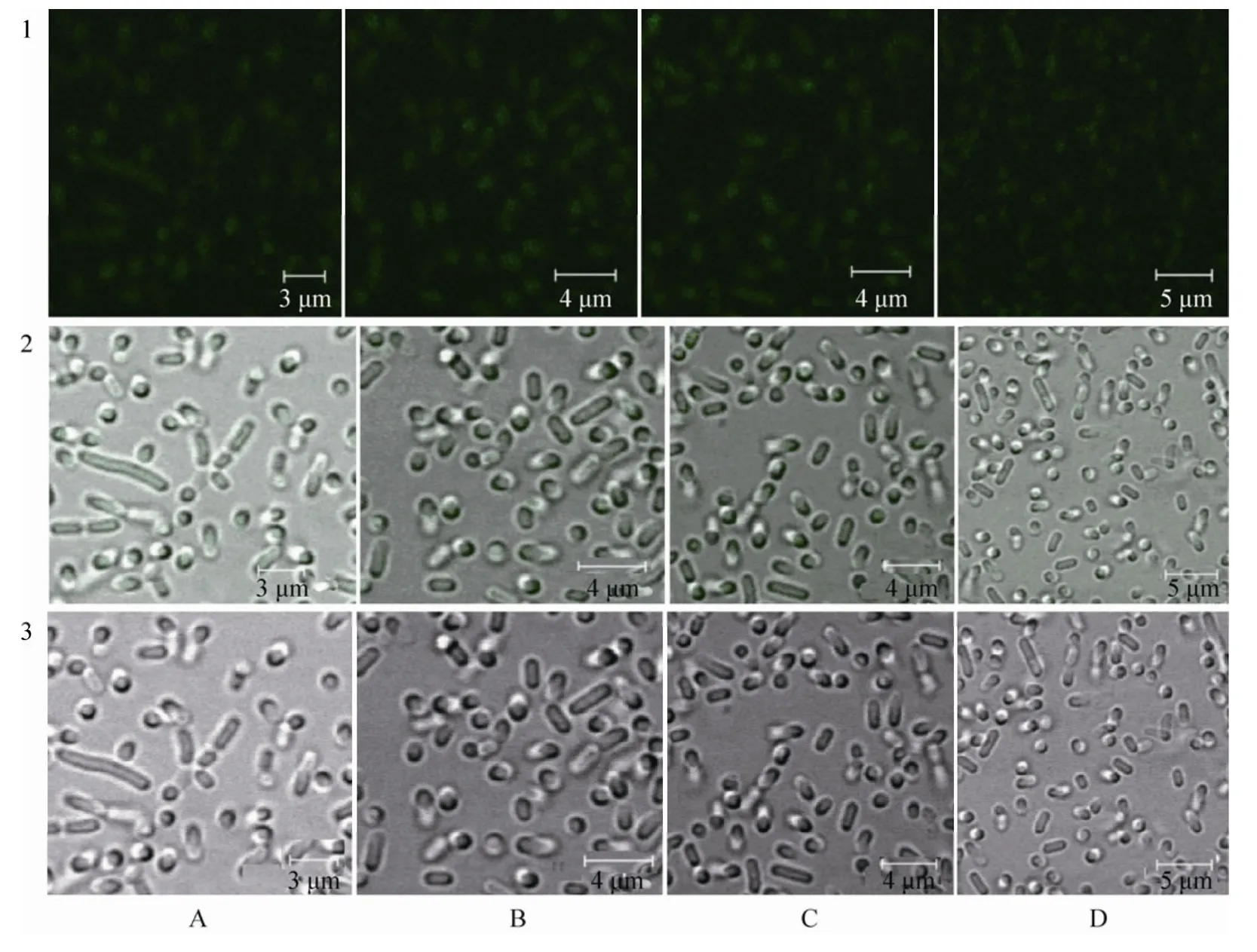
图3 激光共聚焦检验重组菌目标蛋白的表达Fig. 3 Confocal immunofluorescent analysis of the expression of porcine lactoferrin in recombinant lactobacillus. The target protein showed green fluorescence. (A)pPG612.1-plf/L. casei. (B)pPG612.1-plf/L. pentosus. (C)pPG612.1-plf/L. plantarum.(D)pPG612.1-plf/ L. paracasei. 1: dark field examination results of recombinant Lactobacillus; 2: bright field examination results of recombinant Lactobacillus; 3: bright field examination results of recombinant Lactobacillus without filter.
2.3 四种重组乳杆菌猪乳铁蛋白表达量的比较
根据阳性对照的标准曲线,得出 4种重组菌上清中重组猪乳铁蛋白的表达量。结果可见,4种重组乳杆菌Plf表达量分别为 9.6 µg/mL、10.8 µg/mL、12.5 µg/mL 和 9.9 µg/mL;转化pPG612.1空载体的4种重组菌未检测到Plf表达。4种重组菌中重组植物乳杆菌Plf表达量高于其他3种,且差异显著(P<0.05),另外3种重组菌表达量差异不显著(P>0.05)(图4)。
2.4 重组菌表达产物体外抑菌活性比较
抑菌试验表明,转化plf的4种重组菌表达的猪乳铁蛋白均对金黄色葡萄球菌有明显的抑菌作用,抑菌圈直径相对较大,而对鼠伤寒沙门氏菌、巴氏杆菌、李氏杆菌也均有抑制作用,但是抑菌圈相对较小,以鼠伤寒沙门氏菌的抑菌圈最小;并且,4种重组乳杆菌表达产物抑菌效果以重组植物乳杆菌最好,重组戊糖乳杆菌、重组干酪乳杆菌和重组副干酪乳杆菌相对较弱。转化pPG612.1空载体的4种重组菌抑菌圈的测量结果与打孔器直径一致,没有抑菌圈产生,即没有抑菌效果 (表1)。
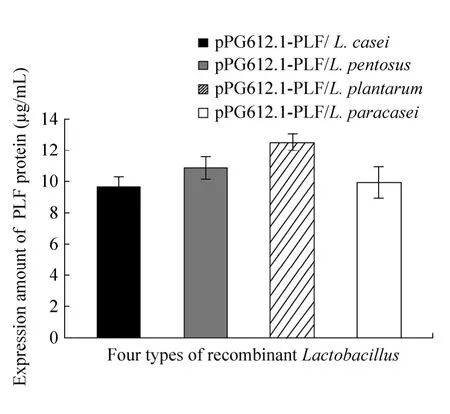
图4 间接ELISA检测重组乳杆菌诱导后上清液中重组蛋白的表达Fig. 4 Measurement of expression of porcine lactoferrin in induced supernatant of recombinant Lactobacillus by indirect ELISA.
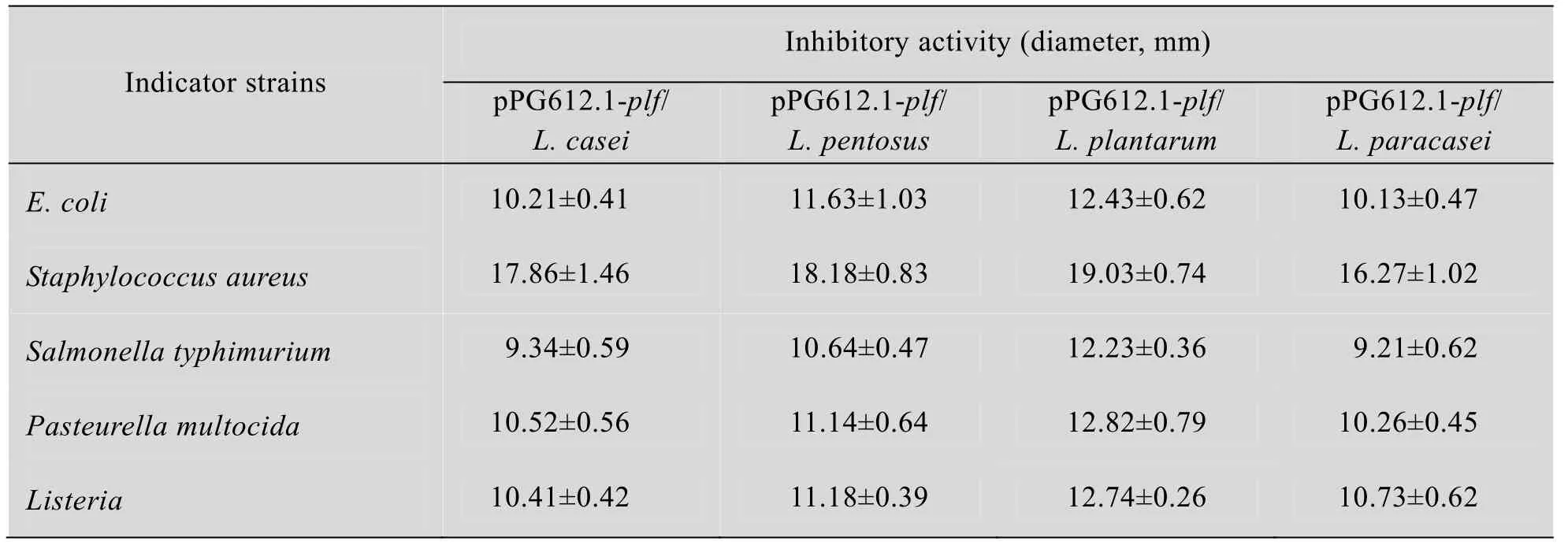
表1 重组乳杆菌对病原菌的抑菌效果Table 1 Antimicrobial activity assay of the recombinant Lactobacillus
3 讨论
乳杆菌种类繁多,而不同乳杆菌分子结构、生理生化特性以及生态各不相同,本研究选择了干酪乳杆菌、戊糖乳杆菌、植物乳杆菌以及副干酪乳杆菌作为受体菌。已经有研究表明,戊糖乳杆菌本身作为活菌制剂,可促进有益菌定植于动物的肠道,并抑制有害菌群的生长繁殖,对防治仔猪腹泻有一定的效果[23],植物乳杆菌具有改善肠道功能的作用,适口性好,已经被用作猪饲料的益生素添加剂[24],副干酪乳杆菌作为活菌制剂饲喂仔猪可显著降低刚断奶幼猪体内梭菌属和肠杆菌的数量[25]。
由于乳酸菌本身的特性,导致表达外源基因量小,不容易检测到,所以本研究根据乳杆菌密码子偏嗜性,在保证氨基酸不变的情况下,优化了plf基因,提高了蛋白表达量,成功地通过 Western blotting和激光共聚焦验证了表达,并用ELISA方法得到了4种菌重组蛋白的表达量,其中重组植物乳杆菌的表达量最大,可达到12.5 µg/mL,其他3种重组乳杆菌的表达量略低,且相互间差异不显著,这可能由于本研究所用载体为诱导表达型,各重组菌对诱导物代谢利用程度的不同,而表现出表达量的差异。
本研究采用传统简便、快捷的抑菌圈法检测了重组菌表达产物对革兰氏阳性菌金黄色葡萄球菌、李氏杆菌和革兰氏阴性菌大肠杆菌、鼠伤寒沙门氏菌、巴氏杆菌这5种比较常见的致病菌的抑制效果。实验结果表明,表达的重组猪乳铁蛋白对上述细菌的生长都表现出了一定的抑制作用。对于乳铁蛋白的抑菌机制,一种解释是乳铁蛋白可以与病原微生物竞争性结合铁离子,造成病原微生物缺乏生存所必需的铁离子;另一种解释是带正电荷的乳铁蛋白与细胞壁或细胞膜上带负电荷的磷脂和脂多糖具有很强的亲和性,与细胞膜结合,增强了细胞膜的通透性,促使细胞内容物的大量流失外泄进而杀死细菌[26]。其中对金黄色葡萄球菌的抑制程度最为明显,其抑菌圈明显大于其他细菌,而对同样作为革兰氏阳性菌的李氏杆菌的抑菌效果与其他几种细菌无明显差别,这可能与细菌的细胞膜构成差异有关。另外,重组植物乳杆菌对5种致病菌的抑菌圈均大于其他重组菌,即其抑菌效果好于其他3种重组乳杆菌,这可能是因为重组植物乳杆菌的乳铁蛋白表达量高于其他重组菌,也可能跟不同的乳杆菌本身的代谢产物有关。研究结果表明4种乳杆菌中,植物乳杆菌更适宜用于重组猪乳铁蛋白的表达,本研究为进一步探索乳杆菌系统表达重组猪乳铁蛋白提供了实验基础。
[1]Monroe S, Polk R. Antimicrobial use and bacterial resistance. Curr Opin Microbiol, 2000, 3(5):496–501.
[2]Schwarz S, Kehrenberg C, Walsh TR. Use of antimicrobial agents in veterinary medicine and food animal production. Int J Antimicrob Agents,2001, 17(6): 431–437.
[3]Sargent PJ, Farnaud S, Evans RW.Structure/function overview of proteins involved in iron storage and transport. Curr Med Chem,2005, 12(23): 2683–2693.
[4]Jacobsen LC, Sorensen OE, Cowland JB, et al.The secretory leukocyte protease inhibitor (SLPI)and the secondary granule protein lactoferrin are synthesized in myelocytes, colocalize in subcellular fractions of neutrophils, and are coreleased by activated neutrophils. J Leukoc Biol, 2008, 83(5): 1155–1164.
[5]Jenssen H, Hancock REW. Antimicrobial properties of lactoferrin. Biochimie, 2009, 91(1): 19–29.
[6]Van der Strate BWA, Beljaars L, Molema G, et al.Antiviral activities of lactoferrin. Antiviral Res,2001, 52(3): 225–239.
[7]Beaumont SL, Maggs DJ, Clarke HE. Effects of bovine lactoferrin on in vitro replication of feline herpesvirus. Vet Ophthalmol, 2003, 6(3): 245–250.
[8]Tanaka T, Nakatani S, Xuan X, et al. Antiviral activity of lactoferrin against canine herpesvirus.Antiviral Res, 2003, 60(3): 193–199.
[9]Conneely OM. Antiinflammatory activities of lactoferrin. J Am Coll Nutr, 2001, 20(sup5):389S–395S.
[10]Wakabayashi H, Yamauchi K, Takase M.Lactoferrin research, technology and applications.Int Dairy J, 2006, 16(11): 1241–1251.
[11]Wang J, Tian Z, Teng D, et al. Cloning,expression and characterization of Kunming mice lactoferrin and its N-lobe. Biometals, 2010, 23(3):523–530.
[12]Wang SR, Lin TY, Chen CM, et al. Isolation and expression of a porcine lactoferrin gene. Am J Vet Res, 1997, 58(10): 1152.
[13]Wang SH, Yang TS, Lin SM, et al. Expression,characterization, and purification of recombinant porcine Lactoferrin in Pichia pastoris. Protein Expres Purif, 2002, 25(1): 41–49.
[14]Chen HL, Lai YW, Chen CS, et al. Probiotic Lactobacillus casei expressing human lactoferrin elevates antibacterial activity in the gastrointestinal tract. Biometals, 2010, 23(3): 543–554.
[15]Ha Z, Zhao LL, Yu XX, et al. High-level expression and antimicrobial activity of recombinant N-terminal porcine lactoferrin. Chin J Biotech, 2010, 26(4): 523–529 (in Chinese).哈卓, 赵丽丽, 于晓旭, 等. 重组猪乳铁蛋白 N端的高效表达及抑菌活性检测. 生物工程学报,2010, 26(4): 523–529.
[16]Tang LJ, Xing JM, Li J, et al. Consecutive expression of porcine lactoferricin gene in Pichia pastorsis and detection of its antimicrobial activity. J Northeast Agric Univ, 2012, 43(6): 1–5 (in Chinese).唐丽杰, 邢婧珉, 李杰, 等. 猪乳铁蛋白肽LFcinP基因在巴斯德毕赤酵母中组成型表达及其抑菌活性检测. 东北农业大学学报, 2012,43(6): 1–5.
[17]Charng YC, Lin CC, Hsu CH. Inhibition of allergen-induced airway inflammation and hyperreactivity by recombinant lactic-acid bacteria. Vaccine, 2006, 24(33): 5931–5936.
[18]Hou XL, Yu LY, Liu J, et al. Surface-displayed porcine epidemic diarrhea viral (PEDV)antigens on lactic acid bacteria. Vaccine, 2007, 26(1): 24–31.
[19]Huang WW. Construction of recombinant Lactococcus lactis expression PLF and detection biological function [D]. Harbin: Northeast Agricultural University, 2013 (in Chinese).黄薇薇. 表达猪乳铁蛋白重组乳酸乳球菌的构建及生物学活性检测[D]. 哈尔滨: 东北农业大学, 2013.
[20]Pouwels PH, Leunissen JAM. Divergence in codon usage of Lactobacillus species. Nuleic Acids Res, 1994, 22(6): 929–936.
[21]Kook MC, Seo MJ, Cheigh CI, et al. Enhancement of γ-amminobutyric acid production by Lactobacillus sakei B2-16 expressing glutamate decarboxylase from Lactobacillus plantarum ATCC 14917. J Korean Soc Appl Biol Chem, 2010, 53(6): 816–820.
[22]Zhao LL, Liu M, Ge JW, et al. Expression of infectious pancreatic necrosis virus (IPNV)VP2-VP3 fusion protein in Lactobacillus casei and immunogenicity in rainbow trouts. Vaccine,2012, 30(10): 1823–1829.
[23]Zhang LF, Wang ZW. Study on effect of lactobacillus product in preventing and curing piglets diarrhea. J Clin Microbiol, 2008, 20(12):568–569 (in Chinese).张丽芳, 王占武. 戊糖乳杆菌制剂防治仔猪腹泻效果初探. 中国微生态学杂志, 2008, 20(12):568–569.
[24]De Angelis M, Siragusa S, Caputo L, et al. Survival and persistence of Lactobacillus plantarum 4.1 and Lactobacillus reuteri 3S7 in the gastrointestinal tract of pigs. Vet Microbiol, 2007, 123(1): 133–144.
[25]Nemcova R, Bomba A, Gancarcikova S, et al.Study of the effect of Lactobacillus paracasei and fructooligosaccharides on the faecal microflora in weanling piglets. Berl Munch Tierarztl, 1998,112(6/7): 225–228.
[26]Ochoa TJ, Cleary TG. Effect of lactoferrin on enteric pathogens. Biochimie, 2009, 91(1): 30–34.

