四个脂肪酸合成酶基因在哺乳动物细胞中的超表达提高长链多不饱和脂肪酸生物合成效率
朱贵明,Abdulmomen Ali Mohammed Saleh,Said Ahmed Bahwal,汪坤福,王明富,王迪迪,葛堂栋,孙洁
佳木斯大学基础医学院,黑龙江 佳木斯 154007
多不饱和脂肪酸 (Polyunsaturated fatty acids, PUFAs)对人体具有独特的作用和意义,是一类被广泛研究和备受关注的脂肪酸。PUFAs包括ω-3和ω-6 PUFAs两种类型,每一种类型又包括多个碳链长度不同、不饱和键数量不等的成员。20C、22C的多不饱和脂肪酸通常可称为长链多不饱和脂肪酸 (Long-chain polyunsaturated fatty acids, LCPUFAs)。DHA(22:6n-3)、EPA (20:5n-3)和 ARA (即花生四烯酸,20:4n-6)是生物体内活性最强的 3种多不饱和脂肪酸[1],已经被证实在促进大脑发育和功能维持以及在预防和治疗心血管疾病、炎症、癌症等多种疾病方面有着重要作用[2-5]。DHA和ARA已经被作为重要的营养补充剂广泛地添加到婴幼儿奶粉等食物中;EPA又常称为血管清道夫,通常和DHA一起食用,对心血管患者十分有益。
现有的研究结果比较明确地证实了在哺乳动物体内 DHA 的生物合成是从 α-亚麻酸(18:3n-3)开始的。首先是 Δ6-脂肪酸去饱和酶将其转变为18:4n-3,Δ6-脂肪酸延长酶将其转变为 20:4n-3,然后 Δ5-脂肪酸去饱和酶将其转变为 EPA (20:5n-3),并在 Δ5-脂肪酸延长酶作用下进一步延长为DPA (22:5n-3)。接下来DPA转变成为DHA需要经历一个比较复杂而低效的过程,即所谓的“Sprecher pathway”:DPA被进一步延长为 24:5n-3,然后被 Δ6-脂肪酸去饱和酶将其转变为 24:6n-3,然后经 β-氧化后生成DHA(22:6n-3)[6-7]。ω-6系多不饱和脂肪酸如ARA的合成过程与此类似,使用相同的酶系。可见,在多不饱和脂肪酸的合成过程中,Δ6/Δ5-脂肪酸去饱和酶和 Δ6/Δ5-脂肪酸延长酶这 4种酶尤为重要。然而,研究表明哺乳动物中这些酶的效率是比较低的,例如 α-亚麻酸转变为DHA的效率小于1%,亚油酸 (LA,18:2n-6)转变为ARA仅为0.2%[8-10]。因此,人体对更多的PUFAs需求主要依靠从食物来源获取。在哺乳动物中为什么绝大部分的ALA或LA不能被转化为活性更强的长链多不饱和脂肪酸呢?很多学者对此进行了各种研究,但得出的结论并不完全令人信服甚至不同研究结论互相矛盾。我们设想,如果通过转基因方法提高多不饱和脂肪酸合成过程中关键性的几种酶活性,继而考察长链多不饱和脂肪酸的合成情况,可能会更好地解释这一疑问。
本研究将来源人的 Δ6-脂肪酸去饱和酶基因fads2和Δ5-脂肪酸去饱和酶基因fads1以及来源于小鼠的 Δ6-脂肪酸延长酶基因 elovl5和Δ5-脂肪酸延长酶基因elovl2这4个多不饱和脂肪酸合成过程重要的基因在哺乳动物细胞(HEK293T)中进行超表达,使其相应的酶活性增加,并在细胞的培养基中添加LA和ALA两种脂肪酸底物,经过一定作用时间后收集细胞并提取脂肪酸,利用气相色谱-质谱联用仪(GC-MS)分析脂肪酸的组成和变化情况,从而探讨哺乳动物细胞中多不饱和脂肪酸的合成的一些深层次问题。
1 材料与方法
1.1 材料
大肠杆菌DH5α、质粒pcDNA3.1(-)为本实验室保存。HEK293T细胞购于中国协和医科大学细胞库。限制性内切酶、T4 DNA连接酶、总RNA提取试剂RNAiso plus、RT-PCR试剂盒等购于宝生物工程 (大连)有限公司。质粒提取试剂盒、PCR产物纯化试剂盒、胶回收试剂盒等购于天根生化科技 (北京)有限公司。转染试剂LipofectamineTM2000为Invitrogen公司产品。细胞培养所用培养基、血清、培养皿等为Hyclone产品。
1.2 方法
1.2.1 基因表达载体的构建
来源于人的 Δ6-脂肪酸去饱和酶基因(fads2,编码 445个氨基酸)和 Δ5-脂肪酸去饱和酶基因 (fads1,编码448个氨基酸)以及来源于小鼠的 Δ6-脂肪酸延长酶基因 (elovl5,编码300个氨基酸)和 Δ5-脂肪酸延长酶基因(elovl2,编码297个氨基酸)这4个基因的多基因表达载体 pcDNA3.1-F2F1-E5E2以串联独立表达的方式构建在pcDNA3.1质粒上,每个目的基因各自有独立的启动子和终止信号polyA,故能独立表达不相互影响。此多基因表达载体总大小为12 760 bp。具体的载体构建方法已经另文发表[11],本文不再详述。
1.2.2 细胞培养和瞬时转染
HEK293T细胞生长培养基为高糖DMEM中添加 1%双抗 (青霉素 10 000 U/mL+链霉素10 000 μg/mL)、1%丙酮酸纳 (11.0 mg/mL)、1%非必需氨基酸、10%胎牛血清。转染前1天将培养的细胞分散至 60 mm平皿,加无双抗培养基5 mL培养,同时添加亚油酸 (LA)和α亚麻酸(ALA)。待其生长至90%左右汇合时用于转染。转染操作按照脂质体 LipofectamineTM2000说明书要求进行,转染所用质粒pcDNA3.1-F2F1-E5E2以及对照转染质粒pcDNA3.1-EGFP各约为8 μg。转染后48 h,用0.25%胰蛋白酶消化细胞,收集备用。
1.2.3 RT-PCR鉴定目的基因的超表达
取上述收集的细胞1/3用于RT-PCR实验。总RNA提取和RT-PCR实验均按照宝生物工程(大连)有限公司相关试剂说明书进行。简言之,总 RNA提取之后先进行定量测定各样品含量,然后将总RNA中的mRNA反转录成为cDNA,每个样品取2 μL反转录产物用于PCR检测,每个PCR反应体系为25 μL。PCR中使用的目的基因表达检测引物列表如下 (其中引物 ActD-s和 ActD-a用于检测内参基因β-actin)。

?
PCR反应结束后,取5 μL左右进行电泳检测,以观察基因表达情况。
1.2.4 脂肪酸的提取与GC-MS分析
取上述收集的细胞余下的2/3用于脂肪酸提取:用去离子水漂洗3次,1 000 r/m离心5 min,加入 1 mL 2.5% H2SO4/甲醇溶液,轻轻混匀,80 ℃水浴90 min,待冷却至室温,加入1.5 mL 0.9% NaCl溶液和1 mL正己烷,剧烈振荡混匀,3 000 r/min离心5 min,将脂肪酸萃取到有机相中,吸取上清经氮气吹干浓缩后-80 ℃保存备用。GC-MS检测时可添加适量的正己烷稀释,使用仪器为安捷伦气质联用仪HP-5890/HP-5971。检测使用参数参考Kang等文献报道[12]。
1.3 统计分析
脂肪酸含量等结果采用x±s (算术平均值±标准偏差)表示。组间数据比较采用Student’s t-test,以P<0.05作为统计学差异显著性的判断标准。每一种脂肪酸百分含量按其峰面积除以表1中所列所有脂肪酸峰面积总和而计算获得。
2 结果与分析
2.1 4个外源目的基因的转染均实现了超表达
将多基因表达载体pcDNA3.1-F2F1-E5E2用于转染,转染时利用pcDNA3.1-EGFP质粒作为对照,其绿色荧光可以比较准确地反映转染效率。转染后第2天观察细胞,可以看到对照组的绿色荧光,在转染后48 h绿色荧光基本达到最强的状态,约90%以上细胞被成功转染,表明转染实验是成功的。在转染后48 h收集细胞提取总RNA进行RT-PCR实验,结果表明转染了pcDNA3.1-F2F1-E5E2质粒的细胞中各个目的基因均成功地被超表达 (图1)。
2.2 外源目的基因的超表达提高了 LA和ALA向长链PUFAs转化的能力
通过RT-PCR实验确认4个目的基因均获得超表达后,我们提取细胞中的脂肪酸,并利用GC-MS进行分析,结果如图2所示。色谱图中横坐标为各种脂肪酸出现的保留时间,不同的脂肪酸出现的时间不一样,由此可以将各种脂肪酸在色谱图中分别开来,再通过质谱分析和搜库对比就可以准确判定各个色谱峰所代表的不同脂肪酸的具体种类。各个色谱峰的高低则表明此脂肪酸的含量,按照其峰面积计算出其含量,进而可计算出每一种脂肪酸的百分含量 (表1)。这些数据表明,与转染对照质粒pcDNA3.1-EGFP的细胞相比,转染pcDNA3.1-F2F1-E5E2质粒的细胞中,fads2、fads1、elovl5和elovl2这4个目的基因的超表达显著地促使LA和ALA转化为相应的长链多不饱和脂肪酸,即LA被主要转化为ARA (20:4n-6)以及少量的21:4n-6,ALA被转化为EPA (20:5n-3)、DPA (22:5n-3)和DHA (22:6n-3)。其中,ω-3系多不饱和脂肪酸的转化能力更强,EPA、DPA和DHA差不多均提高了2倍以上,而且DHA的水平在ω-3系多不饱和脂肪酸达到了最高。显然,在此实验条件下,ω-3系多不饱和脂肪酸的生物合成效率远远高于ω-6系多不饱和脂肪酸生物合成效率。此外,本研究结果还表明,4个目的基因的超表达并没有改变ω-6与ω-3多不饱和脂肪酸之间的比例关系。
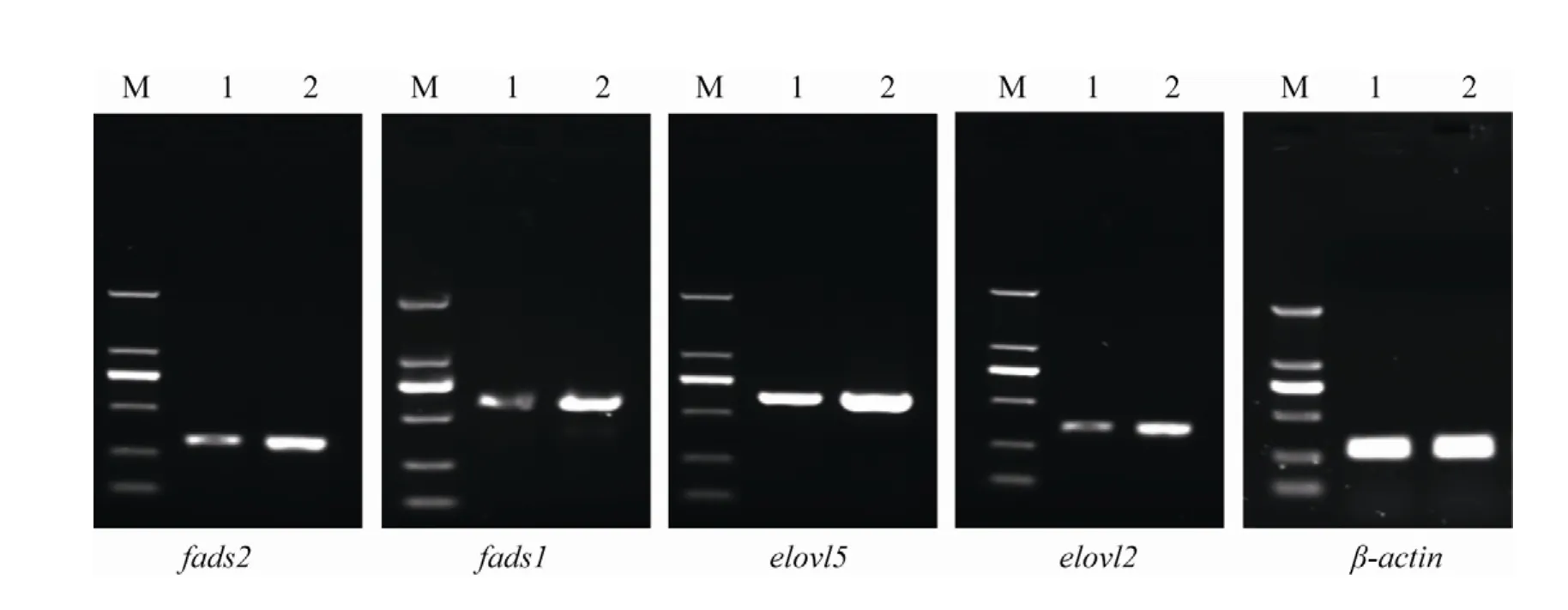
图1 RT-PCR检测转染后细胞中目的基因fads2、fads1、elovl5和elovl2的转录表达Fig. 1 fads2, fads1, elovl5 and elovl2 transcripts in transfected cells were analyzed by RT-PCR. M: DNA markers;1: cells transfected with pcDNA3.1-EGFP; 2: cells transfected with pcDNA3.1-F2F1-E5E2.
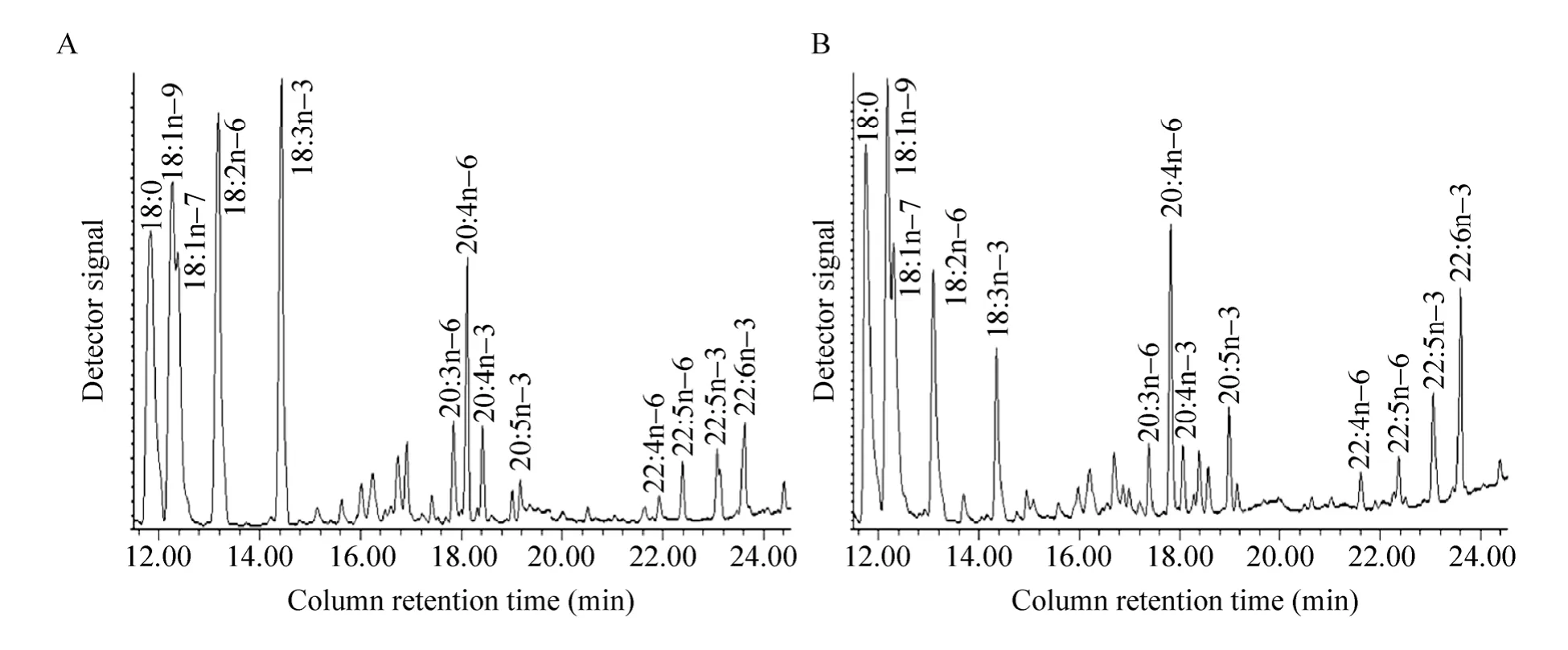
图2 转染pcDNA3.1-EGFP或pcDNA3.1-F2F1-E5E2质粒的HEK293T细胞中多不饱和脂肪酸的色谱图 (局部)Fig. 2 Partial gas chromatograph traces showing fatty acid profiles of total cellular lipids extracted from the control cells transfected with pcDNA3.1-EGFP (A)and the cells transfected with pcDNA3.1-F2F1-E5E2 (B).

表1 转染pcDNA3.1-EGFP或pcDNA3.1-F2F1-E5E2质粒的HEK293T细胞中多不饱和脂肪酸的组成及含量变化Table 1 PUFA composition of total cellular lipids from the HEK293T cells transfected with pcDNA3.1-EGFP or pcDNA3.1-F2F1-E5E2
3 讨论
在PUFAs合成过程中一类重要的酶为脂肪酸去饱和酶,它们以其自身的酶特异性在碳链上的特定位置引入双键从而产生去饱和作用;另一类重要的酶类为脂肪酸延长酶,它们通过其碳链延长酶活性使较短的脂肪酸变为更长的脂肪酸[13]。这两类酶共同作用,在哺乳动物体内可将LA和ALA转变成为更长链的多不饱和脂肪酸。
目前在哺乳动物中已发现的脂肪酸去饱和酶大约有4种:Δ9、Δ6、Δ5和Δ8脂肪酸去饱和酶。Δ9脂肪酸去饱和酶可分别催化 16:0和18:0转化为 16:1n-7和 18:1n-9,该酶广泛地存在于所有哺乳动物,但不参与哺乳动物 PUFAs的生物合成;Δ6脂肪酸去饱和酶则以 18:2n-6和18:3n-3以及少量的16:1n-7和18:1n-9为反应底物,是参与动物PUFAs生物合成的第1个限速酶;Δ5脂肪酸去饱和酶的反应底物为20:3n-6和20:4n-3以及少量的18:2n-7和20:2n-9,该酶对 ω-3系列的脂肪酸具有更强的酶活性,且反应速度高于 Δ6脂肪酸去饱和酶;Δ8脂肪酸去饱和酶是在大鼠睾丸中发现的,可催化20:2n-6转化为20:3n-6[14-16]。
哺乳动物中发现的脂肪酸碳链延长酶有 7种,命名为 ELOVL 1-7。其中,ELOVL-1、ELOVL-3和 ELOVL-6脂肪酸延长饱和脂肪酸和单不饱和脂肪酸,ELOVL-2、ELOVL-4和ELOVL-5则延长多不饱和脂肪酸。ELOVL-5同时还可以延长一些单不饱和脂肪酸,但主要是延 长 γ-linolenoyl-CoA (18:3n-6 CoA), 而ELOVL-2主要延长 22C 的 PUFAs[17-20]。ELOVL-4除了延长28C和30C的超长链饱和脂肪酸,还延长 28C–38C超长链多不饱和脂肪酸(它们独特地在视网膜、睾丸和大脑中表达)[21-26]。ELOVL-7的作用底物尚不清楚,体外实验表明它主要延长20C超长链饱和脂肪酸[27]。
由此可见,在哺乳动物中长链多不饱和脂肪酸的合成主要依靠Δ5和Δ6脂肪酸去饱和酶以及ELOVL-2和ELOVL-5脂肪酸延长酶的作用。这正是本研究选择这 4种酶的编码基因作为目的基因的原因。本研究通过转基因技术而在 HEK293T细胞中将这 4个基因进行超表达后,LA和ALA转化成为长链多不饱和脂肪酸的效率大大提高了,该研究结果也明确地证实了在哺乳动物中长链多不饱和脂肪酸的合成主要依靠Δ6和Δ5脂肪酸去饱和酶以及Δ6和Δ5脂肪酸延长酶的作用。从我们的研究可以看出,哺乳动物自身形成了某种平衡机制,抑制长链多不饱和脂肪酸如DHA、ARA等的大量的高水平合成,但是通过对Δ6和Δ5脂肪酸去饱和酶以及Δ6和Δ5脂肪酸延长酶的超表达,能够打破哺乳动物这种平衡机制,从而显著提高DHA、ARA等的合成水平。至于哺乳动物为何需要这种抑制长链多不饱和脂肪酸合成的机制而又要依靠食物补充这些重要的营养物质,则需要从进化等角度进行深入的研究。
我们的研究还为利用哺乳动物生产多不饱和脂肪酸的思路提供了重要依据。如果本研究中的基因表达载体在转基因动物中也能够达到类似的效果,则可以在动物产品中获得较高水平的长链多不饱和脂肪酸。另外,本研究通过对Δ6和Δ5脂肪酸去饱和酶以及Δ6和Δ5脂肪酸延长酶的超表达,能够明显看到DHA和EPA的增加水平远高于ARA的增加水平,说明ω-3系多不饱和脂肪酸的生物合成效率要高于ω-6系多不饱和脂肪酸的生物合成效率。根据这一点,可以通过优化LA和ALA添加的比例而获得更多的DHA和EPA等ω-3系多不饱和脂肪酸。
[1]Li Y, Monroig O, Zhang L, et al. Vertebrate fatty acyl desaturase with Δ4 activity. Proc Natl Acad Sci USA, 2010, 107(39): 16840–16845.
[2]Moriguchi T, Greiner RS, Salem NJr. Behavioral deficits associated with dietary induction of decreased brain docosahexaenoic acid concentration. J Neurochem, 2000, 75(6):2563–2573.
[3]Catalan J, Moriguchi T, Slotnick B, et al. Cognitive deficits in docosahexaenoic aciddeficient rats.Behav Neurosci, 2002, 116(6): 1022–1031.
[4]Innis SM. The role of dietary n-6 and n-3 fatty acids in the developing brain. Dev Neurosci, 2000,22(5/6): 474–480.
[5]Birch EE, Garfield S, Castaneda Y, et al. Visual acuity and cognitive outcomes at 4 years of age in a double-blind, randomized trial of long-chain polyunsaturated fatty acid-supplemented infant formula. Early Hum Dev, 2007, 83(5): 279–284.
[6]Cook HW, McMaster RCR. Biochemistry of Lipids, Lipoproteins, and Membranes. DE Vance and JE Vance Eds. Amsterdam: Elsevier, 2004:181–204.
[7]Sprecher H. Metabolism of highly unsaturated n-3 and n-6 fatty acids. Biochim Biophys Acta, 2000,1486(2/3): 219–231.
[8]Emken EA, Adlof RO, Gulley RM. Dietary linoleic acid influences desaturation and acylation of deuterium-labeled linoleic and linolenic acids in young adult males. Biochim Biophys Acta, 1994,1213(3): 277–288.
[9]Pawlosky RJ, Hibbeln JR, Novotny JA, et al.Physiological compartmental analysis of alpha-linolenic acid metabolism in adult humans. J Lipid Res, 2001, 42(8): 1257–1265.
[10]Hussein N, Ah-Sing E, Wilkinson P, et al.Long-chain conversion of [13C]linoleic acid and alpha-linolenic acid in response to marked changes in their dietary intake in men. J Lipid Res, 2005,46(2): 269–280.
[11]Wang KF, Zhu GM, Zhang L, et al. Construction of fatty acid synthesis enzymes multigene expression vector. Chin J Gerontol, 2013, 33(17): 4178–4180(in Chinese).汪坤福, 朱贵明, 张莉, 等. 脂肪酸合成酶系多基因表达载体的构建. 中国老年学杂志, 2013,33(17): 4178–4180.
[12]Kang ZB, Ge Y, Chen Z, et al. Adenoviral gene transfer of Caenorhabditis elegans n-3 fatty acid desaturase optimizes fatty acid composition in mammalian cells. Proc Natl Acad Sci USA, 2002,98(7): 4050–4054.
[13]Nakamura MT, Nara TY. Structure, function, and dietary regulation of delta6, delta5, and delta9 desaturases. Annu Rev Nutr, 2004, 24: 345–376.
[14]Tocher DR, leaver MJ, Hodgson PA. Recent advances in the biochemistry and molecular biology of fatty acyl desaturase. Prog lipid Res,1998, 37(2/3): 73–117.
[15]Huang YS, Pereira SL, Leonard AE. Enzymes for transgenic biosynthesis of long-chain polyunsaturated fatty acids. Biochimie, 2004,86(11): 793–798.
[16]Pereira SL, Leonard AE, Huang YS, et al.Identification of two novel microalgal enzymes involved in the conversion of the omega3-fatty acid, eicosapentaenoic acid, into docosahexaenoic acid. Biochem J, 2004, 384(2): 357–366.
[17]Jakobsson A, Westerberg R, Jacobsson A. Fatty acid elongases in mammals: Their regulation and role in metabolism. Prog Lipid Res, 2006, 45(3):237–249.
[18]Leonard AE, Pereira SL, Sprecher H, et al.Elongation of long-chain fatty acids. Prog Lipid Res, 2004, 43(1): 36–54.
[19]Moon YA, Shah NA, Mohapatra S, et al.Identification of a mammalian long chain fatty acyl elongase regulated by sterol regulatory element-binding proteins. J Biol Chem, 2001,276(48): 45358–45366.
[20]Wang Y, Botolin D, Xu J, et al. Regulation of hepatic fatty acid elongase and desaturase expression in diabetes and obesity. J Lipid Res,2006, 47(9): 2028–2041.
[21]Agbaga MP, Brush RS, Mandal MN, et al.Anderson .Role of Stargardt-3 macular dystrophy protein (ELOVL4)in the biosynthesis of very long chain fatty acids. Proc Natl Acad Sci USA, 2008,105(35): 12843–12848.
[22]Grogan WM. Metabolism of arachidonate in rat testis: characterization of 26–30 carbon polyenoic acids. Lipids, 1984, 19: 341–346.
[23]Furland NE, Zanetti SR, Oresti GM, et al.Ceramides and sphingomyelins with high proportions of very long-chain polyunsaturated fatty acids in mammalian germ cells. J Biol Chem,2007, 282: 18141–18150.
[24]Furland NE, Oresti GM, Antollini SS, et al. Very long-chain polyunsaturated fatty acids are the major acyl groups of sphingomyelins and ceramides in the head of mammalian spermatozoa.J Biol Chem, 2007, 282: 18151–18161.
[25]Harkewicz R, Du H, Tong Z, et al. Essential Role of ELOVL4 Protein in very long chain fatty acid synthesis and retinal function. J Biol Chem, 2012,287: 11469–11480.
[26]Barabas P, Liu A, Xing W, et al. Role of ELOVL4 and very long-chain polyunsaturated fatty acids in mouse models of Stargardt type 3 retinal degeneration. Proc Natl Acad Sci USA, 2013, 10:1073–1078.
[27]Tamura K, Makino A, Hullin-Matsuda F, et al.Novel lipogenic enzyme ELOVL7 is involved in prostate cancer growth through saturated long-chain fatty acid metabolism. Cancer Res,2009, 69(20): 8133–8140.

