碳源和氮源对5-酮基-葡萄糖酸生成的影响
谭之磊,王洪翠,魏彧翘,李艳艳,钟成,贾士儒
天津科技大学生物工程学院 教育部工业发酵微生物重点实验室,天津 300457
L(+)-酒石酸是一种天然有机酸,其他旋光性酒石酸在自然界尚未被发现[1],其盐类较稳定,应用广泛。在食品和饮料中可用作食品添加剂,如酸味剂和膨化剂,酸味值约为柠檬酸的1.3倍,而且是葡萄酒生产过程中唯一一种允许添加的酸味剂[2],对葡萄酒的味道及口感有很重要的影响[3];在医药方面,可作外科绷带硬化剂、药物拆分剂和酒石酸异丁嗪等药品的成盐剂[4];在纺织工业上,用作酸性还原剂[5]。此外,还可作印染的防染剂、照相显影剂[6]以及应用于电镀、制革[7]等行业。酒石酸的生产方法主要有提取法[8]、半生物合成法[9-10]和酶法[11],目前国内生产L(+)-酒石酸主要是采用酶法,利用微生物转化顺式环氧琥珀酸[11]的方法,能产生顺式环氧琥珀酸水解酶的菌种[12-13]有很多,其常用生产菌种主要是棒状杆菌[14]和诺卡氏菌[15],此工艺的底物为顺式环氧琥珀酸,其来源复杂[16],安全性低,耗能高。氧化葡萄糖杆菌[17]Gluconobacter oxydans可以将葡萄糖氧化成葡萄糖酸,并进一步氧化成 2-酮基-葡萄糖酸(2KGA)和 5-酮基-葡萄糖酸[9](5KGA),其中5KGA在催化剂[10]的作用下能够转化为L(+)-酒石酸[18],此方法改善了以上不足之处。Helmut Görisch 等[19-20]筛选出一株核黄素依赖型GA-2-DH酶活缺失型突变株 Gluconobacter oxydans MF1,此突变株不生成2KGA,使5KGA的转化率达到84%。文中以不生成2KGA的氧化葡萄糖杆菌Gluconobacter oxydans HGI-1为生产菌株,研究不同碳源和氮源对5KGA生成的影响。
1 材料与方法
1.1 菌种和培养基
1.1.1 菌种
氧化葡萄糖杆菌 Gluconobacter oxydans HGI-1由日本玉川大学Tatsuo Hoshino教授赠送。
1.1.2 培养基
种子培养基(g/L):甘露醇 25,酵母浸粉 5,蛋白胨 3。
摇瓶发酵培养基(g/L):葡萄糖 100,玉米粉3,酵母浸粉 1.67,NH4Cl 1.50,KH2PO40.10,MgSO4·5H2O 0.25,MnSO4·5H2O 0.03,CaCO330。
发酵罐发酵培养基(g/L):葡萄糖 100,玉米粉3,酵母浸粉 1.67,NH4Cl 1.50, KH2PO40.10,MgSO4·5H2O 0.25, MnSO4·5H2O 0.03,CaCO30.34。
1.2 培养和检测方法
1.2.1 种子液制备
从斜面上挑取两环菌种于液体种子培养基中,摇床 (30 ℃,180 r/min)培养20 h。
1.2.2 摇瓶培养
500 mL三角瓶装液量为 50 mL,接种量为10%,摇床 (30 ℃,180 r/min)培养72 h。
1.2.3 5 L发酵罐放大培养
采用5 L全自动发酵罐 (BLBIO-XGJG,上海百仑生物科技有限公司),培养基装液量为3 L,接种量为10%(V/V),在发酵过程中,控制温度为30 ℃,搅拌转速为750 r/min,通气速率为1 vvm,自动流加6 mol/L KOH控制发酵过程中的pH在5.50,葡萄糖浓度降至0 g/L时,不再控制pH。发酵过程由发酵罐控制系统软件进行在线控制和数据采集。
1.2.4 5-酮基-D-葡萄糖酸的测定
采用高效液相色谱仪(型号:1100,安捷伦(中国)有限公司)测定5-酮基-D-葡萄糖酸的含量。具体条件:反相色谱柱 Themos BDS C18(4.6 mm ID×250 mm),流动相为 10 mmol/L HClO4[21],流速0.5 mL/min,柱温25 ℃,检测波长210 nm。
2 结果与分析
2.1 碳源对5KGA生产的影响
2.1.1 碳源种类对5KGA产量的影响
分别以初始浓度为100 g/L的葡萄糖、蔗糖、麦芽糖、乳糖和可溶性淀粉作碳源,三角瓶振荡培养72 h。由图1可知,当碳源分别为乳糖、麦芽糖、蔗糖、淀粉和葡萄糖时,5KGA的产量分别为16.50、11.90、25.00、45.60和98.20 g/L,其中葡萄糖为碳源时5KGA产量最高,这可能是由于蔗糖、麦芽糖、乳糖为二糖,可溶性淀粉为多糖,不易被菌体利用,菌体利用上述碳源时,需先将其水解为单糖,才能被菌体利用生成5KGA。而葡萄糖能直接被菌体利用,更有利于5KGA的生成,因此选用葡萄糖作碳源。
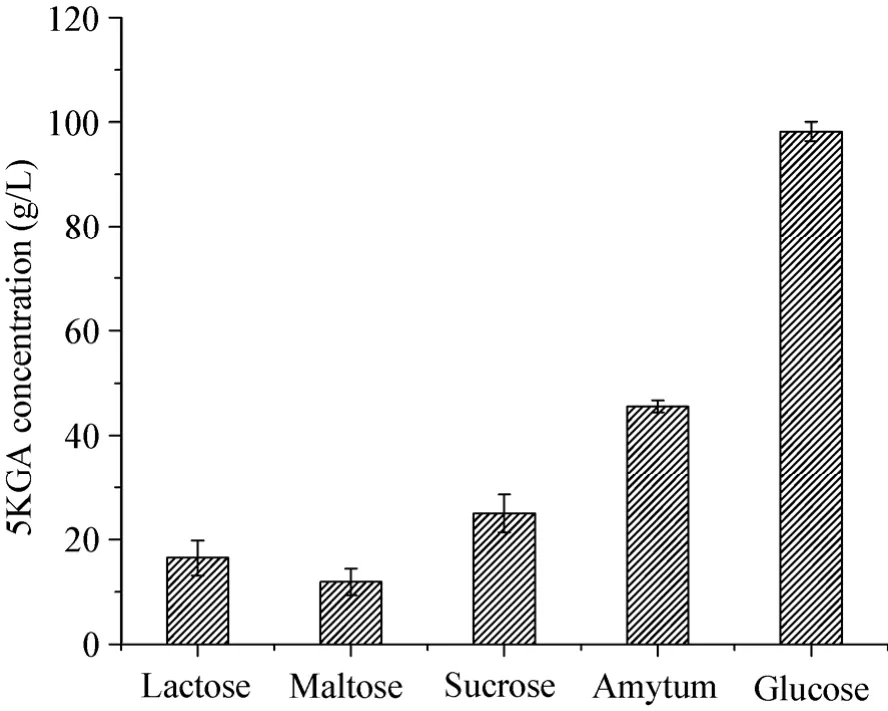
图1 不同碳源对5KGA产量的影响Fig. 1 Effects of different carbon sources on the 5-keto-gluconic acid production.
2.1.2 葡萄糖浓度对5KGA产量的影响
选择葡萄糖初始浓度分别为 60、80、100、120和140 g/L,三角瓶振荡培养72 h。由图2可知,当葡萄糖浓度在60–100 g/L时,5KGA的产量随葡萄糖浓度的增大而增大,100 g/L时最高为 98.21 g/L,而当葡萄糖浓度再增大时 5KGA的产量反而下降,这说明较低或较高的葡萄糖浓度皆不适宜5KGA的生成,这可能是由于高浓度的葡萄糖抑制了菌体的生长[22],从而影响了5KGA的生成。
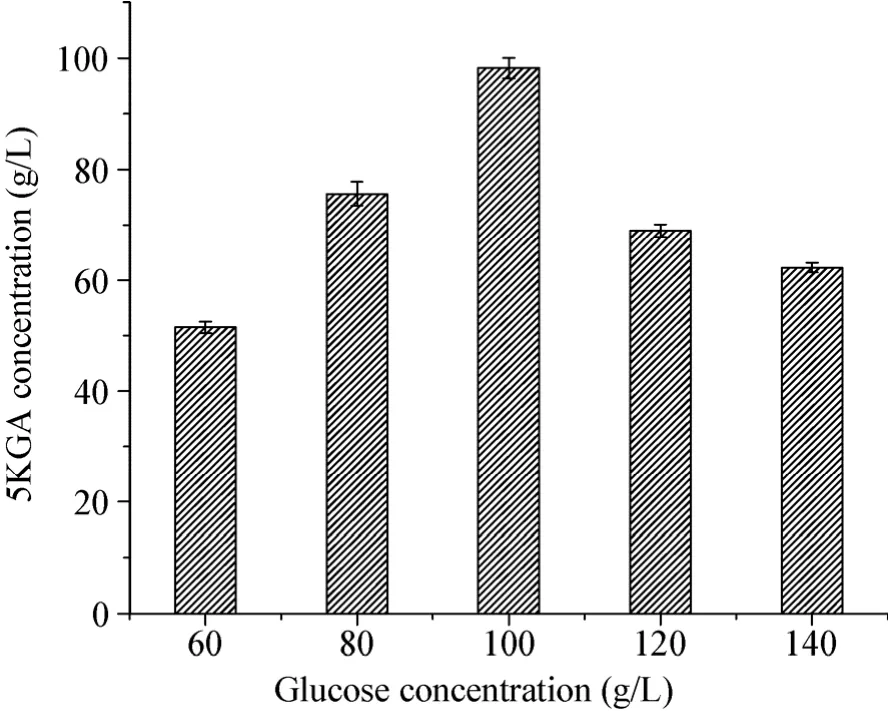
图2 不同葡萄糖浓度对5KGA产量的影响Fig. 2 Effects of different glucose concentrations on the 5-keto-gluconic acid production.
2.2 有机氮源对5KGA生产的影响
2.2.1 有机氮源种类对5KGA产量的影响
以鱼粉、玉米浆、黄豆饼粉和棉籽饼粉为氮源,其蛋白含量分别为55%、40%、38%和40%,按蛋白终含量为1.20%分别添加2.20、3.00、3.15和3.00 g,以酵母粉为(蛋白含量为 68%)对照,其添加量为1.67 g/L,三角瓶振荡培养72 h。由图3可知,当使用酵母粉作氮源时,5KGA产量为98.21 g/L。当使用鱼粉、玉米浆、黄豆饼粉、棉籽饼作有机氮源时,5KGA产量分别为101.40、79.20、70.10和62.10 g/L。鱼粉和玉米浆作氮源产量较黄豆饼粉、棉籽饼高。鱼粉作氮源时产量超过酵母粉作氮源时的产量,虽然差异未达到显著性水平(数据未列出),但考虑到鱼粉和玉米浆的价格优势,有望作为工业化生产氮源。
2.2.2 鱼粉、玉米浆起始浓度对5KGA产量的影响

图3 不同氮源对5KGA产量的影响Fig. 3 Effects of different nitrogen sources on the 5-keto-gluconic acid production.
分别添加鱼粉(1.50/2.20/3 g)、玉米浆(2/3/4 g)作为氮源,其最终蛋白含量分别为0.80%、1.20%和1.60%,三角瓶振荡培养72 h。由图4可知,当培养基中蛋白含量为1.60%时,鱼粉作有机氮源,5KGA产量最高为109.10 g/L,其次是使用玉米浆时,5KGA产量最高为93.80 g/L。考虑到玉米浆作氮源与鱼粉作氮源5KGA产量接近,但价格仅为鱼粉的40%左右,文中选择了玉米浆为氮源,进一步做了5 L发酵罐放大研究。
2.3 5 L自动发酵罐分批发酵
5 L自动发酵罐分批发酵过程中,葡萄糖浓度降至0 g/L之前,自动流加6 mol/L KOH控制发酵过程中的pH在5.50,葡萄糖浓度降至0 g/L后,不再控制 pH。这是由于 1991年 Qazi等[23]发现pH为5.50 最利于G. oxydans的细胞生长,且是葡萄糖脱氢酶的最适 pH。5KGA生成过程可分为两个阶段,即先将葡萄糖氧化生成葡萄糖酸,葡糖酸再进一步转化成 5KGA[20],葡萄糖氧化生成葡萄糖酸后,pH下降,葡萄糖浓度降为0 g/L,pH不再降低。在第一阶段中,为了保证菌体最大限度地利用葡萄糖并将其氧化成葡萄糖酸,控制 pH为5.50,这有利于细胞生长和葡萄糖转化成葡萄糖酸[24]。

图4 不同蛋白浓度鱼粉、玉米浆对5KGA产量的影响Fig. 4 Effects of different protein concentrations of fish meal and corn steep liquor on the 5-keto-gluconic acid production.
由图5(A)和图6(A)可知,以酵母粉作有机氮源时,发酵9 h葡萄糖的浓度降至0 g/L、5KGA开始生成,10.5 h时生成速率最大、达到8.60 g/(L·h),72 h时5KGA产量达到最大、为105.41 g/L,转化率为90.60%,平均生成速率为 1.44 g/(L·h)。由图 5B 和 6B 可知,以玉米浆作有机氮源,18 h时5KGA开始生成,5KGA 生成速率在 26 h时达最大,为3.48 g/(L·h),60 h时5KGA产量达到最大,为93.80 g/L。平均生成速率为1.56 g/(L·h),转化率为85.93%。
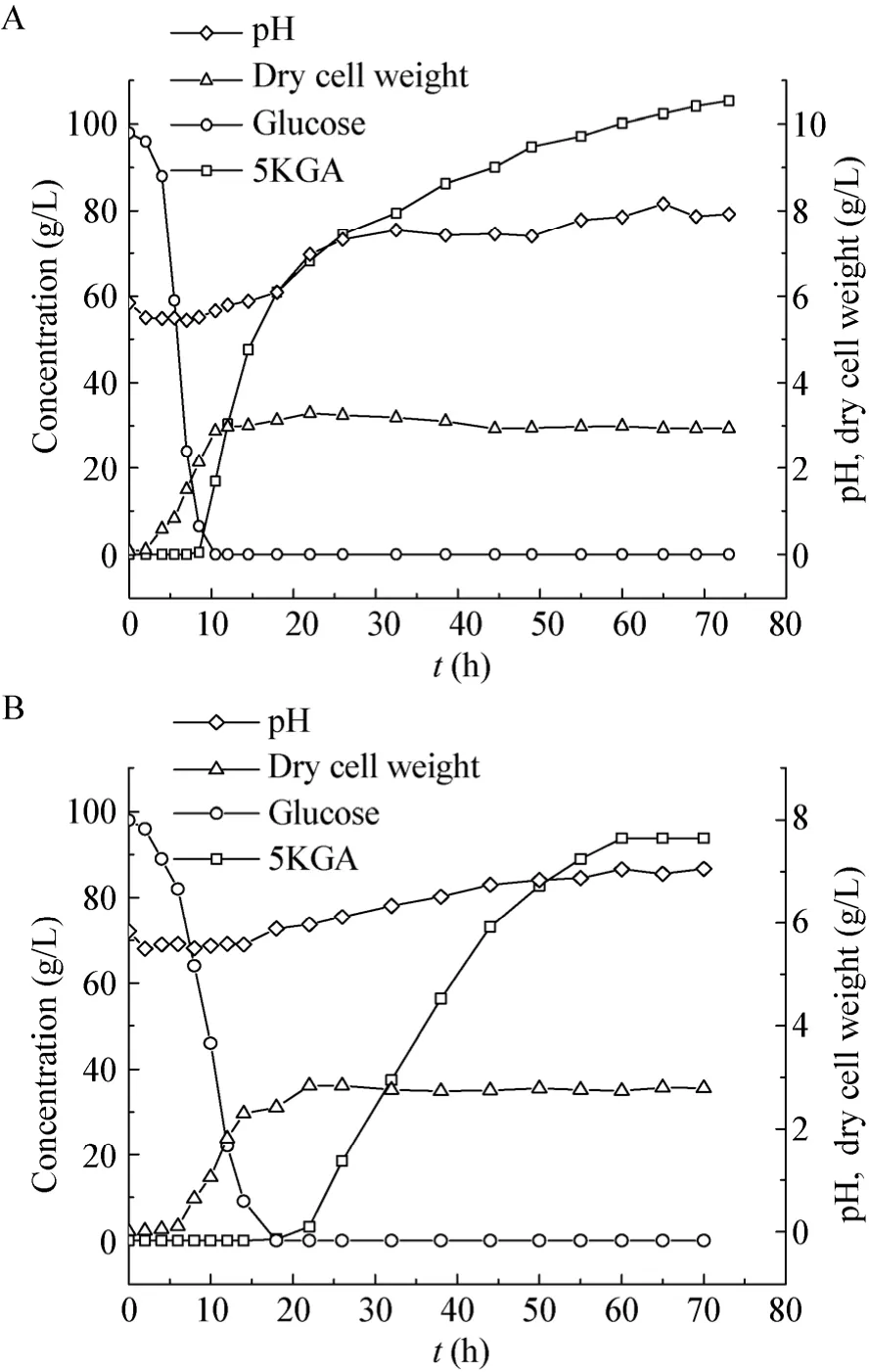
图5 以酵母粉(A)和玉米浆(B)作氮源分批发酵生产5KGAFig. 5 Time course of batch 5KGA production with yeast extract (A)and corn steep (B)liquor as nitrogen source.

图6 以酵母粉(A)和玉米浆(B)作氮源5KGA生成速率曲线Fig. 6 Time course of 5KGA specific production rate with yeast extract (A)and corn steep (B)liquor as nitrogen source.
以玉米浆作有机氮源 5KGA的产量与酵母粉作有机氮源接近,玉米浆成本远低于酵母粉,同时发酵周期缩短,平均生成速率为1.56 g/(L·h)高于以酵母粉作有机氮源的平均生成速率1.44 g/(L·h)。
3 讨论
三角瓶和5 L发酵罐分批发酵放大试验结果表明:采用菌株Gluconobacter oxydans HGI-1生产 5KGA,最佳碳源为葡萄糖,最佳浓度为100 g/L。最佳氮源为酵母粉,其次为鱼粉、玉米浆。考虑工业生产成本问题,选择玉米浆作为有机氮源,其最佳添加量为 4 g/L。以葡萄糖为碳源、玉米浆为有机氮源 5KGA 的发酵水平达到了93.80 g/L,平均生成速率为1.56 g/(L·h),转化率为85.93%,发酵周期较酵母粉缩短15 h,5KGA平均生成速率提高 8.26%,取得了较好的实验效果。
Hirohide TOYAMA等[25]研究了以葡萄糖为唯一碳源,在葡萄糖浓度为20 g/L (111 mmol/L)、不控制pH条件下,G. suboxydans IFO 12528生成5KGA的产量为12.61 g/L,转化率仅为59%。Helmut Görisch等[19]筛选出一株核黄素依赖型GA-2-DH酶活缺失型突变株 Gluconobacter oxydans MF1,使用酵母粉作有机氮源,葡萄糖浓度为25 g/L时,5KGA的产量为22.70 g/L,其葡萄糖转化率为84%。与其相比,Gluconobacter oxydans HGI-1以葡萄糖为碳源、玉米浆为有机氮源生产5KGA转化率与文献水平相当,但以玉米浆作氮源降低了生产成本,更有利于工业化生产。
[1]Kodama S, Yamamoto A, Matsunaga A, et al.Direct chiral resolution of tartaric acid in food products by ligand exchange capillary electrophoresis using copper(II)-D-quinic acid as a chiral selector. J Chromatogr A, 2001, 932(1):139–143.
[2]Palma M, Barroso CG. Ultrasound-assisted extraction and determination of tartaric and malic acids from grapes and winemaking by-products.Anal Chim Acta, 2002, 458(1): 119–130.
[3]Bastos SST, Tafulo PAR, Queiros RB, et al. Rapid determination of tartaric acid in wines. Comb Chem High Throughput Screening, 2009, 12(7): 12–722.
[4]Lou JF. Study on cis-epoxysuccinate hydrolase [D].Zhengjiang: Zhejiang University, 2006 (in Chinese).楼锦芳. 顺式环氧琥珀酸水解酶的研究[D]. 浙江: 浙江大学, 2006.
[5]Willaert R, Vuyst LD. Continuous production of L-(+)-tartaric acid from cis-epoxysuccinate using a membrane recycle reactor. Appl Microbiol Biotechnol, 2006, 71(2): 155–163.
[6]Cao XM, Lü AZ. Optimization of extraction Conditions of tartaric acid from grapes pomace.Hubei Agric Sci, 2011, 50(14): 2930–2933 (in Chinese).曹熙敏, 吕爱枝. 葡萄渣中酒石酸的提取条件优化. 湖北农业科学, 2011, 50(14): 2930–2933.
[7]Olivato JB, Nobrega MM, Müller CM, et al.Mixture design applied for the study of the tartaric acid effect on starch/polyester films. Carbohydr Polym, 2013, 92(2): 1705–1710.
[8]Mi S, Li H, Liu J. Optimization of extraction process for L(+)-tartaric acid from vitis quinquangularis lees via response surface methodology. Food Sci Technol, 2012, 33(8):49–53 (in Chinese).米思, 李华, 刘晶. 响应面法优化毛葡萄酒泥中L(+)-酒石酸. 食品科学, 2012, 33(8): 49–53.
[9]Merfort M, Herrmann U, Ha SW, et al.Modification of the membrane-bound glucose oxidation system in Gluconobacter oxydans significantly increases gluconate and 5-keto-D-gluconic acid accumulation. Biotechnol J,2006, 1(5): 556–563.
[10]Matzerath I, Kläui W, Klasen R, et al. Vanadate catalysed oxidation of 5-keto-D-gluconic acid to tartaric acid: the unexpected effect of phosphate and carbonate on rate and selectivity. Inorg Chim Acta, 1995, 237(1): 203–205.
[11]Lou JF, Zhang JG. Research on microbial productions of L(+)-Tartaric acid. Food Sci Technol, 2006, (11): 162–164 (in Chinese).楼锦芳, 张建国. 酶法合成L(+)-酒石酸的研究进展. 食品科技, 2006, (11): 162–164.
[12]Pan KX, Min H, Xia Y, et al. Isolation,identification and phylogenetic analysis of Rhodococcus sp. strain M1 producingcis-epoxysuccinate hydrolase and optimization of production conditions. Acta Microbiol Sin, 2004, 44(3): 276–280 (in Chinese).潘克侠, 闵航, 夏颖, 等. 产顺式环氧玻拍酸水解酶的红球菌 Ml菌株的分离鉴定及其产酶条件优化. 微生物学报, 2004, 44(3): 276–280.
[13]Pan HF, Xie ZP, Bao WN, et al. Isolation and identification of a novel cis-epoxysuccinate hydrolaseproducing Bordetella sp. BK-52 and optimization of enzyme production. Acta Microbiol Sin, 2008, 48(8): 1075–1081 (in Chinese).潘海峰, 谢志鹏, 鲍文娜, 等. 产顺式环氧琥珀酸水解酶的博德特氏菌BK-52的筛选、鉴定及其产酶条件优化. 微生物学报, 2008, 48(8):1075–1081.
[14]Zhang JG, Qian YJ. Production of L(+)-tartaric acid by immobilized Corynebacterium sp. JZ21.Chin J Biotech, 2000, 16(2): 188–192 (in Chinese).张建国, 钱亚娟. 棒状杆菌固定化细胞生产L(+)-酒石酸. 生物工程学报, 2000, 16(2):188–192.
[15]Zheng P, Sun ZH. Enzymatic Conversion of Cis-Expoxysuccinate into L(+)-Tartarate by Nocardia sp. SW 13-57. Ind Microbiol, 1994, 4 (3):12–17 (in Chinese).郑璞, 孙志浩. 用诺卡氏菌酶法转化顺式环氧琥珀酸生产L(+)-酒石酸的研究. 工业微生物, 1994,4(3): 12–17.
[16]Lu ZF, Dong W, Xia MZ, et al. Synthesis ofepoxysuccinic acid. special petrochem, 2001,5(3): 7–9 (in Chinese).吕志芳, 董伟, 夏明珠, 等. 环氧琥珀酸的合成条件研究. 精细石油化工, 2001, 5(3): 7–9.
[17]Muynck CD, Pereira CSS, Naessens M, et al. The genus Gluconobacter oxydans: comprehensive overview of biochemistry and biotechnological applications. Crit Rev Biotechnol, 2007, 27(3):147–171.
[18]lassen R, Zam H, Korloy W, et al. Preparation of tartaric acid: CN, 951961381. 2000-12-27 (in Chinese).R·克拉森, H·扎姆, W·克劳伊, 等. 酒石酸的备方法: CN, 95196138.1. 2000-12-27.
[19]Elfari M, Ha SW, Bremus C, et al. A Gluconobacter oxydans mutant converting glucose almost quantitatively to 5-keto-D-gluconic acid.Appl Microbiol Biotechnol, 2005, 66(6): 668–674.
[20]Marcel Merfort, Herrmann U, Stephanie BM, et al. High-yield 5-keto-D-gluconic acid formation is mediated by soluble and membrane-bound gluconate-5-dehydrogenases of Gluconobacter oxydans. Appl Microbiol Biotechnol, 2006, 73(2):443–451.
[21]Herrmann U, Merfort M, Jeude M, et al.Biotransformation of glucose to 5-keto-D-gluconic acid by recombinant Gluconobacter oxydans DSM 2343. Appl Microbiol Biotechnol, 2004, 64: 86–90.
[22]Velizarov S, Beschkov V. Biotransformation of glucose to free gluconic acid by Gluconobacter oxydans: substrate and product inhibition situations. Process Biochem, 1998, 33(5): 527–534.
[23]Qazi GN, Parshad R, Verma V, et al.Diketo-gluconate fermentation by Gluconobacter oxydans. Enzyme Microb Technol, 1991, 13(6):504–507.
[24]Silberbach M, Maier B, Zimmermann M, et al.Glucose oxidation by Gluconobacter oxydans:characterization in shaking-flasks, scale-up and optimization of the pH profile. Appl Microbiol Biotechnol, 2003, 62(1): 92–98.
[25]Ano Y, Shinagawa E, Adiach O, et al. Selective,high conversion of D-glucose to 5-Keto-D-gluoconate by Gluconobacter suboxydans. Biosci Biotechnol Biochem, 2011, 75(3): 586–589.

