雷公藤红素抑制大鼠胰岛细胞功能损伤研究
黄明来,马卓
(湖北工业大学生物工程学院,湖北 武 汉430068)
0 引言
在糖尿病的发生发展过程中,炎症因子的侵润而使β细胞功能受损最终导致胰岛素分泌不足是糖尿病的重要发病机制,糖尿病的发病与机体的炎症过程密切相关[1].相关研究表明当胰岛β细胞受到炎症因子的刺激时,NO的分泌量就会相对增加[2],从而导致胰岛细胞凋亡.而雷公藤红素(Celastrol)因其确切的抗癌、免疫抑制以及抗炎作用而越来越受科研工作者的关注[3].本文中探索Celastrol对于INS-1细胞功能的影响,完善Celastrol的药理学分子机制,为其辅助治疗糖尿病提供可能.
1 材料和方法
1.1 主要材料和试剂 实验用大鼠胰岛细胞系INS-1来源于ATCC.细胞用RPMI-1640培养,其中含有100μg/mL的青霉素和链霉素以及10%的新生胎牛血清(FBS).细胞在恒温细胞培养箱中培养,培养箱温度为37℃,CO2含量为5%左右.INS-1细胞每隔2~3d传代一次.当细胞密度为80%~90%时可种板为后续实验做准备.主要试剂:RPMI-1640,DMEM 细胞培养基购自Invitrogen Life Technologies(Grand Island,NY);胎牛血清购自 Hyclone公司(Logan,UT);MTT试剂,PI及 Hoechst购于Sigma公司(StLous,MO)产品.雷公藤红素购于中国科学院上海药物研究所,用于检测INS-1细胞功能的I125放射免疫试剂盒购于上海雅吉生化试剂六厂.NO检测试剂盒购于上海前尘生物技术有限公司.
1.2 MTT检测INS-1活性 INS-1细胞以5×103个/孔种于96孔板.细胞贴壁后(约12~24h),弃培养液,用含有不同浓度的雷公藤红素(100~300nmol/L)联合固定浓度的IL-1β(10ng/mL)处理细胞;药物作用48h后,换用含有0.5mg/mL的MTT的新鲜培养液培养4h,弃培养液,加入DMSO(150 μL/孔)用酶标仪在波长为490nmol/L处测吸光度值,以吸光度值间接反映细胞增殖.实验重复3次,运用SPESS16.5统计软件单因素ANOVA进行统计分析,取p<0.05为差异具有统计学意义.
1.3 荧光染色观察INS-1凋亡情况 蓝色荧光染料Hoechst很容易进入细胞,可以将活细胞染成蓝色.而PI荧光染料不能通过正常细胞的双膜结构,但是凋亡细胞由于细胞膜的双层结构已经改变,所以可被PI染料染色.根据Hoechst和PI两种荧光染料的特性,为了从形态学的角度更好地观测有功能和功能损伤的细胞,我们对INS-1细胞同时进行两种染色,并采用荧光显微镜观察双染的细胞凋亡情况.
INS-1细胞种板于6孔板之中,贴壁12h之后用含有不同浓度的雷公藤红素(100~300nmol/L)联合固定浓度的IL-1β(10ng/mL)处理细胞48h之后,加入PI、Hoechst荧光染料及RNA酶抑制剂,避光孵育半小时于32倍光学显微镜下观察INS-1细胞状态并拍照.
1.4 KSIS分析INS-1细胞功能 INS-1细胞浓度达到70%~80%种于48孔板之中,贴壁后12h,加入不同浓度的雷公藤红素(100~300nmol/L)刺激细胞24h.观察细胞密度,弃培养液,加入KRB固定0.5h后,加入含有低浓度钾离子的1640培养液,培养1h之后吸取上清于2mL EP管中.加入含高浓度钾离子的1640培养液,培养1h之后吸取上清于2mL EP管中.于孔板之中加入酸乙醇,4℃放置过夜,抽提胞内胰岛素.所有收集上清液按照I125放射免疫试剂盒操作步骤操作,于γ放射沉淀计数仪上计数,并且换算细胞胰岛素的分泌量.
1.5 ELISA检测INS-1细胞NO的分泌 INS-1细胞种板于6孔板中,贴壁12h之后,弃上清,加入含有IL-1β和Celastrol的新的1640培养液,继续培养48h之后,取上清液,按照试剂盒操作步骤加入试剂.充分涡旋混匀30s,室温静置40min后,3 500~4 000r/min,离心10min,取上清,上机检测.
2 结果
2.1 Celastrol对INS-1细胞活性的影响 为了测定低浓度的雷公藤红素是否对INS-1细胞系的诱导凋亡有一定的保护作用,本研究首先用IL-1β(10ng/mL)联合不同浓度的Celastrol(100~300nmol/L)进行处理.以MTT实验所反应的细胞活性来衡量雷公藤红素的效果.如图1所示,结果显示在低浓度的状态下雷公藤红素对有炎症因子引起的凋亡有一定的抑制作用.为了更加直观和形象地观察这种现象,我们进行了PI和Hoechst双染来观察细胞的凋亡情况.当用IL-1β联合Celastrol处理种板细胞后,INS-1细胞系的凋亡得到了抑制,甚至表现轻微的增殖.荧光染色结果如图2所示:其中蓝色为正常细胞,红色为凋亡细胞(图2Alone组所示);加入炎症因子干扰后,INS-1细胞凋亡增加明显(图2Ctrol组所示);而给予雷公藤红素处理后,红色凋亡细胞数量减少(如图2Celastrol组所示),INS-1细胞的凋亡得到了抑制,结果和预期一致.
2.2 Celastrol对INS-1细胞的KSIS功能影响 为了研究雷公藤红素对INS-1细胞系KSIS功能的影响,我们分别以单一雷公藤红素刺激INS-1细胞,和雷公藤红素联合IL-1β处理INS-1细胞.结果如图3所示,结果显示在低浓度状态下,单一加入雷公藤红素对INS-1细胞系的KSIS功能影响不是很大,但当INS-1细胞系被炎症因子损伤后,雷公藤红素对INS-1细胞的KSIS功能损伤有一定的逆转作用,这种作用对于分泌出细胞外的胰岛素含量(Insulin secretion)和胞浆类的胰岛素含量(Insulin content)的作用是一致的.
2.3 INS-1细胞NO的分泌 通过NO检测试剂盒测的INS-1细胞上清之中NO的分泌如图4所示.结果表明,Celastrol可以降低有IL-1β引起的NO的分泌.
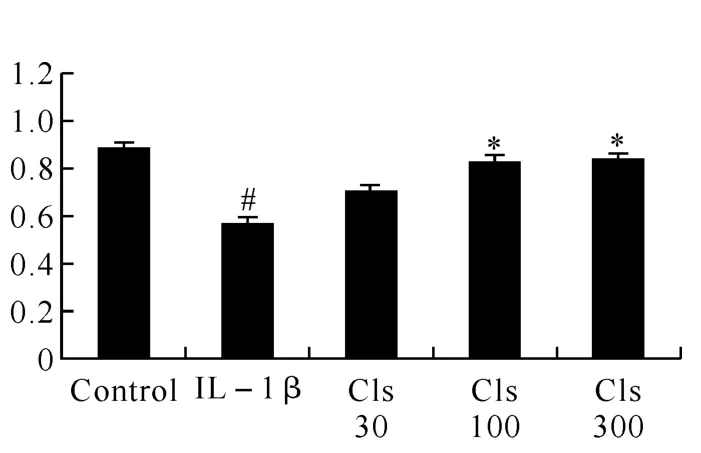
图1 雷公藤红素对INS-1活性的影响

图2 免疫荧光观察INS-1细胞凋亡
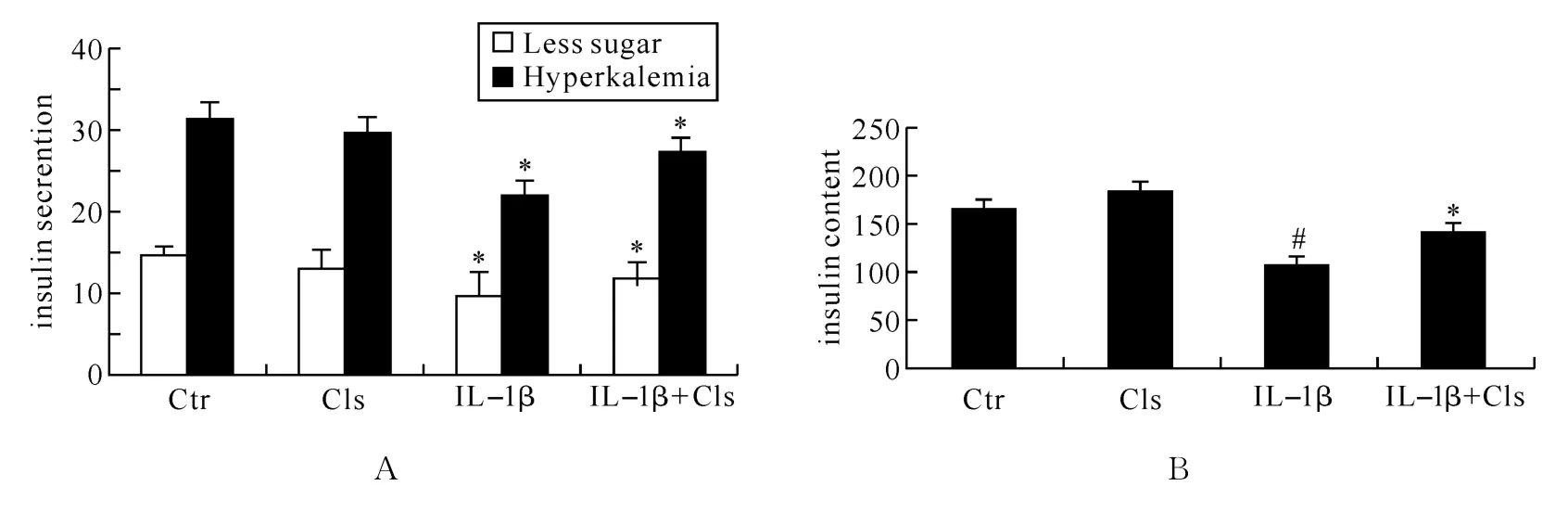
图3 KSIS验证INS-1细胞功能
3 讨论
雷公藤红素是我国一味传统的中医药,其良多的生物学活性引起了广大科研工作者的强烈兴趣.在试验中我们发现雷公藤红素对于由炎症所引起的INS-1功能损伤有一定的抑制作用,由此我们进行了一系列的实验去进一步地证实和阐明这种效果.实验结果和我们预期基本一致:在远远小于雷公藤红素细胞毒性的低浓度状态下,雷公藤红素对有IL-1β引起的大鼠胰岛细胞INS-1凋亡有一定的抑制作用;同时,INS-1分泌胰岛素的功能得到了一定程度上的恢复;而造成这一现象的可能原因是雷公藤红素抑制了INS-1细胞NO的分泌从而减缓了细胞的凋亡.此次研究为雷公藤红素作用于胰岛β细胞提供了实验的依据,为糖尿病的治疗提供了一个新的可能的方向.
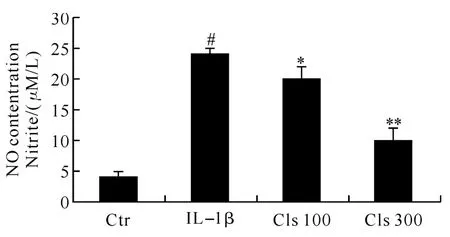
图4 ELISA检测NO的分泌
也有人指出利索茶碱可以很好地抑制胰岛β细胞体内STAT4磷酸化,进一步干扰STAT4介导的IL-12信号传递并抑制Th1细胞的活化,从而缓解促炎性因子(IL-1β,IFN-γ,TNF-α)介导的β细胞炎性损伤[4].尼克酰胺及西罗莫司等则可通过降低炎性反应相关蛋白(如单核细胞趋化蛋白1、巨噬细胞炎性蛋白1等)分泌量来阻碍IFN-γ或TNF-α介导的β细胞炎性损伤进程,以此延长β细胞的体外存活期限[5-6].由此说明,IL-1β诱导的INS-1细胞凋亡和功能损伤不可能只是单一的因素,因此相信关于雷公藤红素对INS-1细胞的生物学活性还有很多亟待研究.
同时,由于实验水平和条件的有限,还有很多方面是值得完善的.比如在高糖或高脂及炎症侵润状态下雷公藤红素对胰岛β细胞的作用;INS-1细胞NO分泌的增多是由什么来调控的,iNOS的蛋白表达是怎样的一种情况,又是经过哪一条信号通路的改变来实现的.这些问题都值得我们后期进一步地实验和探索!
[1]赵善刚.IL-1β与高浓度葡萄糖通过激活ERK信号通路协同诱导大鼠胰岛细胞死亡[D].上海:上海交通大学,2007.
[2]刘春莹,杨佳朋,胡玉斌.生物体内一氧化氮化学作用机制的研究进展[J].中国海洋大学学报,2008,65(4):567-573.
[3]Yang Huanjie,Chen Di,Cui Cindy,et al.Celastrol,a triterpene extracted from the Chinese“thunder of god vine,”is a potent proteasome inhibitor and suppresses human prostate cancer growth in nude-mice[J].Cancer Research,2006,66(9):4758-4765.
[4]Yang Z,Chen M,Ellett J D,et al.Inflammatory blockade improves human pancreatic islet function and viability[J].Transplant,2005,5(3):475-483.
[5]Moberg L,Olsson A,Berne C,et al.Nicotinamide inhibits tissue factor expression in isolated humanpancreatic islets:implications for clinical islet transplantation[J].Transplantation,2003,76(2):1285-1288.
[6]Atsuyoshi M,Camillo R,Atsushi M,et al.Antiproinflammatory effects of sirolimus on human islet preparations[J].Transplantation,2008,86(1):46-53.

