核酸定量检测试验应用于HIV-1感染实验室诊断的探讨
李繁,蒋岩,张桂云,蒲鑫,潘品良
中国疾病预防控制中心 性病艾滋病预防控制中心,北京 102206
自1997年《全国艾滋病检测工作规范》实施以来,人免疫缺陷病毒(human immunodeficiency vi⁃rus,HIV)抗体检测作为HIV实验室诊断主要检测手段的检测策略已在我国实行了十几年的时间。《全国艾滋病检测技术规范》2009年版规定,HIV抗体检测分为筛查试验(最常用的为酶联免疫吸附试验,ELI⁃SA)和确证试验(蛋白印迹法,Western印迹)[1]。
HIV抗体检测只适用于HIV感染窗口期后艾滋病患者整个病程中的艾滋病实验室诊断,不适用于HIV感染窗口期和HIV阳性母亲所生18个月以下婴儿(由于母体抗体的干扰)。此外,受被检测者自身免疫状况、病程及感染其他疾病的影响,以及高敏感性的检测方法和试剂等原因,抗体确证试验经常会出现“抗体不确定”样本[2]。此类样本须结合流行病学资料进行3个月后的跟踪随访,这给受检者带来巨大的精神压力,也不利于HIV的提早治疗和预防。
HIV-1核酸定量(HIV-1病毒载量)检测方法直接检测血液中HIV的RNA量,可早于Western印迹检测出血浆中的病毒,已经越来越受到人们的关注。在此,我们拟综合对比分析HIV-1核酸定量试验和Western印迹检测结果,探讨HIV-1核酸定量检测用于HIV-1感染实验室诊断的可行性,分析此方法在实际应用中的优点和局限性。
1 材料和方法
1.1 标本来源
选取参比室库存的145例第四代筛查试剂检测结果为阳性的血浆样本。
1.2 检测方法
1.2.1 确证试验(Western印迹,以下简称WB)采用MP生物医学公司HIV1+2型抗体检测试剂盒(免疫印迹法,HIV BLOT2.2),仪器为Autoblot system 20免疫印迹仪。
1.2.2 HIV-1核酸定量检测试验(病毒载量试验)采用Roche公司COBAS AmpliPrep/COBAS Taq⁃Man HIV-1 Test V2.0试剂盒,仪器为Roche公司Cobas AmpliPrep/Cobas TaqMan全自动分析系统。
以上试验操作均严格按照试剂盒和仪器说明书进行,所有检测试剂均在有效期内。
1.3 WB判定标准
严格按照试剂盒说明书判定。HIV-1抗体阳性要求至少检出2条env带(gp41和gp160/gp120)及gag带(p55、p24、p17)或 pol带(p66、p51、p31);HIV抗体阴性是指无HIV抗体特异带出现;HIV抗体不确定性是指出现HIV抗体特异带,但不足以判定为阳性。
2 结果
2.1 HIV-1核酸定量检测试验和WB检测结果比较
对145例样本分别进行WB和HIV-1核酸定量检测试验,WB检出阳性样本120例,阴性8例,结果不确定17例;核酸定量试验检出131例,结果为“TND”的14例。见表1。
2.2 病毒载量值的分布
131例HIV-1核酸定量试验检出样本中,69例病毒载量log10值为4~5,所占比例为52.7%;log10值为3~4的样本36份,所占比例27.5%;log10值大于5的样本18份,所占比例为13.8%;log10值小于3的样本8份,所占比例为6.0%。见表2。
2.3 WB不确定样本及HIV-1核酸定量试验和WB结果不一致样本比较
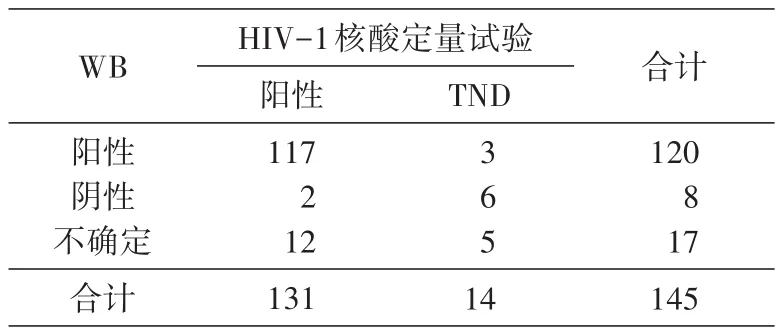
表1 HIV-1核酸定量检测试验和WB检测结果比较
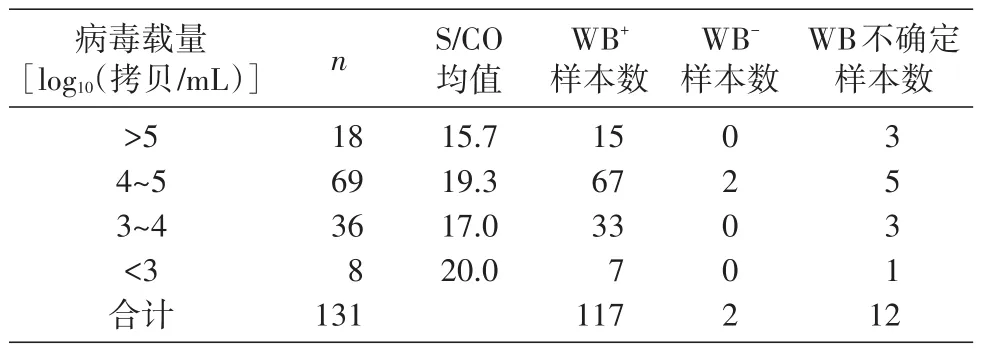
表2 HIV-1核酸定量检测结果分布
HIV-1核酸定量试验检出12例WB结果不确定样本,2例WB阴性样本;有3例WB结果为阳性的样本,HIV-1核酸定量试验结果为“TND”。见表3。
3 讨论
多年来,由于体外HIV核酸扩增试验操作步骤较复杂,受实验室环境和操作者影响因素多,容易污染而导致假阳性,HIV-1核酸定量检测大多用来评估HIV感染进程和监测抗病毒疗效,一般不作为诊断依据。《全国艾滋病检测技术规范》(2009年修订版)中规定HIV核酸检测只能作为辅助诊断依据,确诊仍然需要HIV抗体确证试验结果。随着科技的发展,HIV-1核酸定量检测技术有了很大的进展,自动化程度也日益提高,如Cobas AmpliPrep/Cobas Taq⁃Man全自动分析系统,核酸扩增和检测程序全部在密闭的仪器中由机械臂进行自动化操作,完全代替了手工提取,大大降低了污染风险,使得检测的精确度也大幅度提高。
从表1可看出,有117例样本的WB和HIV-1核酸定量试验结果一致,均为阳性。25例WB结果不确定和阴性样本中,HIV-1核酸定量试验检出14例,其中10例病毒载量值>104拷贝/mL(表2、3),符合HIV急性/早期病毒免疫学特征,可以判断为HIV急性/早期感染;其余4例病毒载量值为612~2360拷贝/mL(表3),低于通常在急性/早期感染所见到的高病毒载量。由于本实验使用的是实验室库存样本,缺少临床和随访资料,无法得知样本来源者的真实感染状态及病毒治疗相关信息,所以无从验证HIV-1病毒载量对这几例样本的诊断结果。出现这种情况,可能是因为样本采集于HIV感染病毒储存库建立初期,病毒载量值还处于较低水平;或者是由于样本采集、保存和运输不当等原因造成的核酸降解;也不能排除是实验室误操作、交叉污染等原因造成的假阳性结果。国外文献曾报道病毒载量值较低的假阳性案例[3],对于病毒载量值高于检测限但小于5000拷贝/mL的样本,通常视为可能存在假阳性结果[4-5],建议再采集一份血浆进行HIV-1核酸定量检测试验。
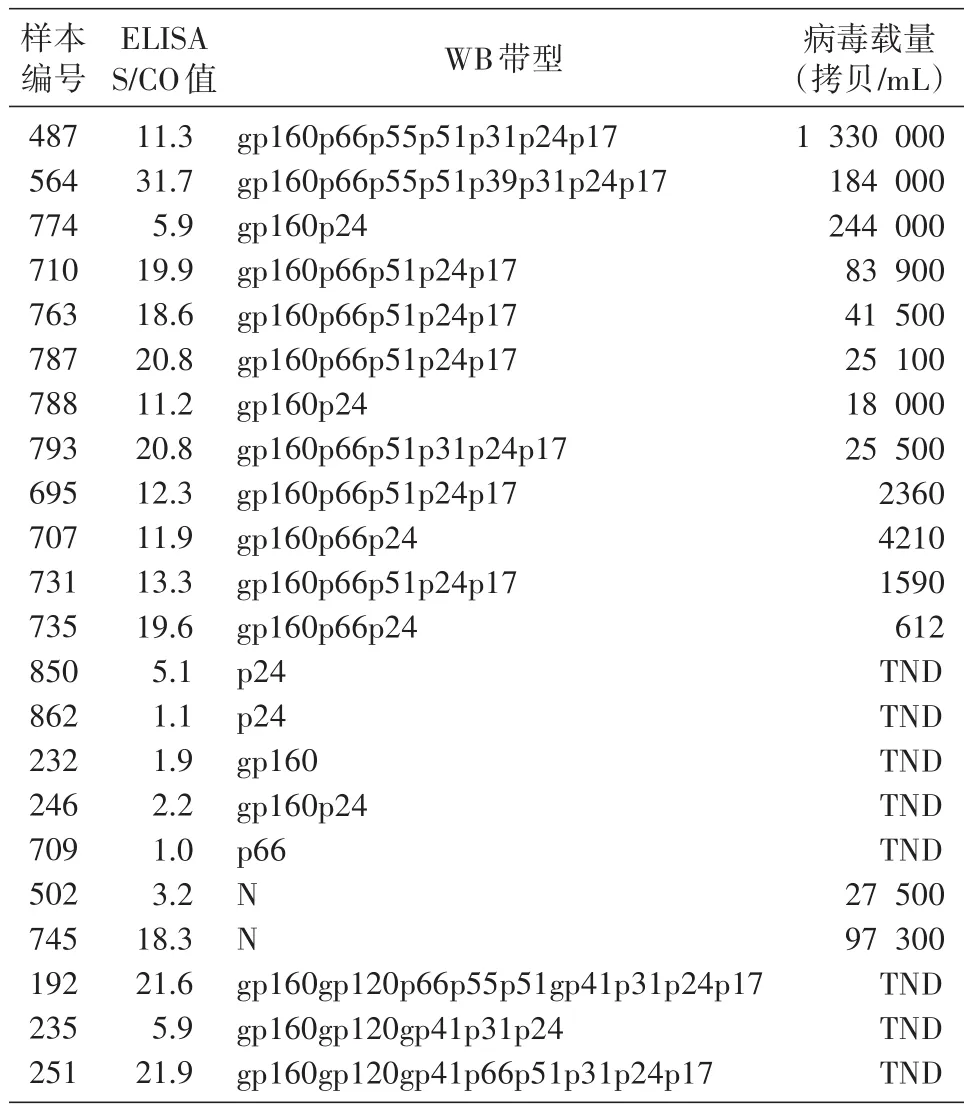
表3 WB不确定样本及WB和病毒载量试验结果不符合样本列表
有3例WB检测结果为阳性的样本,病毒载量检测结果为“TND”(表3)。这是由于HIV-1核酸定量方法本身有最低检测限(如COBAS AmpliPrep/CO⁃BAS TaqMan HIV-1 Test V2.0试剂盒的检测下限为20拷贝/mL),检测结果为“TND”只能代表未检出。曾经有报道,有少数未经治疗且抗体检测阳性的感染者,血液中病毒含量长期处于低水平状态,HIV-1核酸检测试验无法检出[6-8];检测非B亚型时,HIV-1亚型变异导致的基因差异也可能出现检测值被低估[9-12]的情况;此外,现有的HIV-1核酸定量检测试剂无法检测HIV-2的样本。所以,对于HIV-1核酸定量检测结果为“TND”的样本,建议加做WB试验或结合其他补充试验结果来进行综合诊断。
人体感染HIV后,首先在血液中检出的是HIV RNA和p24抗原,急性期感染者血浆中病毒RNA急剧复制,最高可达107拷贝/mL[13],HIV-1急性期感染者的传染性明显高于情况已稳定的感染者,有研究显示大约50%以上的HIV传播发生在HIV感染急性早期阶段[14],所以HIV-1核酸定量试验对于HIV急性/早期感染样本的意义尤其重要。在本研究中,HIV-1核酸定量试验比传统的实验室诊断(WB)方法有更高的敏感性,可以检出由于急性/早期感染等原因导致WB试验无法诊断的阳性样本,弥补传统WB诊断试验的不足。
另外,HIV-1核酸定量试验对于样本质量、实验室环境和操作者的要求较高,HIV-1核酸定量试验需要使用质量较高的血浆,可能存在肝素的样本,重度溶血、变质、乳糜血、反复冻融样本和由于温度等原因造成的保存不当等样本不适合用HIV-1核酸定量试验进行检测。在日常工作中,也要求我们要加强实验室质控,杜绝实验室污染。
[1]中国疾病预防控制中心.全国艾滋病检测技术规范(2009年修订版)[Z].2009.
[2]黑发欣,王璐.病毒载量检测在HIV/AIDS抗体疑难样本诊断中的应用[J].中国艾滋病性病,2010,16(3):323-326.
[3]Rich J S,Merriman N A,Mylonakis E,et al.Misdiagnosis of HIV infection by HIV-1 plasma viral load testing:a case se⁃ries[J].Ann Intern Med,1999,130:37-39.
[4]New York State Department of Heather AIDS Institute.Diag⁃nostic,monitoring,and resistance laboratory tests for HIV.Up⁃dated February 2011;section updates January 2014;section updates January 2014[E/OL].http://www.hivguidelines.org/wpcontent/uploads/2014/01/diagnostic-monitoring-and-resistancelaboratory-tests-for-hiv.pdf[2014-04-16].
[5]New York State Department of Heather AIDS Institute.Diagno⁃sis and management of acute HIV infection.Updated January 2010-Currently under Revision[E/OL].http://www.hivguidelines.org/wp-content/uploads/2012/10/diagnosis-and-management-ofacute-hiv-infection-10-16-2012.pdf[2014-04-16].
[6]Laperche S,Morel P,Deschaseaux M,et al.HIV antibody screening remains indispensable for ensuring viral safety of blood components despite NAT implementation[J].Transfusion,2003,43:1428-1432.
[7]Heffelfinger J,Delaney K,Owen M,et al.Ability of the gen⁃probe APTIMA HIV-1 RNA qualitative assay to confirm reac⁃tive rapid HIV screening tests[A]//Poster Session Presented at 16thConference on Retroviruses and Opportunistic Infections.2009:#993.
[8]Nugent C T,Nodelman V,Giachetti C,et al.Evaluation of a highly sensitive qualitative human immunodeficiency virus type1(HIV-1)RNA assay for detection fo HIV-1 suppression[J].J Clin Microbiol,2009,47(3):833-836.
[9]Lyles C M,Vlahov D.Comparison of two measures of human immunodeficiency virus(HIV)type 1 load in HIV risk groups[J].J Clin Microbiol,1998,12:3647-3652.
[10]Damond F,Roquebert B,Benard A,et al.Human immunodefi⁃ciency virus type 1(HIV-1)plasma load discrepancies be⁃tween the Roche COBAS AMPLICOR HIV-1 MONITOR Ver⁃sion 1.5 and the Roche COBAS AmpliPrep/COBAS TaqMan HIV-1 assays[J].J Clin Microbiol,2007,45:3436-3438.
[11]Wolff D,Gerritzen A.Comparison of the Roche COBAS Am⁃plicorMonitor,Roche COBAS Ampliprep/COBAS TaqMan and Abbott RealTime Test assays for quantification of hepati⁃tis C virus and HIV RNA[J].Clin Chem Lab Med,2007,45:917-922.
[12]Robertson K,Fiscus S.CSF,plasma viral load and HIV asso⁃ciated dementia[J].J Neuro,1998,4:90-94.
[13]Daar E S,Moudgil T,Mreye R D,et al.Transient high lev⁃els of viremia in patients with primary human immunodeficien⁃cy virus type 1 infection[J].N Engl J Med,1991,324(14):961-964.
[14]Priddy F H,Pilcher C D,Gupta P,et al.Detection of acute HIV infections in an urban HIV counseling and testing popu⁃lation in the United State[J].J Acquir Immune Defic Syndr,2007,44(2):196-202.

