乙型脑炎病毒可视化分型基因芯片的制备
薛斐 ,辛舒,2,田宇飞,孙文超,2,温树波,2,阎富龙,2,盛媛,2,王茂鹏,3,朱羿龙,3,田明尧,金宁一
1.军事医学科学院 军事兽医研究所,省部共建吉林省人兽共患病预防与控制重点实验室,吉林 长春 130122;2.吉林农业大学 动物科技学院,吉林 长春 130118;3.吉林大学 畜牧兽医学院,吉林 长春 130062
乙型脑炎病毒又称日本脑炎病毒(Japanese en⁃cephalitis virus,JEV),属披膜病毒科黄病毒属,为单股RNA病毒,由其引起的疾病称为乙型脑炎。乙型脑炎是一种中枢系统人畜共患急性传染病,以高热和狂暴、抑郁等神经症状为特征[1]。三带喙库蚊为JEV的主要传播媒介,猪是主要的传染源,病毒通常在猪-蚊-蚊或人等动物间循环[2]。
基于进化树分析对JEV进行分型的方法有2种,一种依据PrM蛋白基因进行分型[3-4],另一种则依据E蛋白基因进行分型[5]。由于PrM基因长度较短,使得分析结果存在一定程度的可变性,所以根据E蛋白基因序列进行进化树分析已逐渐成为主要的分型方法。依据E蛋白基因序列,可将JEV分为5种基因型(Ⅰ~Ⅴ)。JEV主要在亚洲流行,我国目前分离到的毒株有Ⅰ、Ⅲ和Ⅴ型[3-4],但主要是Ⅰ型和Ⅲ型。
目前,乙型脑炎诊断方法主要有血清学诊断、分离培养和分子生物学方法[6],一次试验一般只能检测样品中的一种基因型,样品量较大时不能在短时间内提供检测结果。因此,建立一种具有同步检测和鉴别诊断功能的快速、灵敏、高效的诊断方法有重要意义。我们拟设计JEV型特异性探针,用于对JEV基因的分型检测,以期为JEV的快速诊断和流行病学监测提供有效的检测技术。
1 材料和方法
1.1 材料
含JEV-Ⅰ PrM和E基因(GenBank登录号:AF045551.2)的质粒、含基孔肯亚病毒(CHIKV)E基因(GenBank登录号:FJ95103)的质粒、含辛德比斯病毒(SINV)E基因(GenBank登录号:U38305)的质粒均由Blue Heron生物技术公司合成;含JEV-ⅢPrM和E基因(GenBank登录号:JN604986.1)的质粒由本实验室保存;2×Taq PCR Master Mix购自天恩生物有限公司;Simply P总RNA提取试剂盒购自BioFlux公司;Axyprep质粒DNA小量提取试剂盒和Axyprep DNA凝胶回收试剂盒均购自Axygen公司;链霉亲和素标记纳米金和银染试剂购自NanoProbes公司;SDS、20×SSC购自Promega公司;点样缓冲液、光学级醛基基片、芯片杂交盒、芯片盖玻片等购自北京博奥生物有限公司;生物素标记的特异性引物(上游引物为5'-BIOTIN-AAGCTTyTGATGACCATCA AC-3',下游引物为5'-AAGCTTyTGATGACCATCA AC-3')及氨基修饰寡核苷酸探针(表1)由上海生工生物工程有限公司合成。
Micro GridⅡ610基因芯片点样仪(Genomic So⁃lutions公司);离心浓缩仪(Eppendrof公司);Genepi×personal 4100A扫描仪(Axon公司);TC-512型PCR仪(Techne公司);IF-Ⅲ分子杂交炉(宁波新芝生物科技股份有限公司);HH-1数显恒温水浴锅(金坛市金南仪器制造有限公司)。
1.2 探针的设计
根据JEV-Ⅰ和JEV-Ⅲ基因组序列,用BLAST、Accelrys Gene和Array Designer 4.0等生物信息学软件,按照探针设计基本原则,设计1条阳性对照探针和3条用于检测的18~21 mer Oligo探针(表1),探针终浓度为50 μmol/L,将点样液与探针等体积混匀,加入384孔板中,-20℃保存。
1.3 阵列设计、打印及玻片处理
芯片微阵列设计为3×3阵列,每个位点包含一种探针的一个4×4阵列(图1)。用Micro GridⅡ610基因芯片点样仪将探针有序地打印在玻片上,将醛基玻片放入杂交盒中,于37℃恒温箱中固定12 h,固定结束后用37℃预热的洗涤液(2 g/L SDS)清洗2 min,在双蒸水中清洗1 min,最后放在封闭液中封闭5 min,用双蒸水洗脱,离心甩干。
1.4 杂交与检测
将PCR产物加热至96℃变性5 min,立即取出并冰浴3 min,每一个样品取15 μL PCR变性产物,与5 μL上游引物和20 μL杂交缓冲液混匀,将混合物加至芯片阵列孔上,将杂交盒置42℃水浴4 h;杂交结束后取出芯片,立即放入42℃预热的洗液Ⅰ(2×SSC,1 g/L SDS)、洗液Ⅱ(0.1×SSC,1 g/L SDS)、洗液Ⅲ(0.1×SSC),在42℃杂交炉中各清洗2 min,双蒸水洗脱1 min,离心甩干,置4℃保存;加入链霉亲和素标记的纳米金(用1×PBS+5 g/L BSA 1∶400稀释),40 μL/孔,37℃水浴 25 min,用 1×PBS洗脱 2 min,双蒸水洗脱1 min,离心甩干;每孔加入银染A液和银染B液各20 μL混匀,37℃孵育5 min,双蒸水洗脱,离心甩干,重复操作,37℃孵育2 min,双蒸水洗脱;肉眼观察可见明显阳性信号,也可用普通扫描仪或照相机记录。
1.5 芯片特异性试验
分别提取本实验室保存的蓝耳病病毒(PRRSV,长春株)、猪新城疫病毒JL01株(由本室2000年分离保存)、H9N2型禽流感病毒(由本室2004年分离保存)鸡胚尿囊液的RNA,经反转录得到cDNA,用已设计好的特异性引物进行PCR;另外,以含基孔肯亚病毒E基因的质粒、含辛德比斯病毒E基因的质粒、JEV-Ⅰ和JEV-Ⅲ的含PrM和E基因的质粒为模板进行PCR。将以上6种PCR产物分别与芯片杂交,进行可视化,用普通扫描仪扫描结果。

表1 JEV寡核苷酸探针即序列

图1 芯片3×3阵列图
1.6 芯片灵敏性试验
测定JEV-Ⅰ、JEV-Ⅲ质粒质量浓度分别为40.8和 44.2 μg/mL,计算初始拷贝数分别为 8.1×1013和7.9×1013拷贝/mL,然后用ddH2O分别将JEV-Ⅰ和JEV-Ⅲ质粒进行1/10梯度稀释,以稀释的质粒为模板进行PCR,与芯片杂交,实现可视化。
1.7 芯片重复性试验
分别以JEV-Ⅰ、JEV-Ⅲ的含PrM和E基因的质粒为模板进行PCR,扩增出生物素标记的PCR产物,应用同批5片芯片、不同批5片芯片分别进行杂交,以检测不同批次芯片制备的重复性及同一批次芯片的同一性。
2 结果
2.1 芯片杂交试验
分别以含JEV-Ⅰ或JEV-Ⅲ的PrM和E基因的重组质粒为模板,用生物素修饰的特异性引物进行PCR,得到460 bp的目的条带(图2),与预期相符。
预杂交的芯片滴加5 μL 5'端生物素修饰的上游引物、15 μL生物素修饰的PCR变性产物和20 μL杂交缓冲液混合物,在42℃水浴锅中杂交4 h,经可视化后用普通扫描仪扫描,结果见图3,1号阳性坐标探针即Ynyxdz探针、2号探针即Yn0b探针处均有阳性信号,JEV-Ⅰ扫描结果中3号探针即Yn1b探针处有信号,JEV-Ⅲ扫描结果中4号探针即Yn3a探针处有信号。由此可知,2号探针可用于鉴定JEV,3号和4号探针可用于JEV的分型。
2.2 特异性试验

图2 重组质粒PCR扩增产物琼脂糖凝胶电泳图

图3 JEV鉴定及分型可视化结果
将1.5中描述的6种PCR扩增产物与芯片进行杂交,可视化后用普通扫描仪扫描芯片。结果表明,蓝耳病病毒、猪新城疫病毒、禽流感病毒、基孔肯亚病毒、辛德比斯病毒的PCR扩增产物除阳性坐标探针有信号外,其他探针均无阳性信号,JEV的2种亚型质粒PCR扩增产物混合后能同时检出阳性信号(图4)。
2.3 灵敏性试验
用ddH2O分别将JEV-Ⅰ和JEV-Ⅲ质粒按一定比例稀释后进行PCR,当质粒至105拷贝/mL时,PCR产物电泳条带难以辨认,当稀释至104拷贝/mL时已无条带出现(图5)。
以稀释的质粒为模板进行PCR,扩增产物与芯片进行杂交,用扫描仪扫描,结果见图6。当JEV-Ⅰ稀释至8.1×105拷贝/mL时有微弱信号,稀释至8.1×104拷贝/mL或更低时,未检测到阳性信号。当JEV-Ⅲ质粒为7.9×105拷贝/mL时,除阳性坐标探针有信号外,2号和4号探针仍有微弱信号;当稀释至7.9×104拷贝/mL或更低时,未检测到阳性信号。

图4 PCR(A)与芯片(B)检测JEV的特异性试验
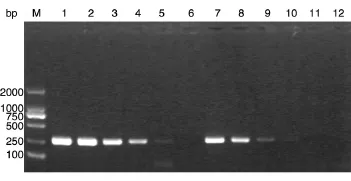
图5 JEV-Ⅰ和JEV-Ⅲ质粒梯度稀释后PCR产物电泳图
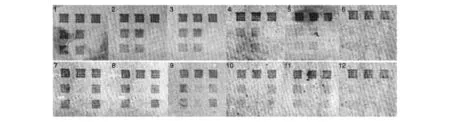
图6 芯片检测JEV-Ⅰ和JEV-Ⅲ质粒的灵敏度试验
2.4 重复性试验
分别以JEV-Ⅰ、JEV-Ⅲ含PrM和E基因的2种重组质粒为模板进行PCR,将扩增出的荧光标记的PCR产物与芯片杂交。随机抽取同一批次制备的芯片5张,在同一条件下进行检测,结果均为阳性,表明同批制作的芯片具有同一性;随机抽取不同批次制备的芯片5张,在相同条件下进行检测,结果均为阳性,说明不同时间制备的芯片重复性、稳定性好。
3 讨论
利用基因芯片技术进行人和动物疫病的检测是未来疾病诊断的一个发展方向。基因芯片检测技术有其独特的优点,可从核酸水平对病原进行检测,而且可将多种不同病原的探针集成到同一张芯片上,对相关病原同时进行检测,还可以做到对病原体进行血清型和毒力的区分。基因芯片技术对病原微生物进行基因分型最为突出的例子是在肝炎病毒研究方面。目前研究较多的是利用短Oligo基因芯片对流感病毒[7-8]、HIV、人乳头瘤病毒[9]、轮状病毒[10]、肝炎病毒[11]等进行基因分型。Lin等[12]建立的Oligo基因芯片可检测9种呼吸道病毒(流感病毒、呼吸道合胞病毒、腺病毒、冠状病毒、副流感病毒等)和9种其他呼吸道病原体(炭疽杆菌、百日咳杆菌、肺炎衣原体、土拉菌、肺炎支原体、耶尔森菌等),采用多重PCR扩增病原体基因,可对临床标本中以上病原体进行种及分离株的检测及分型。
在本研究中,我们制备了针对Ⅰ型与Ⅲ型JEV的分型及鉴定基因芯片。我们根据GenBank中的JEV-Ⅰ和JEV-Ⅲ的PrM和E基因序列差异,设计出JEV分型引物及寡核苷酸探针,且引物5'端带有生物素修饰,其中1号探针作为阳性坐标探针。实验证明,探针浓度为50 μmol/L时杂交信号可达到饱和,效果最佳。通过37℃水浴固定、2 g/L SDS清洗和2.5 g/L NaHB4封闭后,将稀释的探针固定于醛基化玻片上,分别以含JEV-Ⅰ和JEV-Ⅲ的PrM和E基因的2种重组质粒为模板进行PCR,将PCR产物与探针在42℃[13]杂交炉中杂交,通过可视化获得肉眼可见结果。普通扫描结果显示,除阳性坐标探针外,共有3条寡核苷酸检测探针特异地与相应的标记样品杂交,芯片上呈现较强的阳性杂交信号,其中2号探针一直能出现信号,说明2号探针可用于鉴定JEV。3、4号探针可分别用于鉴定JEV-Ⅰ和JEV-Ⅲ。通过特异性、灵敏度及重复性试验的验证,制备的基因芯片具有病毒特异性和可靠的重复性,灵敏度比PCR高10倍。以上结果表明,本研究制备的基因芯片可为JEV的检测及分型提供一种快速、准确、高通量的方法。
[1]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997:633.
[2]王逸民,任广宏,葛继乾,等.我国乙脑主要传播媒介和主要宿主动物的确定及其在疫区区划和流行病学监测中的作用[J].医学研究通讯,1990,19(1):26-28.
[3]谭翰,陈清华,谭海芳.乙型脑炎病毒检测技术研究进展[J].中国卫生检验杂志,2006,16(11):1402-1404.
[4]Chen W R,Tesh R B,Rico-Hesse R,et al.Genetic varia⁃tion of Japanese encephalitis virus in nature[J].J Gen Virol,1990,71:2915-2922.
[5]Chen W R,Tesh R B,Rico-Hesse R.A new gene type of Japanese encephalitis virus from Indonesia[J].Am J Med Hyg,1992,47:61-69.
[6]Li M H,Fu S H,Chen W X,et al.Genotype V Japanese en⁃cephalitis virus is emerging[J].PLoS NegI Trop Dis,2011,5(7):e1231.
[7]Ivshina A V,Vodeiko G M,Kuznetsov V A,et al.Mapping of genomic segments of influenza B virus strains by an oligo⁃nucleotide microarray method[J].J Clin Microbiol,2004,42(12):5793-5801.
[8]Li J,Chen S,Evans D H.Typing and subtyping influenza vi⁃rus using DNA microarrays and multiplex reverse transcrip⁃tase PCR[J].J Clin Microbiol,2001,39(2):696-704.
[9]van Doorn L J,Quint W,Kleter B,et al.Genotyping of hu⁃man papillomavirus in liquid cytology cervical specimens by the PGMY line blot assay and the SPF10 line probe assay[J].J Clin Microbiol,2002,40:979-983.
[10]Chizhikov V,Wagner M,Ivshina A,et al.Detection and geno⁃typing of human group A rotaviruses by oligonucleotide micro⁃array hybridization[J].Clin Microbiol,2002,40(7):2398-2407.
[11]李宁,毛红菊,祁自柏.基因芯片法特异性检测丙型肝炎病毒的基因分型[J].中国免疫学杂志,2005,21(9):687-689.
[12]Lin B C,Wang Z,Gary J V,et al.Broad-spectrum respirato⁃ry tract pathogen identification using resequencing DNA micro⁃arrays[J].Genome Res,2006,16(4):527-535.
[13]孙珊珊,沈国顺,田明尧,等.甲型H1N1与季节性H1N1流感病毒检测基因芯片的制备与初步应用[J].中国兽医学报,2010,30(5):634-638.

