化疗药物对细胞因子诱导的杀伤细胞(CIK)的影响
焦 雪,王士勇*,刘 畅,刘迪杰,单风平
(1.中国医科大学附属第四医院生物治疗科,辽宁 沈阳 110032;2.中国医科大学基础医学院免疫教研室,辽宁 沈阳 110001)
细胞因子诱导的杀伤细胞(Cytokine-induced killer cells,CIK)是一种新型的免疫活性细胞,是人外周血单个核细胞在体外经多种细胞因子刺激后获得的一群异质细胞,兼具T淋巴细胞强大的杀瘤活性和NK细胞的非MHC限制性,作为一种新的治疗手段,安全、有效,已广泛应用于多种血液和实体肿瘤的治疗。近年来研究表明,化疗联合CIK细胞治疗肺癌、肾癌、鼻咽癌和肝癌等各种肿瘤均获得显著的疗效[1]。但是,当化疗与CIK联合时,采用何种方式,包括化疗后间隔多长时间输注CIK细胞才是恰当的,均不明确。为此,必须明确化疗药物对CIK细胞增殖活性及CIK细胞亚群的影响,特别是对效应细胞 CD3+CD56+和CD3+CD8+的影响。本文选用了临床上常用的几种化疗药物,采用不同的药物浓度,体外检测了对CIK细胞增殖活性的影响,以此模拟化疗药物体内代谢过程中不同时间对CIK及其亚群的影响,从而明确化疗后CIK输注的时机,为临床治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 试剂 人淋巴细胞分离液(天津景洋生物制品科技有限责任公司,批号:30130508-0364);抗CD3单克隆抗体(天津美德太平洋科技有限公司,批号:231301A);重组人 IFN-γ(美国 PEPROTECH公司,批号:121127);IL-1α(美国 PEPROTECH公司,批号:060811);重组人IL-2(山东泉港药业有限公司,批号:201306001);无血清细胞培养液(日本 Cell Science & Technology Inst.,Inc,批号:191303A);四色淋巴细胞亚群分析试剂盒(美国BD公司,批号:79890);MTT(德国Sigma公司,批号:1017130D);顺铂(齐鲁制药有限公司,批号:20130920);氟尿嘧啶(天津金耀氨基酸有限公司,批号:1307101);紫杉醇(哈药集团生物工程有限公司,批号:20130602);地塞米松磷酸钠(国药集团容生制药有限公司,批号:13062011)。
1.1.2 仪器 FACSCalibur流式细胞仪(美国BD公司),细胞培养箱(上海力新仪器设备公司),酶标仪(美国Thermo公司,型号Multiskan Mk3)。
1.2 方法
1.2.1 CIK细胞制备 按照本实验室既往报告的方法进行[6],简述如下:选取10名健康志愿者,男、女各5人,年龄25~50岁,平均年龄(37.23±11.72)岁,分别抽取外周血20 mL,用淋巴细胞分离液提取外周血单个核细胞(PBMCs),培养当天加入重组人IFN-γ(1000 U/mL),24 h后加入IL-1α(500 U/mL)、IL-2(1000 U/mL)和 CD3 单抗(1/μg/mL),4 d 后仅加入 IL-2(1000 U/mL)和无血清培养基[5],在37℃、5%CO2细胞培养箱内培养。
1.2.2 体外检测化疗药物对CIK细胞增殖活性的影响 采用MTT法,取第20天的CIK细胞,接种到96孔板,每孔加入1×106个 CIK细胞,37℃、5%CO2孵育4 h,将不同浓度顺铂、氟尿嘧啶、紫杉醇及地塞米松分别接种于相应孔内,每种药物设4组:培养液空白对照组、CIK细胞对照组、CIK+药物组、CIK+药物组+IL-2组,每组设6个复孔。共培养24~72 h,洗涤2次、加入MTT 20 μL(终浓度为 5 mg/mL),共孵育 4 h,1500 r/min离心10 min,弃上清、加入二甲基亚砜 150 μL,10 min震荡混匀,570 nm测量各孔OD值,计算增殖活性。计算公式:增殖活性(%)=((实验组OD值-空白对照组OD值)/CIK细胞对照组OD值)×100%
1.2.3 流式细胞仪检测CIK细胞淋巴细胞亚群取待检测的CIK细胞,调整细胞浓度至1×106/mL,分别取100 μL加入A、B两管,四色淋巴细胞亚群分析试剂盒(A:D45-PerCP/CD3-FITC/CD4-APC/CD8-PE;B:CD45-PerCP CD3-FITC/CD16+56-PE/CD19-APC)染色,向A管内加入A液20 μL,B管内加入B液20 μL,室温避光染色30 min,再加入PBS 450 μL,充分混匀,室温避光15 min后上流式细胞仪检测 CD3+、CD3+CD4+、CD3+CD8+、CD3+CD56+细胞比例,实验重复3次。
1.2.4 统计学处理 应用SPSS17.0软件进行统计学分析,采用样本均数t检验比较两组差异,多组资料比较采用方差分析,组间比较采用LSD法,P<0.05为差异有统计学意义。
2 结果与分析
2.1 化疗药物对CIK细胞增殖活性的影响
本实验选用了临床常用的3种化疗药物及一种细胞回输的辅助用药地塞米松,每种药物设6~7种浓度,与CIK细胞作用24~72 h,图1为作用24 h的结果。顺铂、氟尿嘧啶、紫杉醇及地塞米松对CIK细胞的增殖活性均产生显著影响,其中顺铂和紫杉醇表现出明显的浓度依赖性,差异显著(P<0.05)(图1A、B);5-氟尿嘧啶在极低的浓度对CIK细胞即有影响,但随着浓度的增加对CIK细胞毒性并未增加(图1C)。地塞米松同样在低浓度即可影响CIK细胞的增殖,随着浓度增加对CIK细胞的毒性并未增加(图1D)。IL-2可提高CIK细胞的增殖活性,特别是在5-氟尿嘧啶和地塞米松组(P<0.05),而在顺铂组和紫杉醇组保护作用极低(见图1)。药物与CIK细胞作用48、72 h,与作用24 h的结果呈现同样的趋势(图未给出)。

图1 化疗药物及地塞米松对CIK细胞增殖活性的影响Fig.1 Effect of chmomedicine and dexamethasone on proliferative viability of CIK cells
2.2 化疗药物对 CIK细胞淋巴细胞亚群的影响
为了解各种药物对CIK亚群的影响,每种药物取2种浓度,体外与CIK细胞作用24~72 h。90%抑制浓度顺铂(5 μg/mL)与CIK细胞共培养24 h的结果如下(见表1、图2~4)。

图2 顺铂对CD3+CD4+细胞亚群的影响Fig.2 Effect of DDP on proportions of CD3+CD4+sunsets
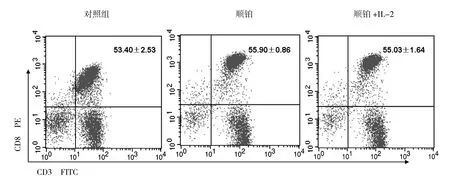
图3 顺铂对CD3+CD8+细胞亚群的影响Fig.3 Effect of DDP on proportions of CD3+CD8+sunsets

图4 顺铂对CD3+CD56+细胞亚群的影响Fig.4 Effect of DDP on proportions of CD3+CD4+sunsets

表1 顺铂对CIK细胞淋巴细胞的影响Table 1 Effect of DDP on proportions of lymphocyte sunsets
3 讨论
CIK细胞的主要效应细胞为CD3+CD56+亚群淋巴细胞,该细胞亚群同时表达CD3和CD56两种膜蛋白分子,其杀瘤活性具有非MHC限制性。CD3+CD56+CIK细胞主要通过释放含有细胞溶解毒素的细胞颗粒由细胞膜渗透进靶细胞从而引起靶细胞的溶解,起到对肿瘤细胞的直接杀伤作用[3]。在培养CIK细胞的过程中,活化后的CIK 细胞可产生大量的 TNF-α、GM-CSF、IFN-γ 等细胞炎性因子,可以通过机体的免疫调节作用间接杀伤肿瘤细胞[4]。近年来研究表明,化疗联合CIK细胞治疗转移性肾癌取得了良好的近期疗效[5],胃癌患者术后化疗联合CIK免疫治疗可以显著延长患者生存期[6],支气管动脉灌注化疗联合CIK细胞治疗非小细胞肺癌疗效优于全身静脉化疗[7],肝动脉栓塞化疗联合CIK细胞疗法可提高原发性肝癌患者的远期生存率[8]。目前,化疗联合CIK细胞治疗已广泛应用于多种恶性肿瘤的治疗,但是,当化疗与CIK联合时,化疗药物会对CIK细胞产生多大影响以及化疗后间隔多长时间回输CIK细胞尚未见明确报道。
顺铂是一种周期非特异性抗肿瘤药物,静脉注射后主要分布于肝、肾、肠道及皮肤组织中,血浆半衰期55~73 h,全剂量注入5 d内仅有27%~43%排除体外。临床常用剂量为75 mg/m2,按人均 1.7 m2、60 kg 计算,相当于 2.1 μg/mL。根据本实验 MTT结果,加入 IL-2组顺铂浓度为0.156 μg/mL时细胞增殖活性为90%,按半衰期55~73 h可推测顺铂治疗后10~14 d回输CIK细胞同时加入IL-2可以保持细胞增殖活性 >90%。氟尿嘧啶为抗代谢类广谱抗肿瘤药物,静脉用药后广泛分布于体液中,半衰期很短,仅10~20 min,并在4 h内从血中消失,本实验结果显示氟尿嘧啶对CIK细胞影响较弱,加入IL-2组CIK增殖活性显著提高,因而氟尿嘧啶治疗后1~2 d即可回输CIK细胞。紫杉醇是一种天然来源抗肿瘤药物,主要在肝脏代谢,血浆半衰期5.8 h,本实验结果显示CIK细胞对紫杉醇的杀伤作用较敏感,根据半衰期5.8 h推测紫杉醇在体内完全代谢约需3~4 d,因而建议紫杉醇治疗3~4 d开始回输CIK细胞。从以上3种细胞毒性药物对CIK的影响来看,化疗后1周左右回输CIK细胞应该是可行的,但是含有顺铂的方案应延长回输的时间,或者选择水化等方式,加快其排泄。地塞米松为糖皮质类激素药物,具有抗炎、抗内毒素、抑制免疫、应激及抗休克等药理作用,血浆半衰期为190 min,主要用于在CIK细胞回输过程中可能出现的过敏反应及输液反应的患者。本实验明确了地塞米松有抑制CIK细胞增殖的作用,但其是否对杀伤活性有影响,尚不明确。因此,应慎用地塞米松。
IL-2(interleukin-2)是一种T细胞生长因子,主要由活化的CD4+和CD8+T细胞产生,具有广泛的生物活性[9-10]。研究表明,IL-2可诱导细胞溶解酶颗粒聚集,从而增强CD8+T细胞和NK细胞的细胞溶解活性[11-12]。本研究结果证明,在低浓度的化疗药物作用下,IL-2可提高CIK细胞的增殖活性。此外,我们另外的体外杀伤实验证明,CIK细胞杀伤肿瘤细胞时,加入IL-2可提高其杀伤活性。因此,在应用CIK细胞治疗时,应同时给予IL-2,以保持CIK细胞的增殖和杀伤活性。
本文根据以上3种化疗药物的临床最大用药剂量设置浓度梯度,以模拟体内代谢过程中不同时间对CIK细胞的影响,从而明确化疗后CIK细胞治疗的时机。建议根据不同化疗药物体内代谢半衰期的长短以及患者情况制定个体化的治疗方案,在CIK细胞治疗的同时给予IL-2,从而提高CIK细胞的治疗效率。此外,进行CIK细胞治疗时尽量减少地塞米松的使用。
[1]Jiang Jingting,Wu Changping,Lu Binfeng.Cytokine-induced killer cells promote antitumor immunity[J].Journal of Translation Medicine,2013,11:83.
[2]王士勇,杜微丽,张晖,等.重组人纤维连接蛋白诱导的CIK细胞的生物学特性和对肺癌细胞株杀伤活性的体外研究[J].中国肺癌杂志,2010,13(4):277-281.
[3]Metha BA,Schmidh-Wolf,Weissman IL,et al.Two path ways of exocytosis of cytoplasmic granule contents and target cell killing by cytokine-induced CD3+CD56+killer cells[J].Blood,1995,86(9):3493-3499.
[4]Zhang Jinying,Zhu Lingjun,Wei Juan,et al.The effect of cytokine-induced killer cells for treatment of patients with solid tumors:a clinical retrospective study[J].J Cancer Res Clin Onclo,2012,138:1057-1062.
[5]袁香庆,崔传亮,斯璐,等.化疗联合CIK细胞回输治疗转移性肾细胞癌 II期临床研究[J].肿瘤学杂志,2008,14(5):362-365.
[6]樊永丽,赵华,于津浦,等.胃癌患者术后化疗联合CIK免疫治疗的临床疗效[J].中国肿瘤生物治疗杂志,2012,19(2):168-174.
[7]赵光强,叶联华,段林灿,等.全身化疗和支气管动脉灌注联合CIK过继性免疫治疗III期非小细胞肺癌的临床研究[J].中国肺癌杂志,2009,12(6):493-494.
[8]Huang ZM,Li W,Li S,et al.Cytokine-induced killer cells in combination with transcatheter arterial chemoembolization and radiofrequency ablation for hepatocellular carcinoma patients[J].J Immunother,2013,36(5):287-293.
[9]赵定亮,单风平.白细胞介素-2最新研究进展[J].微生物学杂志,2013,33(4):77-83.
[10]薛明,杨谛,单风平.白介素-2及干扰素-γ对人成骨细胞增殖的影响[J].微生物学杂志,2009,29(4):59-61.
[11]Liao W,Lin JX,Leonard WJ.Interleukin-2 at the crossroads of effector responses,tolerance,and immunotherapy[J].Immunity,2013,38(1):13-25.
[12]James AM,Hsu HT,Dongre P,et al.Rapid activation receptor-or IL-2-induced lytic granule convergence in human natural killer cells requires Src,but not downstream signaling[J].Blood,2013,121(14):2627-2637.

