玉米丝黑穗病苗的快速鉴定*
马 鹏,刘子玥,吕亚楠,张延明**,晋齐鸣,贾 娇
(1.哈尔滨师范大学;2.吉林省农业科学院)
0 引言
玉米作为中国乃至全世界第一大粮食作物,是重要的粮食作物和饲料来源,同时也是全球总产量最高的经济粮食作物.而玉米丝黑穗病作为一种全球性的病害已经严重的影响了全球各地玉米的产量,同时也是制约我国玉米产业快速发展的主要病害之一[1].玉米丝黑穗病又名乌米、哑玉米等,在华中、华北、华南、东北、西北和西南地区都普遍发生.2002年东北地区玉米丝黑穗病大面积的发生,其平均发病率为10% ~15%,严重的地区高70% ~80%[2].随着玉米感病品种的大规模种植,玉米丝黑穗病的发病率一年高过一年[3],并且已经成为了危害我国玉米产量的重要病害.因此,寻找一种能够快速且有效的方法对玉米丝黑穗病进行检测显得尤为重要,为研究丝孢堆黑粉菌的致病机理,寻找防治该病害的新途径、新方法提供技术支持.
在对植物进行某种病原检测中,通常使用的是PCR检测技术.PCR技术用来检测病原物是指选择某一特定的引物去扩增相应的目的DNA片段[4].该实验所采用的引物是由上海生工生物公司合成的玉米丝黑穗病菌的特异性引物(GSP),然后采用PCR扩增检测技术可以对玉米病苗中的丝黑穗病菌基因组进行特异性的扩增,对扩增的样品DNA进行浓度为1.5%的琼脂糖凝胶电泳,最后在凝胶成像系统中进行观察和记录,从而得知玉米是否感染了丝黑穗病.最后计算出该特异性引物GSP对玉米病苗的检测效率,看是否可以用于快速有效的对玉米感病植株在发病之前对病菌进行检测.
1 材料与方法
1.1 材料准备
(1)丝黑穗冬孢子的观察
称取10 mg已经处理好的玉米丝黑穗病菌冬孢子粉,将其置于1.5 mL的离心管中,加入适量的无菌水浸泡过夜,然后置于高速离心机中离心2 min(10000 r/min),弃掉上清液.再用无菌水处理1 d,再次离心并弃掉上清液[5].将已经处理好的冬孢子沉淀浸泡于配置好的2%葡萄糖溶液中,置于28℃的温箱中黑暗培养3 d,3 d后观察冬孢子的萌发状态.
(2)试验材料及病菌
玉米感病品种(黄早4),植物DNA提取试剂盒(宝生物公司购买),供试丝黑穗病菌(将事先收集好的病菌样品置于室内晾干,再用筛子充分筛选出孢子粉,将孢子粉置于通风、阴凉、干燥处保存备用).
(3)配置菌土
土壤采样后放入高压灭菌锅中进行灭菌,待土壤冷却后加入玉米丝黑穗菌粉配置成1%的菌土.
(4)播种与接种
选取200粒感病品种黄早4,将种子在4月20日播种于吉林省农业科学院所属的玉米试验田(公主岭),每穴2~3粒,将配置好的菌土覆盖在玉米种子上.
(5)取样
在玉米抽穗前期(此时病状并未表现出来)对玉米的根与叶片组织进行采样.
1.2 试验方法
1.2.1 DNA的提取方法(采用试剂盒提取,提取方法参照说明书)
将采集的每份玉米根与叶片的样品取适量置于研钵中用液氮充分的研磨,将研磨好的样品组织(不多于50 mg)分装于1.5 mL的离心管中,并分别做好标记.加入400μL LE Buffer,上下颠倒混合均匀,迅速置于65℃环境中温浴15~30 min(期间可震荡离心管2-3次),然后移出.然后向离心管中加入130 μL DA Buffer,充分混匀,在冰盒中放置5min,再放入Sigma微量台式离心机中14000 r离心3 min,待离心完成后用移液器吸取上层清液,将上清液转移至一个已灭菌的1.5 mL离心管中.加入750 μL的 E Binding Buffer(使用前已按说明加入了28 mL的无水乙醇),上下颠倒混匀后将混合液转移至Spin colum中,在高速离心机中6000 r离心1 min,并倒掉接液管中的液体,因为此时的混合液体积大于750 μL,所以需要分2次进行离心过柱.之后向Spin colum 中加入500 μL 的 G Binding Buffer,于10000r离心30s,并倒掉接液管中的液体.在Spin colum中加入600 μL的Wash Buffer(使用前已按说明加入了37.8 mL的无水乙醇).于10000 r离心30 s,倒掉接液管中的液体,再重复此步骤一次.然后将Spin colum转移至一个新的1.5 mL的离心管中,向其中加入100 μL的Elution Buffer,放于室温温浴1 min后,最后于离心机中12000 r离心1 min,并弃掉Spin colum,此1.5 mL的离心管中的液体含有所需DNA,置于-20℃环境中保存备用.
1.2.2 DNA纯度的检测
随机抽取已提取的样品DNA进行电泳检测,每个随机样品取5μL于1.5%的琼脂糖凝胶中进行电泳,电流 180mA,电压 180V,电泳15min,于凝胶成像系统中观察DNA的降解情况及是否有RNA的影响.
PCR检测:
(1)所使用的引物购买于上海生工生物公司,引物GSP的序列为
上游 5’-TCGCCGACGGATGATAATCG-3’下游5’-GAGTCACCCGCCCAAAGTTA - 3’
(2)反应程序:共设置35个循环,步骤如下:
94℃(预变性)4 min→94℃(变性)1 min→54℃(复性)1 min→72℃(延伸)1.5 min→72℃(延伸)5 min→4℃环境中保存备用
(3)1.5%琼脂糖凝胶电泳
用万分之一天平称取适量的琼脂糖,加入适量的已配置好的TAE溶液配制成1.5%凝胶,用微波炉将其沸腾一次后加入适量的EB,趁热倒入插好梳子的制胶槽中,待凝胶凝固后加入PCR的产物,10 μL的样品,并加入DNA Marker.
(4)电泳的结果在凝胶成像系统中进行观察和记录.
2 结果与分析
2.1 玉米丝黑穗冬孢子萌发情况的观察
从温箱中取出已培养3 d的玉米丝黑穗冬孢子,吸取适量的冬孢子滴于载玻片的中央,并滴几滴无菌水后盖上盖玻片,至于电子显微镜下观察其萌发状态.结果如下.
如图1所示为冬孢子萌发前的状态,在将其至于2%的葡萄糖溶液中,28℃黑暗培养3 d后,
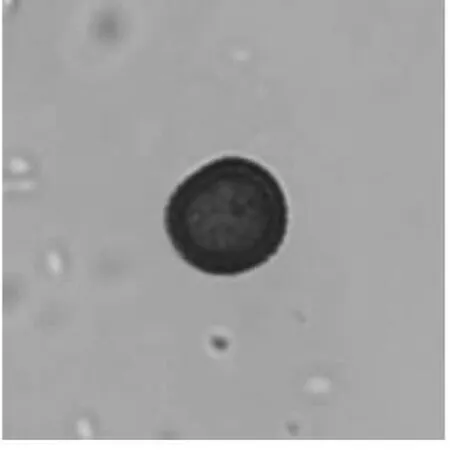
图1 冬孢子萌发前

图2 冬孢子萌发后
其萌发状态如图2所示.说明该丝黑穗冬孢子粉具有活性且能正常萌发,可以使用其对玉米进行侵染.
2.2 DNA的提取与检测
将采用试剂盒方法提取的DNA样品,经琼脂糖凝胶电泳检测,结果表明,用试剂盒所提取的样本组织的DNA可以获得高质量的DNA,可以用于后续的实验.结果如图3所示.

图3 DNA凝胶检测图谱
2.3 PCR结果检测
2.3.1 玉米叶片组织中丝黑穗病原菌的检测
如图4所示为带病玉米植株叶片组织DNA的电泳结果,其中 M 是 DNA Marker,1~10,13~22均为黄早4未发病叶片组织DNA,11、23均为水(CK),12、24均为玉米丝黑穗病菌的DNA.根据图4可知,以玉米叶片DNA为模板进行病菌PCR检测发现只扩增出了3条与玉米丝黑穗病菌在同一范围内的谱带,其中5号较为明显,14号、21号均不明显,病菌的检测效率仅为15%.

图4 琼脂糖凝胶电泳图谱(叶片)
2.3.2 以玉米根组织中丝黑穗病原菌的检测
如图5所示为带病玉米植株根组织DNA的电泳结果,其中 M 是 DNA Marker,1 ~10,13 ~22均为黄早4未发病根组织DNA,11、23为水(对照),12、24为玉米丝黑穗病菌的DNA.根据图4可知,以玉米叶片DNA为模板进行病菌PCR检测发现扩增出了16条与玉米丝黑穗病菌在同一范围内的谱带,仅有2号、3号、5号没有扩增出谱带,13号不太明显,病菌的检测效率为80%.

图5 琼脂糖凝胶电泳图谱(根)
3 结论与讨论
通过选用玉米感病品种黄早4抽穗前期的叶片和根组织的DNA进行提取,然后采用玉米丝黑穗病菌的特异性引物(GSP)进行PCR扩增检测.结果发现以叶片的DNA为模板进行PCR检测时,其检测效率仅仅为15%并不能对病苗是否带有玉米丝黑穗病菌进行有效的检测.而以根组织的DNA为模板进行PCR检测,发现其检测效率为80%,远远高于叶片DNA的检测效率.因此可以快速有效的对玉米幼苗在发病前期检测出植株是否感染了玉米丝黑穗病.
在PCR扩增的反应程序中将退火温度设置为54℃(根据引物GSP的特性设置了3个退火温度梯度,分别是53℃、54℃、55℃,其余条件均不变的情况下发现,当退火温度为54℃时凝胶电泳检测图谱最为清晰),35个循环时,以玉米丝黑穗病菌的特异性引物GSP对玉米丝黑穗病病苗中的病菌进行检测发现,其病菌的检测率达到80%,因此可以用于快速且有效的在玉米丝黑穗病的发病前期对丝黑穗病菌进行检测,提早进行防治,降低玉米丝黑穗病对玉米产量的影响.
在对玉米丝黑穗病进行PCR研究时,通常提取的是玉米下部组织的DNA而不采用玉米叶片组织的DNA.通过查阅相关的文献发现,玉米丝黑穗病属于幼苗期侵染的一种系统性的病害,丝黑穗的病原菌以散落在土壤中、混入到粪肥中或附着在玉米种子表面的冬孢子越冬,第二年成为主要的传染源,其中以土壤带菌侵染为主[3].病原菌于种子萌发开始从根茎、胚芽以及芽鞘侵染,并且在植株体内形成菌丝,跟随着植物向上生长.因此,在玉米植株的下部组织DNA中的病原菌浓度要远远大于上部组织DNA中的病原菌浓度,而叶片中的病原菌数量要低于茎髓组织和根部组织甚至是没有(如图4所示),因为病原菌菌丝是选择性的对植株的部位进行侵染的,若选择侵染叶片则不利于病原菌的繁殖[2].玉米丝黑穗是一种比较复杂的病害,目前对它的发病机制了解还不是很透彻,而针对玉米品种的抗性而言,目前尚无绝对的免疫品种,抗病与不抗病是相对的概念[6],只有做到早检测、早发现、早防治才能将玉米丝黑穗病的危害降到最低,才能保证玉米的产量.随着现代科学技术的不断发展,有关玉米分子遗传学和基因组学的研究领域也在不断向更深层面发展,随着人们对玉米丝黑穗病的探索和研究越来越深入,将会有助于推进玉米抗丝黑穗病育种取得新的研究进展[7].
[1] 李玥莹,董雪卉,许丽,等.玉米抗丝黑穗病基因RAPD分析[J].生物技术,2006(5):16-18.
[2] 邢跃先,吴凤新,蔡鑫茹,等.叶片DNA对玉米丝黑穗病研究的可靠性[J].玉米科学,2008(6):114-116.
[3] 晋齐名.东北地区玉米、大豆重要病虫害识别与防治.吉林:吉林科学技术出版社,2011.
[4] 白寿发,高增贵,张小飞.玉米丝黑穗病菌PCR检测[J].杂粮作物,2010(4):294-296.
[5] 李旭军,刘西莉,刘鹏飞.玉米丝黑穗冬孢子萌发影响因子[A].中国植物病理学会.中国植物病理学会2004年学术年会论文集[C].中国植物病理学会,2004.
[6] 邢跃先,檀国庆,李晓辉,等.玉米丝黑穗病侵染率与发病率关系的PCR检测分析[J].玉米科学,2007(6):111-113.
[7] 曹士亮.玉米抗丝黑穗病遗传育种研究进展[J].黑龙江农业科学,2009(6):157-160.

