基于QuEChERS提取的快速液相色谱-串联质谱法测定婴幼儿谷基辅助食品中的9种真菌毒素
胡文彦,许 磊,杨 军,凌 睿
(南京市产品质量监督检验院,江苏 南京 210000)
真菌毒素(mycotoxin)也称霉菌毒素,是霉菌等真菌在其所污染的食品中产生的有毒的次生代谢产物,可广泛污染农作物、食品及饲料等植物源性产品。目前发现大约300~400种有毒的真菌次生代谢产物,其结构多样,物理化学性质也千变万化[1]。在这些代谢物中,黄曲霉毒素类(AFs)、赭曲霉毒素类(OTs)、伏马毒素类(FBs)、脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮以及T-2毒素对经济及人们的健康危害尤为巨大[2]。超过一定摄入量后会损坏人的肝肾功能、致癌、致畸并诱发免疫抑制性疾病[3]。
婴幼儿时期是人生长发育的关键时期。婴幼儿谷基辅助食品作为6个月以上婴儿食物重要的组成部分,安全问题不容忽视。婴幼儿谷基辅助食品含有至少25%(质量分数)以上的谷物原料,如果企业对原料质量控制不够严格,就有可能导致最终产品被真菌毒素污染,威胁婴幼儿的身体健康。
食品中真菌毒素的检测方法主要有酶联免疫法(ELISA)[4]、薄层色谱法 (TLC)[5]、气相色谱法(GC)[6]及液相色谱法(LC)[7]等。近年来,液相色谱-串联质谱技术(LC-MS/MS)在检测毒素方面的优势逐渐显现[8-10]。采用选择离子监测技术,可大大提高检测的灵敏度和特异性,因此可以采用比传统方法更为简便的前处理技术,且不需要做柱后衍生化,是同时检测多种毒素的理想方法。本实验室采用基于QuEChERS原理的快速提取方法,结合快速液相色谱-串联质谱技术建立了婴幼儿辅助谷基食品中多种真菌毒素的快速测定方法。该方法简便快速,可操作性强,免去繁琐的SPE净化步骤,只需一步提取浓缩就可以准确筛查婴幼儿谷基辅助食品中的多种真菌毒素。采用建立的方法对市面上销售的部分婴幼儿谷基类食品进行了筛查,获得了较为翔实的数据,为企业及食品安全监管部门提供了有效的技术支撑。
1 实验部分
1.1 仪器、试剂与材料
1200-RRLC-6460 QQQ MS/MS串联四极杆质谱仪,配电喷雾离子源(ESI),MasshunterB06.00质谱工作站(美国Agilent公司);3-18K冷冻离心机(美国Sigma公司);十万分之一电子天平(瑞士梅特勒公司);24位氮吹仪(美国Organomation公司)。
黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素 B2(aflatoxin B2,AFB2)、黄曲霉毒素 G1(aflatoxin G1,AFG1)、黄曲霉毒素G2(aflatoxin G2,AFG2)、赭曲霉毒素A(ochratoxin A,OTA)、玉米赤霉烯酮(zearalenone,ZEA)、T-2毒素(T-2 toxin,T2)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、伏马毒素B1(fumonisin B1,FB1)标准品均购自美国Enzo Biochem公司。
乙腈、甲醇(色谱纯,美国ROE公司);无水硫酸镁(使用前在450℃烘烤2 h,冷却后备用)、氯化钠、冰乙酸、乙酸铵(分析纯,国药集团化学试剂有限公司);甲酸(纯度≥98.0%,德国CNW公司);试验用水为经Milli-Q(0.22 μm过滤膜)净化系统(美国Millipore公司)过滤的超纯水。
样品:购自南京本地超市和网络购物平台,涉及9个品牌,41个批次。其中饼干2批,面条3批,其余均为配方米粉。
1.2 样品提取
称取2 g均质后的试样(精确至0.01 g),置于50 mL具塞离心管中;加入含1%(v/v)乙酸的乙腈/水(85∶15,v/v)提取液20 mL,超声提取 10 min后,再加入2 g无水硫酸镁和0.5 g氯化钠;涡旋振荡2 min,以8000 r/min离心10 min,取上层溶液于50℃下氮吹至干,快速加入55%(v/v)乙腈水溶液1 mL,混匀后过0.22 μm微孔滤膜,供液相色谱-串联质谱仪测定。
按照上述方法测试后的样品,如果未检测到9种真菌毒素将作为空白样品用于回收率试验和制备基质校正溶液。在进行加标试验时,取适量稀释后的标准溶液加入到空白样品中,充分混合后进行后续处理。
1.3 标准溶液的配制
标准储备溶液:分别准确称取适量 AFB1、AFB2、AFG1、AFG2、OTA、ZEA、T2、DON、FB1 标准品于100 mL棕色容量瓶中,用甲醇溶解并定容至刻度,配制成100 mg/L的标准储备溶液,-18℃下避光保存备用。
基质混合标准工作溶液:用空白样品提取液将标准储备溶液配制成适当浓度的基质混合标准工作溶液,基质混合标准工作溶液应现配现用。
1.4 仪器条件
色谱柱为Agilent XDB C18(50 mm×2.1 mm,1.8 μm);柱温为30 ℃;进样体积为2 μL;流动相A为2 mmol/L乙酸铵(含0.1%(v/v)甲酸),流动相B为乙腈;梯度洗脱条件为A在2 min内由45%降至5%,保持3 min后在0.1 min内升至45%,保持2.4 min;流速0.25 mL/min;总运行时间7.5 min。
质谱条件:毛细管电压4000 V;干燥气温度320℃;干燥气流速9.0 L/min;雾化气压力0.276 MPa(40 psi);其余参数通过仪器自动调谐至最优。电离模式:ESI(+);多反应监测(MRM);MRM参数见表1。
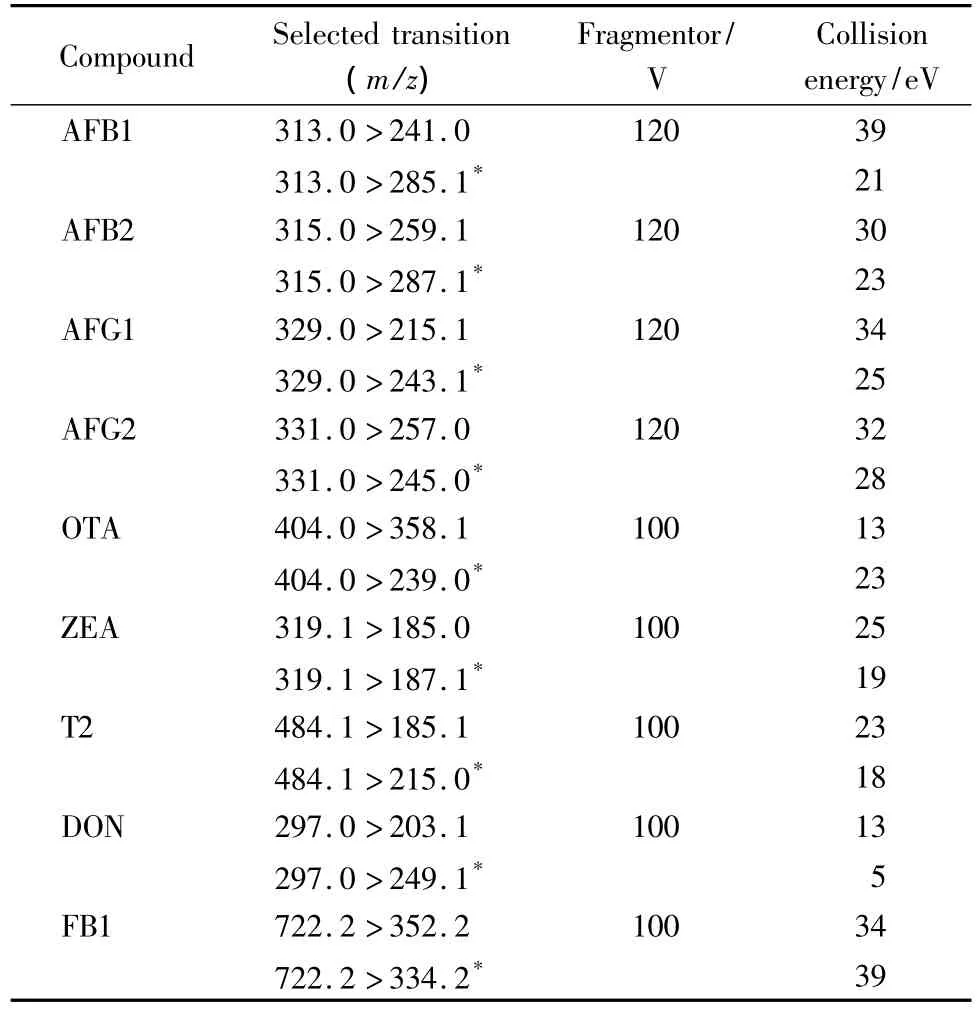
表1 9种真菌毒素的串联质谱检测参数Table 1 MS/MS parameters of the nine mycotoxins
2 结果与讨论
2.1 提取过程的优化
建立多种不同物理化学性质真菌毒素的同时检测方法难度很大,特别是婴幼儿谷基辅助食品作为一种婴幼儿食用的特殊膳食食品一般都添加了大量的营养素和辅料,选择一种合适的前处理方法非常重要。QuEChERS(quick,easy,cheap,rugged,safe)提取方法最早主要用于农残测试[11],由于其具备简便、快速等优点,近年来逐渐广泛运用于各种检测领域,其中也包括真菌毒素的分析[12-14]。在QuEChERS提取方法中,加入无水硫酸镁和氯化钠能产生盐析效应,降低基质中亲水性成分的溶解度,从而提高了提取效率。同时,盐析效应降低了提取液中的水分含量,使得后续的去溶剂步骤更加快速,节约了实验时间。传统的QuEChERS方法中,除了加入混合盐,通常还要加入C18、乙二胺-N-丙基甲硅烷(PSA)等吸附剂来吸附色素或油脂。而在婴幼儿谷基食物中这类杂质较少,且前期实验表明加入吸附剂会造成部分目标物的损失。本文对影响提取效果的这些因素进行了系统的优化。
首先是提取溶剂的选择。依次考察了甲醇、乙腈以及不同比例的甲醇-水混合溶液、乙腈-水混合溶液,发现当水溶液中乙腈的体积分数达到80%~85%时,提取效率最高,这和已有报道[15]基本一致。体系中有机相含量高有利于缩短氮吹步骤所耗的时间。
此外,多数真菌毒素是偏酸性的化合物,理论上在碱性溶剂中的提取效率较高,但是其在碱性溶剂中稳定性变差[16]。调节提取试剂的pH值为3、6、9,按照1.2节的方法对加标的空白样品进行提取,比较pH值对提取效率的影响。从图1可以看出,当提取溶剂的pH值为3时各目标物的提取效率最高,pH值对DON、ZEA、OTA 3种化合物的提取率影响最大。因此采用含1%(v/v)乙酸的乙腈/水(85∶15,v/v)(pH 3)作为提取溶剂,能够兼顾绝大多数目标物的提取效果。
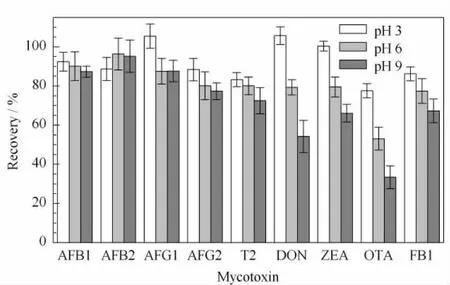
图1 提取溶剂的pH值对空白加标样品中真菌毒素提取效率的影响(n=3)Fig.1 Effect of pH value of solvent on the extraction recoveries of mycotoxins spiked in blank samples(n=3)
在提取方式上,考察了机械振荡、超声提取和匀浆提取3种常用的提取方法。结果表明,超声提取10 min时效率较高,且操作简便。
由于婴幼儿米粉中干扰物质较多,因此尝试通过增加SPE净化步骤来优化提取过程。考虑到待测物的化学性质,选择实验室常用的C18和HLB(亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮两种单体按一定比例聚合成的大孔共聚物)填料对提取效率进行考察。将加标的空白米粉按照1.2节规定的方法提取,将上层溶液于50℃下氮气吹干后,加入2 mL水溶解残渣,分别用上述两种材料的SPE柱进行净化。由图2可以看出,SPE净化后的回收率均低于只用溶剂提取的回收率,特别是极性较大的脱氧雪腐镰刀烯醇经过SPE净化后损失较多,回收率偏低。
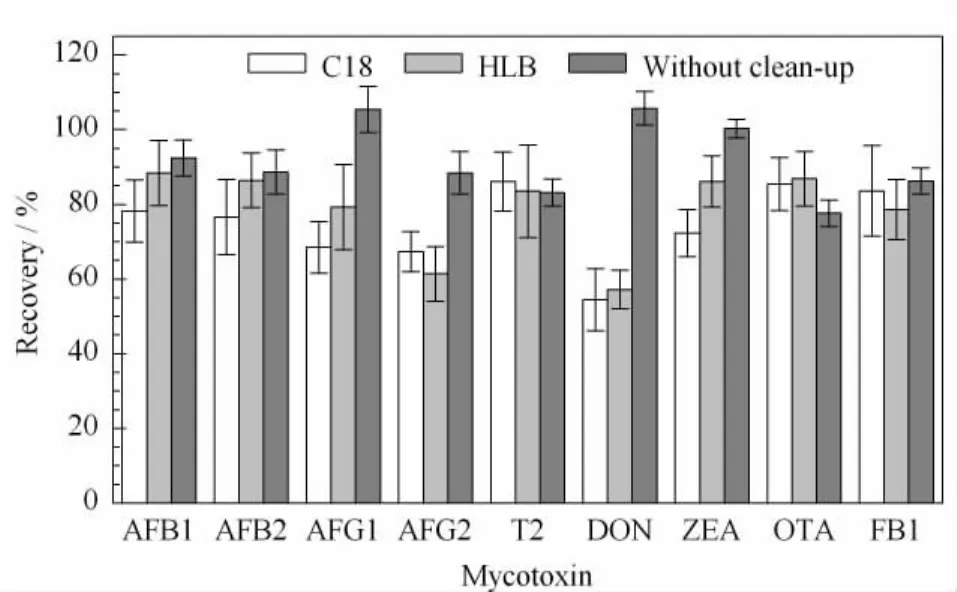
图2 SPE净化过程对真菌毒素回收率的影响(n=3)Fig.2 Effect of the SPE clean-up step on the recoveries of the mycotoxins(n=3)
进而比较了采用HLB填料的SPE柱净化前后待测液的基质效应(matrix effect,ME),以考察SPE净化步骤的必要性。基质效应通过对每个待测物的基质增强或抑制效应进行评价。具体计算公式为ME=Rm/Rs×100%,其中Rm为目标化合物在空白加标样品基质溶液中的响应值,Rs为目标化合物在初始流动相溶液中的响应值。我们通过以上方式对SPE净化前后的两种基质溶液进行了比较,结果见图3。SPE净化前后的溶液均产生一定程度的基质抑制效应,SPE净化后的溶液比未净化的基质抑制程度相当或稍小,但不甚明显,特别是黄曲霉毒素G1、G2、伏马毒素B1及赭曲霉毒素A净化前后溶液的基质效应几乎相同。从提取效率和基质效应两方面的实验结果看,SPE净化并不能进一步改善检测结果,且增加成本,因此最终选择不经SPE净化的较为简单的样品前处理方法。
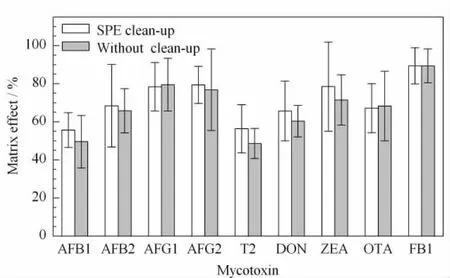
图3 SPE净化过程对毒素基质效应的影响(n=3)Fig.3 Effect of SPE clean-up step on matrix effect of mycotoxins(n=3)
2.2 仪器条件的优化
在对流动相进行优化时,首先比较了甲醇-水和乙腈-水两种体系,发现绝大多数化合物在乙腈-水体系中的响应较高,特别是AFG1、AFG2、T2等3种毒素区别显著。我们同时发现在水相中加入乙酸铵后,各物质的响应值都有一定程度的提升,特别是T-2毒素加氨根的峰强度显著增加,离子化效率明显提高。而加入0.1%(v/v)的甲酸可提高待测物在正离子电喷雾离子源中的离子化效率,提高灵敏度。进一步考察了不同乙酸铵浓度对目标化合物离子化程度的影响,结果表明适当降低乙酸铵的浓度可以提高目标化合物的离子化效率,当乙酸铵浓度为2 mmoL/L时,目标化合物响应值明显增大。因此,最终选用2 mmoL/L乙酸铵(含0.1%(v/v)甲酸)和乙腈作为流动相。由于分析物较多,基质比较复杂,因此采用梯度洗脱进行分析,不仅能缩短出峰时间,还能有效地去除色谱柱中残留的杂质。
在优化质谱采集离子等参数的过程中,同时考察了9种毒素在正、负离子模式下的响应值,发现所有目标物都在正离子模式下响应较好。表1中列出了所有目标物的质谱采集离子信息。除T2毒素的母离子为[M+NH4]+外,绝大多数化合物在选定的分析条件下都产生[M+H]+母离子,在MRM分析中我们选择离子丰度最高的子离子作为定量离子,选择丰度次高的子离子作为定性离子,尽量不选择质荷比在100以下的离子,以免流动相中的低分子量杂质对检测造成影响。
在色谱柱的选择上,我们考察了C18反相填料的3根不同型号的色谱柱,分别是Thermo Hypersil GOLD(100 mm ×2.1 mm,5 μm)、Agilent Proshell 120 EC-C18(50 mm ×4.6 mm,2.7 μm)以及 Agilent XDB C18(50 mm ×2.1 mm,1.8 μm)。从色谱行为看,Agilent XDB C18更加适合于分析这9种真菌毒素,该柱内径和填料粒径均较小,能够获得良好的分离度。最终选择的优化条件见1.4节,在此条件下,除了伏马毒素和玉米赤霉烯酮保留时间较为接近外,其他化合物均能得到基线分离(见图4)。
2.3 校正曲线
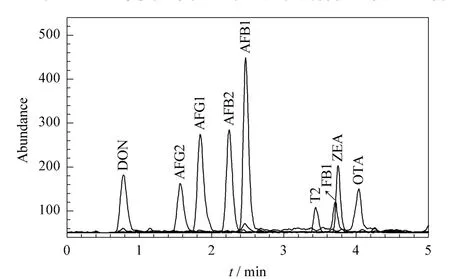
图4 空白米粉加标样品(加标量约为40 μg/kg)经RRLC-MS/MS分析的色谱图Fig.4 RRLC-MS/MS chromatogram obtained from a blank ground rice spiked at about 40 μg/kg
使用ESI离子源做分析时,要消除基质效应除了采用合适的前处理方法外,使用内标物或基质外标法校正[17]是目前液相色谱-质谱分析的主流手段。对于本次分析来说,要想获取所有目标物的同位素内标难度很大,即使能够获取,检测成本也会大幅提升。由于所分析各物质的化学性质差异较大,也很难找到一种或几种化学结构类似的物质作为内标物。而对于婴幼儿米粉来说,空白的基质溶液相对比较容易获取。因此,综合上述原因,我们最终采用了基质空白加标的方法进行目标物的分析,取得了良好的效果。
具体做法为:将经过测试不含待测物的空白样品按照本方法规定的条件进行处理,用获取的空白基质溶液溶解不同质量的标准品,获得系列浓度的基质加标溶液。将此溶液上机测试,利用安捷伦Masshunter工作站进行积分,以质量浓度(X,μg/L)对峰面积(Y)绘制校正曲线,回归方程见表2。
2.4 方法学验证
通过计算各目标物在空白基质中信噪比(S/N)为3时对应的含量来获得检出限(LOD),而定量限(LOQ)则为10倍信噪比对应的含量。通过在空白样品中分别添加3个不同水平的待测目标物,平行测定6次,计算回收率和相对标准偏差(RSD),结果见表2。9种真菌毒素的LOD为0.1~15.8 μg/kg,LOQ为0.3~47.5 μg/kg,完全符合国家标准对真菌毒素限量检测要求[18]。各待测物在实际测试中可能涉及的浓度范围内线性关系良好,在约1倍、2倍及10倍定量限的添加水平下加标回收率结果令人满意,各添加浓度的回收率为77.6%~109.6%,RSD在2.5% ~15.7%之间。
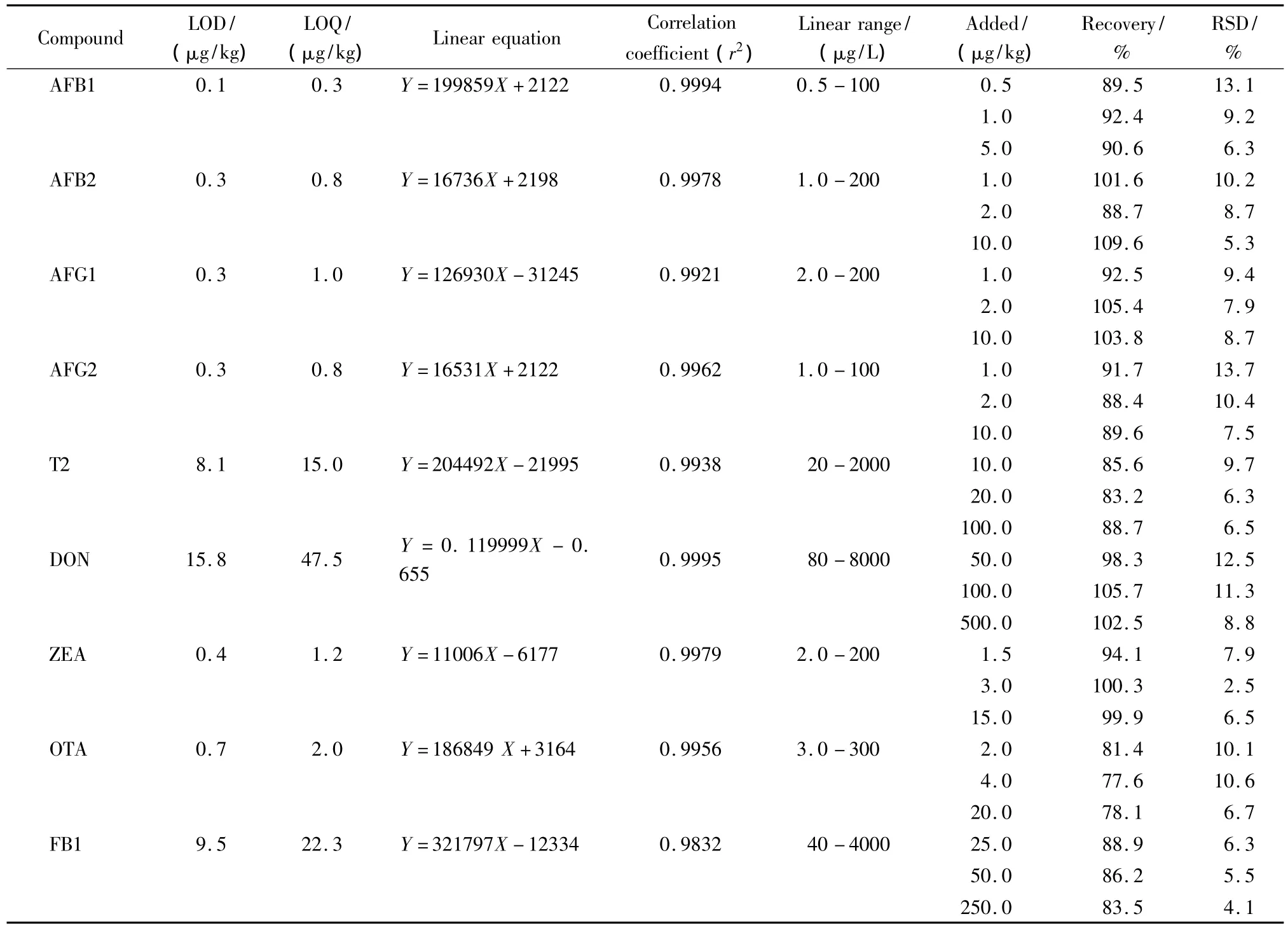
表2 方法的灵敏度、线性关系及回收率(n=6)Table 2 Sensitivities,linearships and recoveries of the developed method(n=6)
2.5 实际样品测试
采用建立的方法随机测定了国内市场41批婴幼儿谷基食品中的9种真菌毒素的残留量。结果8个样品中检出不同浓度水平的脱氧雪腐镰刀菌烯醇,含量从 21.13 μg/kg 至 184.22 μg/kg 不等,均未超过国家标准规定的限量要求[18];共2个样品中检出玉米赤霉烯酮,含量分别为35.32 μg/kg及78.55 μg/kg,后者已经超出国家标准规定的限量,属于不合格产品;除此以外的其余毒素均未检出。由于DON和ZEA热稳定性较好,不易分解,即使经过加热等生产加工过程仍有可能残留于最终产品中。质量监督部门应及时对市场上销售的各种婴幼儿谷基辅助食品产品进行筛查,指导生产企业从源头上控制产品的质量,保障婴幼儿的身体健康。
3 结论
本文建立了一种基于QuEChERS原理的前处理技术,结合液相色谱-串联质谱快速测定婴幼儿谷基辅助食品中黄曲霉毒素B1等9种真菌毒素的方法。在前处理条件考察过程中,优化了提取溶剂、提取方式等关键因素;通过比较SPE净化前后目标物的提取效率及基质效应,验证了QuEChERS提取方案的有效性。通过优化液相色谱与质谱的采集参数,得到了最佳的仪器检测条件。方法学考察及实际样品检测证明,该方法具有简便、快速、经济、准确、实用性强等优点,可作为婴幼儿谷基辅助食品中真菌毒素的快速检测方案推广应用。
[1]Hussein H S,Brasel J M.Toxicology,2001,167:101
[2]Bennett J W,Klich M.Clin Microbiol Rev,2003,16:497
[3]Tchana N A,Moundipa P F,Tchouanguep F M.Int J Environ Res,2010,7:178
[4]Liang D S,Li J S.Modern Food Science and Technology(梁迪思,李建生.现代食品科技),2010,26(12):1421
[5]GB 5009.24-2010
[6]Hu N,Xu L.Food Science(胡娜,徐玲.食品科学),2007,28(8):563
[7]Xie G,Wang X S,Zhang Y.Journal of Instrumental Analysis(谢刚,王雪松,张艳.分析测试学报),2011,30(12):1362
[8]Li L P,Fan S,Zhao R,et al.Chinese Journal of Chromatography(李丽萍,范赛,赵榕,等.色谱),2013,31(7):703
[9]Huang J,Chen G S,Zhang X Y,et al.Chinese Journal of Chromatography(黄娟,陈国松,张晓燕,等.色谱),2012,30(11):1203
[10]Han S,Wang P Y,Liu Y,et al.Chinese Journal of Chromatography(韩深,王珮玥,刘萤,等.色谱),2013,31(10):939
[11]Anastassiades M,Lehotay S,Stajnbaher D,et al.J AOAC Int,2003,86:412
[12]Lukas V,Milena Z,Vojtech H,et al.Talanta,2010,82:1950
[13]Yelko R C,Houda B.J Chromatogr A,2012,1270:28
[14]Rasmussen R R,Storm I M L D,Rasmussen P H,et al.Anal Bioanal Chem,2010,397(2):765
[15]Ren Y P,Zhang Y,Shao S L,et al.J Chromatogr A,2007,1143:48
[16]Ferreira I,Fernandes J O,Cunha S C.Food Control,2012,27:188
[17]Matuszewski B K,Constanzer M L,Chavez-Eng C M.Anal Chem,2003,75:3019
[18]GB 2761-2011

