液相色谱-串联质谱法同时测定棉花中乙烯利、噻苯隆和敌草隆药物的残留量
谢 文,史颖珠,侯建波,黄超群,赵 栋,潘璐璐,董锁拽
(1.浙江出入境检验检疫局技术中心,浙江 杭州 310016;2.浙江立德产品技术有限公司,浙江 杭州 310016;3.浙江出入境检验检疫局丝类检测中心,浙江 杭州 310012)
随着人们生活水平的提高和消费观念的改变,对服装及纺织用品的安全和健康性能要求也不断地提高。作为纺织品的最初原材料,棉花生长的不同阶段均需要使用农药以预防病虫害和杂草生长,以提高棉花纤维的产量和质量。文献[1,2]研究发现,乙烯利、噻苯隆和敌草隆可促使棉花叶片脱落,有利于机械化采收,且棉絮上不带有枯叶碎片,明显提高棉花质量。
尽管纺织品在加工生产过程中会除去大部分农药,但仍有部分农药残留,其与人体皮肤接触过程中被人体吸收会对人体产生毒副作用,重者会诱发癌症[3];另外在纺织工业领域棉花中的农药残留会污染水质和土壤。因此我国早在2002年即发布GB/T 18885-2002《生态纺织品技术要求》并已更新至2009版,其中与棉花生产直接有关的有54种农药(包括杀虫剂、除草剂、脱叶剂),其要求在婴幼儿用品上农药残留量总和不得超过0.5 mg/kg,在成年人用品上不得超过1.0 mg/kg[4]。GB/T 22282-2008《纺织纤维中有害物质的限量》中规定棉和其他天然纤维素种子纤维中杀虫剂总量不得超过0.05 mg/kg,其中包括19种农药[5]。但是对于皮棉中农药残留限量的国家标准目前尚未发布。
已有文献[6,7]报道用高效液相色谱法(HPLC)测定棉花中的噻苯隆,方法定量限(LOQ)为0.01~0.5 mg/kg。郭永泽等[8]和蔡德玲等[9]采用气相色谱-氮磷检测器(GC-NPD)测定棉籽中敌草隆的残留量,方法的检出限为0.05 mg/kg,回收率为80.56%~94.14%,平立凤等[10]采用超高效液相色谱法(UPLC)测定了甘蔗和土壤中敌草隆的残留量,方法的检出限分别为 5 μg/kg和 10 μg/kg。吴刚等[11]采用加速溶剂萃取-超高效液相色谱-串联质谱法(ASE-UPLC-MS/MS)测定棉花中残留的8种脱叶剂,该方法在前处理过程中引入加速溶剂萃取,采用正离子模式进行测定,但该方法不能同时测定乙烯利。目前未见棉花和纺织品中乙烯利残留量检测的文献报道。食品中乙烯利残留量的检测一般利用乙烯利在碱性水溶液中受热能够快速分解成乙烯的特性,孔祥虹等[12]在样品中加入适量的浓碱液,并在70℃下恒温加热,采用顶空气相色谱法测定,方法的定量限为0.01 mg/kg。随着高效液相色谱-串联质谱(LC-MS/MS)技术发展的日趋成熟,该方法被越来越多地应用于测定和确证纺织品和食品中的农药残留,吴凤琪等[13]采用HPLC-MS/MS测定水果中的乙烯利,但未同时测定噻苯隆和敌草隆,其流动相中使用了20 mmol/L醋酸盐缓冲溶液,该溶液易产生絮状沉淀,堵塞流动相滤头。目前尚未见同时检测棉花和植物性样品中乙烯利、噻苯隆和敌草隆的LC-MS/MS的相关报道。本研究采用甲醇-水溶液振荡提取,利用LC-MS/MS的选择性和抗干扰能力较强的特点,建立了同时检测棉花中乙烯利、噻苯隆和敌草隆的LC-MS/MS方法,避免了常规分析用2~3个方法分别测定上述3种农药,所建立的方法简便、稳定,完全满足国内外有关法规对棉花中农药残留检测的要求,可为进口棉花农药残留的监管提供技术支持。
1 实验部分
1.1 仪器、试剂与材料
API 4000Q液相色谱-串联质谱仪:配有电喷雾离子源和大气压化学源(美国AB公司);电子天平:感量0.1 mg、0.01 g(瑞士梅特勒公司);Legend Mach 1.6R高速冷冻离心机(美国热电公司)。
甲醇、乙腈、甲酸为色谱纯(美国Tedia公司);氢氧化钠为分析纯。实验用水为Milli-Q高纯水。
乙烯利(ethephon)、噻苯隆(thidiazuron)、敌草隆(diuron)标准品购自德国Dr.Ehrenstorfer公司,纯度大于99%。标准溶液:用甲醇将标准品配制为100 mg/L的标准储备液,于4℃下避光保存。根据需要用甲醇-水(6∶4,v/v,pH=8)溶液稀释至适当浓度的标准工作液。
1.2 实验步骤
称取均匀样品1 g(精确至0.01 g),置于50 mL具塞离心管中,加入20 mL甲醇-水(6∶4,v/v;用5 mol/L氢氧化钠溶液调节 pH=8),振摇提取20 min,以6000 r/min速率离心5 min,取上清液过0.22 μm有机滤膜,供液相色谱-串联质谱测定。
1.3 仪器条件
Agilent ZORBAX Eclipse XDB-C8色谱柱(150 mm ×4.6 mm,5 μm);流动相:甲醇-水(6∶4,v/v);流速:0.4 mL/min;进样量:20 μL;柱温:20℃。
电喷雾离子源(ESI),负离子模式扫描;质谱扫描方式:多反应监测(MRM);电喷雾电压:-4500 V;雾化气压力(GS1):0.289 MPa;气帘气压力(CUR):0.172 MPa;辅助气压力(GS2):0.31 MPa;离子源温度(TEM):525℃;碰撞气(CAD):5;定性离子对、定量离子对、去簇电压及碰撞气能量见表1。
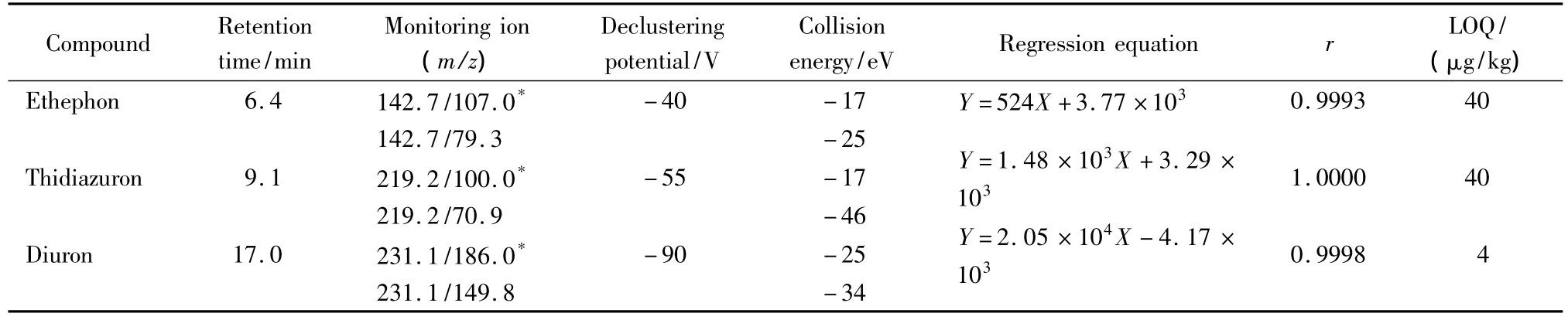
表1 乙烯利、噻苯隆和敌草隆农药的质谱参数、回归方程、相关系数和方法定量限Table 1 Mass parameters,regression equations,correlation coefficients(r)and LOQ of ethephon,thidiazuron and diuron
2 结果与讨论
2.1 质谱条件的优化
分别取5 mg/L乙烯利、噻苯隆和敌草隆农药单标准溶液,采用流动注射的方式以10 μL/min的流速将单标准溶液注入离子源。根据化合物的质谱行为,确定选择负离子扫描。分别在负离子模式下进行乙烯利、噻苯隆和敌草隆标准溶液母离子全扫描,再对其子离子进行全扫描,选择信噪比高、峰形好、干扰小的离子对作为定量离子对,优化去簇电压、碰撞能量。依次对电喷雾电压、雾化气压力、气帘气压力、辅助气流速、离子源温度、碰撞气,使分子离子与特征碎片离子强度达到最大。本文选择各化合物监测的定性离子、定量离子可以满足2002/657/EC对质谱确证方法的要求。乙烯利、噻苯隆和敌草隆的子离子全扫描质谱图见图1。
2.2 稀释溶液和流动相的优化
将乙烯利、噻苯隆和敌草隆混合标准溶液分别用甲醇、乙腈稀释,进行LC-MS/MS分析,谱图显示,相同浓度下乙烯利以乙腈为溶剂的峰形响应低、峰宽、拖尾;因此,实验用不同体积比的甲醇-水配制10 μg/L的混合标准溶液,分别进样分析,结果显示甲醇-水体积比为 4∶6、5∶5、6∶4、7∶3 时的色谱峰峰形均较好,同时流动相为甲醇-水(6∶4,v/v)时3个待测化合物的色谱分离较好,满足测试要求。考虑到定容溶剂与流动相对待测物质的峰形、分离度和灵敏度有很大影响,故选择甲醇-水(6∶4,v/v)作为标准品的稀释溶液。
同时考察了甲醇-水(6∶4,v/v)的pH分别为6(用磷酸调节)、7、8(用5 mol/L氢氧化钠溶液调节)的条件下目标化合物的色谱峰峰形及信号强度。结果表明pH 8的条件下目标化合物的峰形最好、信号最强。故本方法选择pH 8的甲醇-水(6∶4,v/v)作为标准工作溶液的定容溶剂。
2.3 样品提取剂的优化
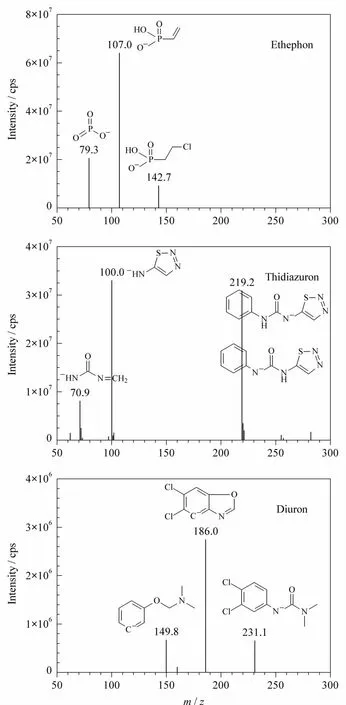
图1 乙烯利、噻苯隆和敌草隆的子离子全扫描质谱图Fig.1 Full scan product ion spectra of ethephon,thidiazuron and diuron
文献[2-5,7]采用丙酮、甲醇或乙腈等作为土壤和植物样品中敌草隆、乙烯利和噻苯隆的提取溶剂。考虑到已优化的定容溶剂,本文分别用甲醇、丙酮、乙腈、甲醇-水(6∶4,v/v)(pH 8)为溶剂进行了提取剂的优化。结果显示,用甲醇、丙酮直接提取棉花中农药残留的回收率均小于50.7%;用乙腈提取棉花样品未测定到乙烯利,噻苯隆和敌草隆的回收率也小于39.8%;用甲醇-水(6∶4,v/v)(pH 8)作为提取溶剂,3种化合物的添加回收率为75.6% ~118%。因此选择用甲醇-水(6∶4,v/v)(pH 8)作为提取溶剂。
2.4 提取方法的选择和提取时间的确定
采用pH 8的甲醇-水(6∶4,v/v)对阳性棉花样品中乙烯利、敌草隆和噻苯隆的提取效果进行考察,比较超声波提取仪和振荡器的提取效果,提取时间均为20 min,结果见图2。可见敌草隆和噻苯隆超声/振摇提取的结果分别为2140/2990 μg/kg和2.29/7.41 μg/kg,具有显著差异,乙烯利对两种提取方法无差异,因此本方法采用振摇提取。
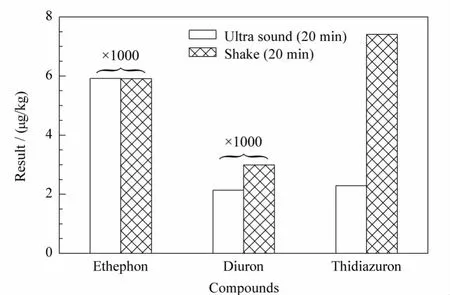
图2 不同提取方法对提取效率的影响Fig.2 Effect of extracted method on the extraction efficiency
用pH 8的甲醇-水(6∶4,v/v)对乙烯利、敌草隆和噻苯隆阳性棉花样品分别振摇提取10、20、30 min,结果见图3,表明随着振摇时间的延长,测得棉花中乙烯利含量由20 min的5910 μg/kg降低到30 min的1100 μg/kg,敌草隆和噻苯隆在样品中的含量也有所降低,故将振荡提取时间定为20 min。
2.5 样品基质效应
LC-MS/MS测定药物残留时,有时基质对离子对具有增强或抑制效应。本文制备了空白棉花样品基质标准工作溶液,将其与用溶剂稀释的混合标准工作溶液分别进样,并对添加水平乙烯利、敌草隆为40 μg/kg,噻苯隆为 4 μg/kg 的样品进行测试,结果见表2。该结果显示样品基质对待测农药的离子对的抑制效应很小,可忽略不计。
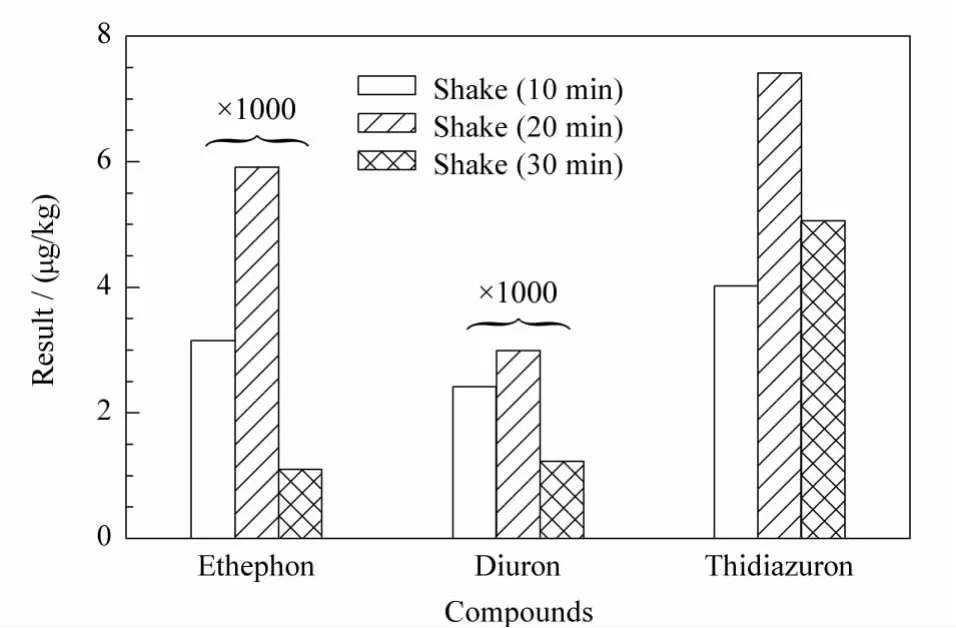
图3 提取时间对提取效率的影响Fig.3 Effect of extracted time on the extraction efficiency
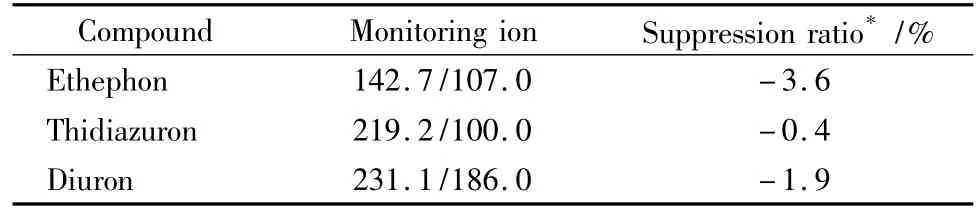
表2 棉花对乙烯利、敌草隆和噻苯隆农药离子化的基质效应Table 2 Matrix effect of cotton on the ion intensities of ethephon,diuron and thidiazuron pesticides
2.6 方法的标准曲线、线性范围、相关系数、检出限、回收率和精密度
采用甲醇-水(6∶4,v/v,pH 8)配制乙烯利、敌草隆和噻苯隆混合标准溶液,乙烯利、敌草隆的质量浓度为 0、2.0、4.0、8.0、10.0 μg/L,噻苯隆的质量浓度为 0、0.2、0.4、0.8、1 μg/L,对 5 点系列浓度混合标准溶液进行测定,分别以3种化合物的峰面积对质量浓度作图,得到各化合物的标准工作曲线。结果显示,在所测定的质量浓度范围内标准工作曲线具有良好的线性,相关系数(r)均大于0.999(见表1)。仪器定量限为10倍信噪比(S/N)时的浓度,表1中的方法定量限是通过仪器定量限和方法回收率计算得到的。
在不含3种待测组分的棉花样品中进行农药的添加回收试验,乙烯利、敌草隆的添加水平均为40、80和 160 μg/kg,噻苯隆添加水平为 4、8和 16 μg/kg,每个添加水平平行测定6次,由表3可见,方法的平均回收率为89.4% ~100.2%;方法的平均相对标准偏差(RSD)为5.7% ~11.5%。空白样品中添加乙烯利、敌草隆和噻苯隆混合标准溶液的HPLC-MS/MS选择离子流图见图4。
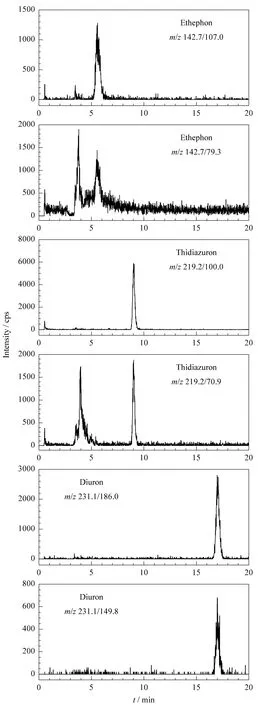
图4 添加乙烯利、噻苯隆、敌草隆混合标准溶液(乙烯利、敌草隆 40 μg/kg,噻苯隆 4 μg/kg)的空白棉花样品的选择性离子流图Fig.4 Selected ion chromatograms of a blank cotton sample spiked with ethephon,thidiazuron and diuron standard solution(40 μg/kg for ethephon and diuron,4 μg/kg for thidiazuron)
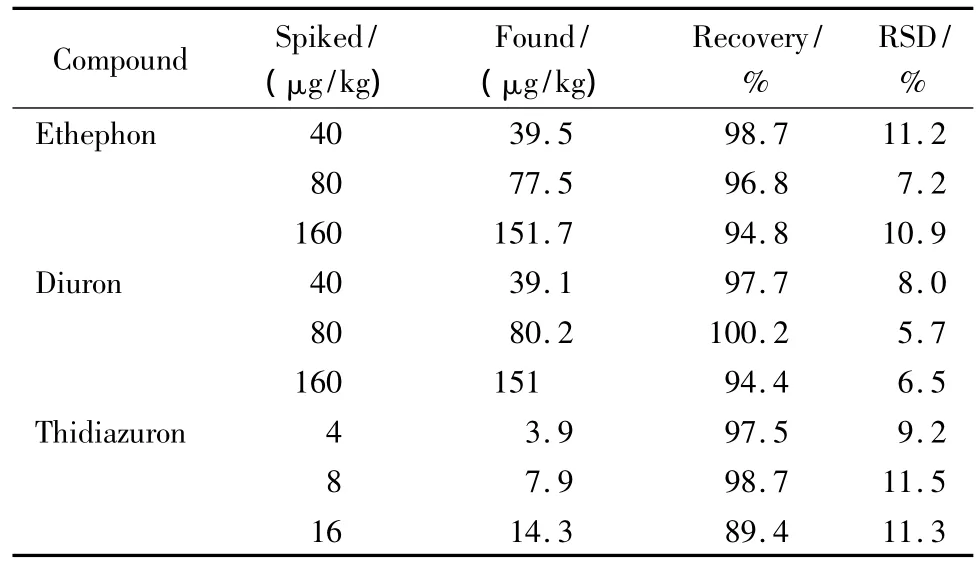
表3 空白棉花中乙烯利、敌草隆和噻苯隆的添加回收率及精密度(n=6)Table 3 Recoveries and accuracies of ethephon,diuron and thidiazuron spiked in blank cotton(n=6)
3 结论
本研究建立了采用液相色谱-串联质谱同时测定棉花中乙烯利、噻苯隆和敌草隆的方法,乙烯利和敌草隆的 LOQ 均为40 μg/kg,噻苯隆为4 μg/kg,回收率和精密度均符合残留分析要求,灵敏度满足国内外对棉花中上述化合物残留限量的要求,该方法不仅适合棉花基质的检测,也为食品等其他基质中乙烯利、噻苯隆和敌草隆的残留测定提供了参考。
[1]Liu J T,Wang X F,Wang B J,et al.Crops(刘京涛,王秀芳,王滨杰,等.作物杂志),2012(4):141
[2]Cao Y,Yan Y P,Feng Z X,et al.Crops(曹阳,严玉萍,冯振秀.作物杂志),2012(4):144
[3]Yang W H,Xu H X,Wang Y Q,et al.Agricultural Quality and Standards(杨伟华,许红霞,王延琴,等.农产品质量与安全),2010(6):49
[4]GB/T 18885-2002
[5]GB/T 22282-2008
[6]Sun J,Zeng R,Zhao R F,et al.Standard Science(孙近,曾蓉,赵瑞方,等.标准科学),2010(9):30
[7]Guo Y Z,Zhang Y T,Song S R,et al.Pesticides(郭永泽,张玉婷,宋淑荣,等.农药),2005,44(3):123
[8]Guo Y Z,Zhang Y T,Liu L,et al.Tianjin Agricultural Sciences(郭永泽,张玉婷,刘磊,等.天津农业科学),2010,16(3):69
[9]Cai D L,Chen J X,Chen L H,et al.Modern Agrochemicals(蔡德玲,陈九星,陈力华,等.现代农药),2009,8(5):40
[10]Ping L F,Li Z,Zhao H,et al.Journal of Analytical Science(平立凤,李振,赵华,等.分析科学学报),2011,27(2):235
[11]Wu G,Dong S Z,Pan L L,et al.Chinese Journal of Chromatography(吴刚,董锁拽,潘璐璐,等.色谱),2013,31(7):697
[12]Kong X H,Li C Y,Zou Y,et al.Chinese Journal of Analysis Laboratory(孔祥虹,李春艳,邹阳,等.分析试验室),2010,29(4):18
[13]Wu F Q,Jin B H,Chen B,et al.Chinese Agricultural Science Bulletin(吴凤琪,靳保辉,陈波,等.中国农学通报),2010,26(15):115

