高效液相色谱-电喷雾串联质谱法测定饲料中的N-氨基甲酰-L-谷氨酸
唐圣芸,王远兴,温平威,辛 贞
(南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
N-氨基甲酰-L-谷氨酸(N-carbamyl-L-glutamic acid)简称NCG,是一种性质稳定、安全性高的活性物质[1]。它是 N-乙酰-L-谷氨酸 (N-acetyl-L-glutamid acid,NAG)的化学结构类似物[2],结构式见图1。已有关于NCG在食品动物生产和人类健康方面的深入研究[3],发现其可广泛用作仔猪饲料添加剂,以替代或部分替代Arg[4]。Arg是仔猪的必需氨基酸,极易缺乏,在饲料中添加量较大,成本高,且会干扰 Trp、Lys和 His等其他氨基酸的代谢[5]。而NCG可作为Arg的代谢激活剂,促进Arg内源合成,从而促进幼龄动物的生长和发育,其所用剂量低且效果显著,同时避免了对其他氨基酸的干扰[6]。
作为一种潜在的理想饲料添加剂,目前还没有建立对饲料中NCG的检测方法,为符合饲料添加剂安全使用规范和使用剂量,有必要建立一种检测方法。根据 NCG 的化学结构,可采用核磁共振[7,8]和高效液相色谱法[9,10]鉴定和检测含量。由于配合饲料中的成分多且基质复杂,本研究小组[5]前期采用柱前衍生-高效液相色谱法分析NCG时发现基质干扰大,分离度比较差。另外,由于NCG的紫外吸收弱,直接采用紫外检测响应度低,灵敏度低[11]。高效液相色谱-电喷雾串联质谱(HPLC-ESI-MS/MS)可克服这些不足[12,13]。因此,本文采用 HPLC-ESIMS/MS对饲料中的NCG含量进行了测定。
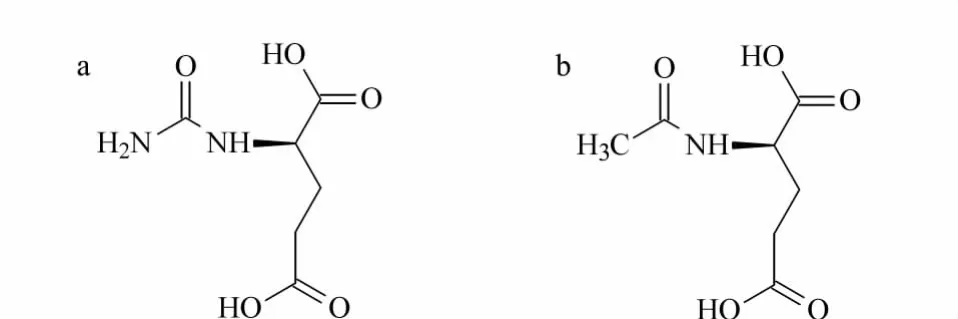
图1 (a)N-氨基甲酰-L-谷氨酸和(b)N-乙酰-L-谷氨酸的结构式Fig.1 Structures of(a)N-carbamyl-L-glutamic acid and(b)N-acetyl-L-glutamic acid
1 实验部分
1.1 仪器与试剂
Agilent 6430液相色谱-三重四极杆质谱联用仪,配有电喷雾离子源(ESI)(美国Agilent公司);涡轮振荡器(太仓市华利达实验设备有限公司);高速离心机(湖南赫西仪器装备有限公司);超声提取仪(昆山市超声仪器有限公司);固相萃取仪(广州智真生物科技公司)等。
NCG标准品(纯度98%)购于Sigma公司;分析纯甲醇、三氯甲烷、正己烷、25%(v/v)氨水溶液均由国药集团化学试剂有限公司生产;色谱纯甲酸、甲醇,纯度均大于99.9%,购自 Merck KGaA公司;超纯水由Milli-Q超纯水仪(Millipore公司)制备。色谱柱Unimicro C18(Unimicro Technologies公司);混合型强阴离子交换反相固相萃取柱(ProElut PXA,60 mg/3 mL)购自北京迪马科技有限公司;50 mL聚丙烯塑料离心管(北京科友佳生物技术有限公司)。
称取NCG标准品5.00 mg于50 mL棕色容量瓶中,用纯水溶解并定容,配制成100 mg/L的标准储备液,于4℃下保存,有效期为1个月。
饲料样品由南昌大学医学院实验动物中心提供。
1.2 样品前处理方法
1.2.1 提取
[14,15]对饲料中目标物的提取方法,依据NCG的理化性质进行改进。准确称取2 g(精确至0.1 mg)粉碎后的饲料样品于50 mL聚丙烯塑料离心管中,加入10 mL甲醇,超声提取15 min(每隔5 min振荡混匀),以4000 r/min离心10 min,上清液全部转移到另一离心管中。用上述方法对残渣重复提取1次,合并上清液。在合并的上清液中加入400 μL 5%(v/v)的氨水溶液后,准确移取 1 mL,用甲醇定容至50 mL,混匀。准确移取3.0 mL上述溶液,待净化。
1.2.2 净化
依次用3 mL甲醇和3 mL水活化固相萃取小柱(ProElut PXA,60 mg/3 mL),将3.0 mL待净化上清液转移至固相萃取柱中,再依次用3 mL水和3 mL甲醇淋洗,抽至近干,用5 mL含2%(v/v)甲酸的甲醇溶液洗脱,收集洗脱液。经0.22 μm滤膜过滤,供上机测定。
1.3 HPLC-MS/MS 条件
HPLC条件 色谱柱:Unimicro C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.1%(v/v)甲酸水溶液(5∶95,v/v);柱温:20 ℃;流速:0.6 mL/min;进样量:10 μL。
质谱条件 电离源:电喷雾离子源(ESI);扫描模式:正离子扫描模式(positive);检测方式:多反应检测(MRM);毛细管电压:4.0 kV;离子源温度:100℃;干燥气温度:300℃;干燥气流量:11 L/min;雾化气压力:1.03×105Pa。NCG的检测离子对、碎裂电压(fragmentor)、碰撞能量(collision energy)等质谱参数见表1。
1.4 加标回收试验
准确称取2 g(精确至0.1 mg)饲料样品,添加适量NCG标准溶液,涡旋混匀后静置10 min,按照1.2节所述的前处理方法进行提取和净化后,按照1.3节所述条件进行HPLC-MS/MS检测。为使标准溶液和样品溶液具有相同的基质,使用基质匹配标准曲线定量,根据添加标准品的峰面积计算回收率。

表1 N-氨基甲酰-L-谷氨酸的质谱检测参数Table 1 MS parameters for the determination of N-carbamyl-L-glutamic acid
2 结果与讨论
2.1 质谱条件的优化
根据NCG的分子结构特征,在电喷雾正离子模式下对NCG标准溶液进行一级质谱分析(Q1扫描),其一级质谱图见图2;再以m/z 191.0作为母离子,进行二级质谱分析(子离子扫描),得到碎片离子(子离子)信息。然后对NCG二级质谱的源内碎裂电压、碰撞气能量等参数进行了优化,使NCG的母离子和特征碎片离子产生的离子对强度最大且稳定时为佳。再按照二级质谱图提供的碎片离子信息,选择最优离子对进行定性和定量。其优化后质谱参数见表1,二级质谱图见图3。
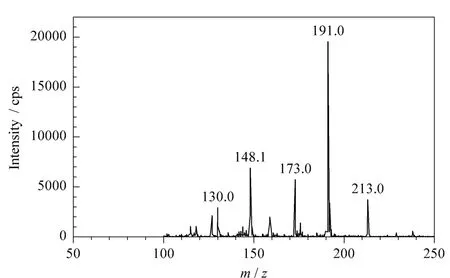
图2 N-氨基甲酰-L-谷氨酸的一级质谱图Fig.2 MS spectrum of N-carbamyl-L-glutamic acid
2.2 色谱分离条件的优化
进行HPLC-MS/MS分析时,流动相的选择对色谱分析效果和检测灵敏度都有很大的影响。分别选用甲醇水溶液和乙腈水溶液作为流动相,对比后发现以甲醇水溶液为流动相时分析物的峰形更好,所以选择甲醇水溶液。NCG呈弱酸性,试验发现在流动相中加入少量甲酸可以提高其电喷雾离子化效率,从而提高灵敏度,同时峰形更好。最终确定如1.3节所述的流动相条件,进行等度分析。
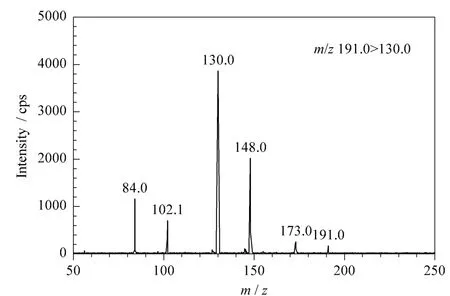
图3 N-氨基甲酰-L-谷氨酸的二级质谱图Fig.3 MS/MS spectrum of N-carbamyl-L-glutamic acid
2.3 样品前处理条件的优化
2.3.1 提取溶剂的选择
因NCG易溶于水和甲醇中,实验对比了水、甲醇水溶液(1∶1,v/v)和甲醇作为提取溶剂的效果。发现以水和甲醇水溶液作为提取溶剂时,杂质更多,干扰比较大,且回收率较低;而以甲醇作提取剂时,干扰相对较小,回收率最好。这可能是由于饲料中大多数添加药物呈水溶性,更易溶于水,而不溶于甲醇中。因此,实验最终选择甲醇为提取溶剂。
2.3.2 固相萃取柱的选择
由于饲料中添加了较多药物,成分复杂,使得样品的初提取液中杂质较多,直接测定容易对目标化合物造成干扰。为了提高灵敏度和降低检出限,对样品初提取液进一步净化处理。实验中比较了液-液萃取法和固相萃取法(SPE)两种方法,发现用三氯甲烷和正己烷分别进行液-液萃取时,去除基质效果不明显,回收率也较低,而且萃取时需消耗大量的有机溶剂,不经济且对环境造成污染,而SPE法更具有优势。所以本实验采用SPE法进行纯化富集。
分别使用反相硅胶键合吸附固相萃取柱(ProE-lut C18,200 mg/3 mL,北京迪马科技有限公司)、ProElut C18-U柱(200 mg/3 mL,北京迪马科技有限公司)和PXA柱进行净化,比较固相萃取的效果。结果发现,C18柱和C18-U柱对目标化合物的净化效果好,有一定的吸附能力,但其回收率都比较低,分别为37.6%和48.5%,难以满足要求;而PXA柱的净化效果较好,对目标化合物的吸附能力很强,回收率为95.3%。故本实验最终采用PXA柱净化。
2.3.3 洗脱条件的选择
由于PXA易吸附阴离子,而NCG为酸性化合物,在样品初提取液中加入适量的氨水溶液可使NCG呈阴离子形态,更易吸附在PXA柱上。用3 mL甲醇活化PXA柱,3 mL 0.1%(v/v)的氨水溶液平衡,上样后依次用3 mL超纯水和3 mL甲醇淋洗,抽干后用5 mL含2%(v/v)甲酸的甲醇溶液洗脱,发现回收率很低。而改用3 mL的纯水进行平衡,发现回收率很理想。分别选择了上样3、4和5 mL作比较,结果发现上样3 mL时的回收率最高,为95.3%;而上样4 mL和5 mL时回收率不理想,分别为78.9%和65.6%。可能是由于PXA柱对饲料中的某些药物的吸附能力也比较强,而其吸附容量有限,造成回收率降低,所以选择上样量为3 mL。
2.4 方法的线性范围、标准曲线及定量限
称取阴性饲料样品,按照1.2节所述方法步骤进行操作,制得样品提取液。用样品提取液对标准储备液进行稀释,得到含量分别为20、50、100、200、500、1000 μg/L的基质标准工作液,现配现用。
为了消除基质效应的影响,使用以上基质标准溶液,按照优化后的色谱和质谱条件进样测定,外标法定量。以NCG特征碎片离子的质量浓度为横坐标(X,μg/L),峰面积为纵坐标(Y),绘制出标准曲线。其相应的线性回归方程为 Y=8.1921 X-7.5459,相关系数(r2)为0.9999。结果表明 NCG在20~1000 μg/L范围内线性关系良好。在阴性饲料中添加80 μg/kg的NCG标准品进行测定,信噪比大于10,因此确定方法的定量限为80 μg/kg;以信噪比大于3确定检出限为24 μg/kg。
2.5 方法的回收率和精密度
准确称取饲料样品,在80、200、500 mg/kg等3个水平做添加回收试验,每个添加水平做5个平行样品。NCG在饲料中的回收率和相对标准偏差(RSD)见表2,3个添加水平的回收率在95.3%和104.0%之间,相对标准偏差在5.8%和7.5%之间,满足饲料中NCG的定量分析要求。NCG加标水平为80 μg/kg的阴性饲料的多反应监测扫描色谱图见图4。

表2 不同加标水平下N-氨基甲酰-L-谷氨酸的回收率和RSD(n=5)Table 2 Recoveries and RSDs of N-carbamyl-L-glutamic acid at different spiked levels(n=5)
2.6 方法的应用
运用本文建立的方法,对5份仔猪饲料样品和5份普通猪饲料样品中的NCG进行了检测,最终5份仔猪饲料样品中均检出NCG,平均含量为309.5 mg/kg,而普通猪饲料样品中均未检出NCG。
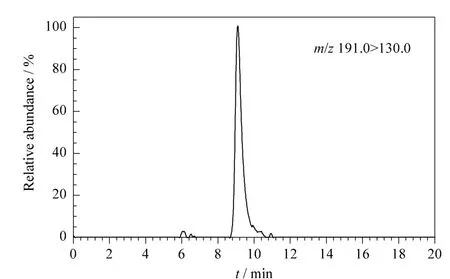
图4 阴性加标(80 μg/kg的N-氨基甲酰-L-谷氨酸)饲料的多反应监测色谱图Fig.4 MRM chromatogram of a negative feedstuff sample spiked with N-carbamyl-L-glutamic acid at 80 μg/kg
3 结论
本文根据饲料样品和NCG的特点,采用甲醇超声提取,混合型强阴离子交换反相固相萃取柱净化,利用高效液相色谱-电喷雾串联质谱法在MRM模式下进行定量分析,成功建立了饲料中NCG含量的检测方法。该方法操作简单,所需溶剂少,样品前处理方便迅速、可操作性高,检测速度快,其灵敏度、准确度和精密度均较高,满足饲料中NCG的分析检测要求,完全达到了预期目标,可为日后建立饲料中NCG含量测定的国家标准提供参考。
参考文献:
[1]Kim S W,McPherson R L,Wu G.J Nutr,2004,134(3):625
[2]Wu G,Knabe D A,Kim S W.J Nutr,2004,134(10):2783S
[3]Schwahn B C,Pieterse L,Bisset W M,et al.Eur J Pediatr,2010,169(1):133
[4]Wu X,Ruan Z,Gao Y,et al.Amino Acids,2010,39(3):831
[5]Huang X Q.[MS Dissertation].Nanchang:Nanchang University(黄新球.[硕士学位论文].南昌:南昌大学),2012
[6]Liu Z Q,Geng M,Shu X G,et al.J Food Agric Environ,2012,10:408
[7]Deng Z W,Li J,Xu M F,et al.Journal of Instrumental Analysis(邓志威,李璟,许美凤,等.分析测试学报),2012,31(9):1081
[8]Pierens G K,Carroll A R,Davis R A,et al.J Nat Prod,2008,71(5):810
[9]Huang Y,Zhang Q J,Liu M,et al.Chinese Journal of Chromatography(黄怡,张青杰,刘敏,等.色谱),2012,30(1):56
[10]Klinglmayr C,Nöbauer K,Razzazi-Fazeli E,et al.J Chromatogr B,2010,878(2):187
[11]Zhu Y T. [MS Dissertation].Nanchang:Nanchang University(朱影恬.[硕士学位论文].南昌:南昌大学),2010
[12]Huang F,Ma Y F,Wu H Q,et al.Journal of Instrumental Analysis(黄芳,马叶芬,吴惠勤,等.分析测试学报),2013,32(3):271
[13]Diana Di Mavungu J,Malysheva S V,Sanders M,et al.Food Chem,2012,135(1):292
[14]Yan L J,Zhang F,Fang E H,et al.Chinese Journal of Chromatography(严丽娟,张峰,方恩华,等.色谱),2010,28(11):1038
[15]Li N,Li H,Shao H,et al.Chinese Journal of Chromatography(李娜,李辉,邵辉,等.色谱),2011,29(4):346

