乙酰胆碱酯酶在脂多糖诱导肺泡巨噬细胞中的变化
刘芬 江榕 李勇 曾振国 聂成 赵宁 黄彩雪 夏亮 钱克俭


DOI:10.3760/cma.j.issn.1671-0282.2014.08.010
基金項目:国家自然科学基金(81101410,81160233);江西省自然科学基金(20122BAB205002)
作者单位:330006 南昌,南昌大学第一附属医院重症医学科(刘芬、江榕、曾振国、聂成、赵宁、黄彩雪、夏亮、钱克俭),肿瘤科(李勇)
通信作者:钱克俭,Email: qkj0607@sohu.com
【摘要】目的 观察脂多糖 (lipopolysaccharide, LPS) 刺激大鼠肺泡巨噬细胞NR8383后乙酰胆碱酯酶 (acetylcholinesterase, AChE) 的表达变化,为研究胆碱能抗炎通路的调控提供新的实验依据。
访法 将体外去致热源培养的NR8383细胞分为对照组及LPS (1 μg/mL) 刺激组,于刺激后3、6、12、24 h各时间点分别离心收集上清液及细胞沉淀,采用酶联免疫吸附法 (enzyme-linked immunosorbent assay, ELISA) 测定上清液中肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) 的变化,实时定量PCR检测细胞中AChE mRNA的表达改变,蛋白质免疫印迹法 (Western blot) 检测细胞中AChE蛋白的表达变化,乙酰胆碱酯酶T-CHE测试盒检测上清液中AChE活性的变化。组间多重比较采用单因素方差分析,进一步采用LSD-t检验进行两两比较,P<0.05为差异具有统计学意义。
结果 与对照组相比,TNF-α的含量在LPS刺激NR8383细胞后3 h开始显著上升 (P<0.05),12 h达高峰,24 h下降但仍明显高于对照组水平 (P<0.05)。与对照组相比,AChE mRNA于刺激后3 h开始上升,升高(3.19 ± 0.44)倍(P<0.05),6 h后达高水平并维持于此水平,6、12、24 h分别上调[(5.65 ± 0.63)、(5.40 ± 0.71)、(5.35 ± 0.77)[倍(与对照组相比,均P<0.05);AChE蛋白的表达及上清液中AChE的活性在LPS刺激后12 h与各自对照组相比均上升[AChE蛋白:(1.37 ± 0.01) vs.(1.05 ± 0.02),P<0.05;AChE活性:(6.14 ± 1.13) U/mL vs. (2.64 ± 0.85) U/mL,P<0.05],随后呈下降趋势,于LPS作用24 h时均低于各自对照组[AChE蛋白:0.65 ± 0.05,P<0.05,AChE活性:(0.56 ± 0.19 )U/mL,P<0.05]。
结论 LPS刺激大鼠肺泡巨噬细胞后,AChE的表达增加,提示其可能参与肺泡巨噬细胞炎症反应的调控;LPS刺激后24 h,AChE mRNA仍处于高表达水平,AChE蛋白及活性却下降,提示在肺泡巨噬细胞炎症反应中可能存在AChE转录后水平的调控。
【关键词】乙酰胆碱酯酶;脂多糖;肺泡巨噬细胞;炎症反应;脓毒症
Changes of acetylcholinesterase expression in alveolar macrophages stimulated by lipopolysaccharide Liu Fen, Jiang Rong, Li Yong, Zeng Zhenguo, Nie Cheng, Zhao Ning, Huang Caixue, Xia Liang, Qian Kejian. Department of Critical Care Medicine, the First Affiliated Hospital of Nanchang University, Nanchang 330006, China
Corresponding author: Qian Kejian, Email: qkj0607@sohu.com
【Abstract】Objective To observe the changes of acetylcholinesterase (AChE) in rat alveolar macrophages NR8383 stimulated by lipopolysaccharide (LPS) in order to provide a novel experimental evidence for studying the regulation of the cholinergic anti-inflammatory pathway.Methods The NR8383 cells cultured with pyrogen-free in vitro were divided into control group and LPS (1 μg/mL) stimulation group. Culture supernatants and cell pellets were collected by centrifugation at 3 h, 6 h, 12 h and 24 h after stimulation, respectively. The level of tumor necrosis factor-α (TNF-α) in the supernatant was assayed by using enzyme-linked immunosorbent assay (ELISA). The expression of AChE mRNA in cells was detected by using real time quantitative RT-PCR, The level of AChE protein in cells was analyzed by using Western blot, The activity of AChE in the supernatant was measured by using True Choline esterase assay kit (T-CHE). One-way analysis of variance (ANOVA) was used for comparisons between two groups, and LSD-t test was performed for further comparison, and difference was statistically significant at P < 0.05. Results The level of TNF-α began to increased significantly at 3 h after stimulation of NR8383 cells with LPS (P<0.05) compared with control group, and reached its peak at 12 h, then decreased until 24 h but the level was still significantly higher than that in control group (P<0.05); The expression of AChE mRNA began to elevate at 3 h after stimulation compared with control group [ (3.19 ± 0.44) times, P<0.05 ], at 6 h reached the high level and then maintained this level at 12 h and 24 h [ (5.65 ± 0.63), (5.40 ± 0.71), (5.35 ± 0.77) times, compared with control group, all P<0.05 ]; The level of AChE protein in cells and the activity of AChE in the supernatant increased at 12 h after LPS stimulation compared with control group [AChE protein: (1.37 ± 0.01) vs. (1.05 ± 0.02), P<0.05; AChE activity:( 6.14 ± 1.13) U/ml vs. (2.64 ± 0.85) U/ml, P<0.05], followed by a downward trend, and were lower than those in control groups at 24 h after LPS stimulation [AChE protein: (0.65 ± 0.05), P<0.05; AChE activity: (0.56 ± 0.19) U/ml, P<0.05].Conclusions The expression of AChE mRNA increased after stimulation with LPS in rat alveolar macrophages, suggesting that AChE may be involved in regulation of alveolar macrophages inflammatory response; AChE mRNA expression is still high while its protein and activity are declined at 24 h after LPS stimulation, suggesting that there may be some mechanisms existed in post-transcriptional regulation of AChE in alveolar macrophages during inflammatory response.
【Key words】Acetylcholinesterase; Lipopolysaccharide; Alveolar macrophage; Inflammatory response; Sepsis
乙酰胆碱酯酶(acetylcholinesterase, AChE)是一种特异性催化水解神经递质乙酰胆碱 (acetylcholine, ACh)的酶[1]。最近有研究表明炎癥反应时迷走神经末梢通过释放ACh可与巨噬细胞上的α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor, α7nAChR)相互作用,减少肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等促炎因子的释放,形成一条胆碱能抗炎通路调控炎症反应[2-3]。AChE因其水解抗炎介质ACh的作用,成为研究炎症反应的新靶点。但AChE在肺泡巨噬细胞炎症反应中的表达变化未见文献报道。本研究以脂多糖(lipopolysaccharide, LPS)刺激大鼠肺泡巨噬细胞为炎症反应模型,观察并分析炎症反应时AChE在肺泡巨噬细胞中的表达变化,为研究胆碱能抗炎通路的调控提供新的实验依据。
1材料与方法
1.1 材料
大鼠肺泡巨噬细胞株(NR8383)购自中国科学院细胞库;Hams F-12K培养基、LPS(E. coli, O111: B4)购自美国Sigma-Aldrich;胎牛血清购自美国Gibco;大鼠TNF-α ELISA检测试剂盒购自上海森雄科技实业有限公司;TRIzol、实时定量PCR引物购自美国Invitrogen;PrimeScript逆转录试剂盒,SYBR实时荧光定量试剂盒购自大连TaKaRa;山羊抗大鼠乙酰胆碱酯酶多克隆抗体购自美国abcam;小鼠抗大鼠β-actin单克隆抗体购自美国anbo;辣根酶标记兔抗山羊IgG、辣根酶标记山羊抗小鼠IgG购自北京中衫金桥生物技术有限公司;乙酰胆碱酯酶T-CHE测试盒购自南京建成生物工程研究所。
1.2细胞培养
所用细胞培养物品均行去致热源处理。将大鼠肺泡巨噬细胞NR8383培养于含15%去致热源胎牛血清的Hams F-12K完全培养基中,置于大气压下37 ℃、5% CO2的恒温湿培养箱中培养。2~3 d更换一次培养基,当细胞融合至80%以上时进行传代。
1.3 实验分组及处理
将NR8383细胞按1×106个/mL密度接种于六孔板中,每孔2 mL。实验分为对照组及LPS刺激组,将终质量浓度1 μg/mL的LPS加至LPS刺激组培养基中,于刺激后3、6、12、24 h各时间点分别离心收集上清液及细胞沉淀,上清液用于TNF-α及AChE活性检测,细胞沉淀用于提取总RNA及总蛋白。
1.4 肺泡巨噬细胞上清液中TNF-α蛋白浓度的检测
采用酶联免疫吸附法(ELISA)测定上清液中TNF-α质量浓度,遵照ELISA试剂盒检测说明书进行操作。
1.5 肺泡巨噬细胞中AChE mRNA表达的检测
采用TRIzol试剂提取细胞总RNA,通过琼脂糖凝胶电泳鉴定所提的总RNA质量,紫外分光光度计测定总RNA在260 nm和280 nm处光密度值,以确定浓度及纯度。参照PrimeScriptRT reagent Kit逆转录试剂盒说明书进行逆转录反应,10 mL反应体系。反应条件:37 ℃ 15 min,85 ℃ 5 s。参照SYBR Premix Ex TaqTM Ⅱ试剂盒说明书进行实时定量PCR反应,20 mL反应体系。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。在ABI StepOne定量PCR仪上进行扩增反应,选取β-actin作为内参照,采用2-ΔΔCt 方法计算AChE mRNA的相对表达量。
1.6 肺泡巨噬细胞中AChE蛋白表达的检测
采用蛋白质免疫印迹法(Western blot)检测AChE蛋白表达。细胞经RIPA试剂冰上裂解后提取总蛋白,通过BCA法测定蛋白浓度,加入2×上样缓冲液后沸水中水浴变性5~10 min。各取20 μg/孔,进行10% SDS-PAGE垂直凝胶电泳分离(浓缩胶电压80 V,分离胶电压120 V),随后电转移至NC膜上(电流100 mA,时间1.5 h)。5% 脱脂奶粉封闭1 h,一抗(山羊抗大鼠AChE抗体1∶200,小鼠抗大鼠β-actin抗体1∶3000)4℃孵育过夜。TBST洗膜后,加入辣根过氧化物酶标记的二抗(兔抗山羊1∶10 000,山羊抗小鼠1∶3000)室温孵育1 h,TBST洗膜后,滴加免疫荧光化学发光法发光底物,曝光,显影。以β-actin为内参照,分析条带灰度值。
1.7 肺泡巨噬细胞上清液中AChE活性的检测
收集上清液按乙酰胆碱酯酶T-CHE测试盒操作说明书进行反应测定,AchE活性 (U/mL)=(测定管OD值-对照管OD值)/(标准管OD值-空白管OD值)×标准品浓度 (1 μmol / mL) ×样本测试前稀释倍数。
1.8 统计学方法
采用SPSS 17.0软件处理数据,结果以均数±标准差(x±s)表示,不同时间点多个均数多重比较采用单因素方差分析,若差异具有统计学意义,不同时间点均数两两比较则进一步采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 肺泡巨噬细胞上清液中TNF-α的浓度变化
LPS(1 μg/mL)刺激NR8383细胞后,通过ELISA检测上清液中TNF-α的变化,结果显示,与对照组相比,TNF-α的含量在LPS刺激后3 h开始显著上升(P<0.05),12 h达高峰,24 h下降但仍明显高于对照组水平(P<0.05)。见图1。
2.2 肺泡巨噬细胞中AChE mRNA的表达变化
LPS(1 μg/mL)刺激NR8383细胞后,采用实时定量PCR方法检测AChE mRNA的相对表达变化,结果显示,在LPS刺激后3 h、6 h、12 h、24 h,AChE mRNA的表达水平与正常对照组相比分别上调(3.19 ± 0.44)倍(P<0.05),(5.65 ± 0.63)倍(P<0.05),(5.40 ± 0.71)倍(P<0.05),(5.35 ± 0.77)倍(P<0.05),差异有统计学意义;6 h、12 h、24 h三组间均数两两比较差异无统计学意义。结果表明LPS刺激能增加大鼠肺泡巨噬细胞NR8383中AChE mRNA的表达,于刺激后3 h开始上升,6 h后达高水平并维持于此水平。见图2。
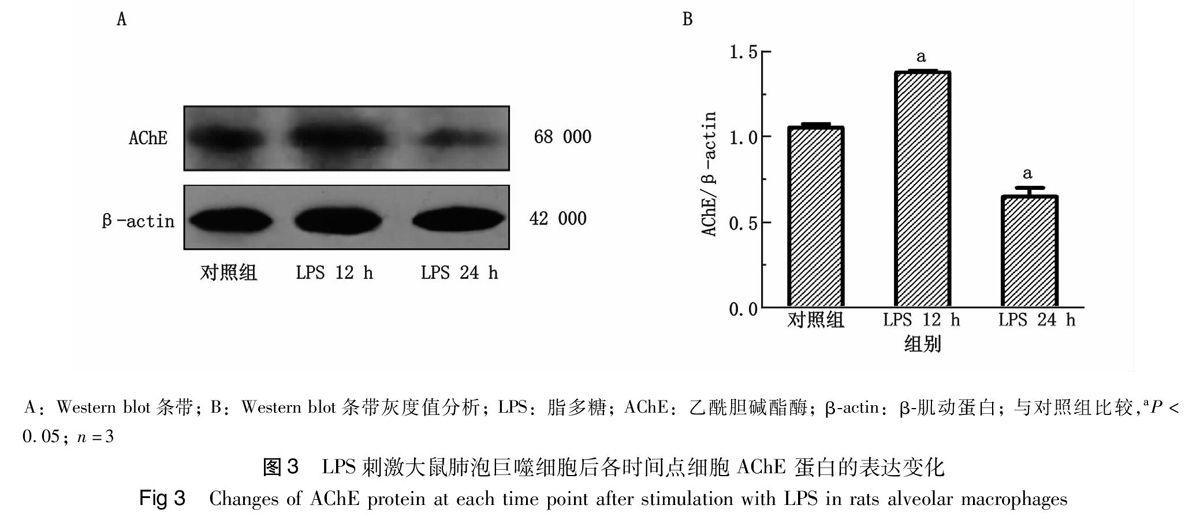
2.3 肺泡巨噬细胞中AChE蛋白的表达变化
LPS(1 μg/mL)刺激NR8383后12 h、24 h,对细胞AChE蛋白采用Western blot方法进行分析,结果如图3A所示,在LPS刺激后12 h,AChE 蛋白条带比对照组条带增粗,颜色加深;在LPS刺激后24 h,与对照组相比,AChE 蛋白条带变细,颜色变浅。条带经灰度值分析,AChE/β-actin灰度比值结果如图3B所示,对照组、LPS 12 h、LPS 24 h灰度比值分别为(1.05 ± 0.02),(1.37 ± 0.01),(0.65 ± 0.05) ,P<0.05;12 h、24 h均值與对照组相比,差异具有统计学意义。LPS刺激大鼠肺泡巨噬细胞NR8383后,细胞中AChE蛋白的表达在刺激后12 h上升,随后呈下降趋势,于LPS作用后24 h低于对照组水平。见图3。
2.4 肺泡巨噬细胞上清液中AChE活性的变化
LPS(1 μg/mL)LPS刺激NR8383后12 h、24 h,通过乙酰胆碱酯酶T-CHE测试盒对细胞上清液AChE活性进行测定,结果显示,对照组AChE活性为(2.64 ± 0.85 )U/mL,LPS刺激后12 h AChE活性为(6.14 ± 1.13 )U/mL (P<0.05),刺激后24 h为(0.56 ± 0.19 )U/mL (P<0.05),12 h、24 h均值与对照组相比,差异具有统计学意义。结果表明LPS刺激大鼠肺泡巨噬细胞NR8383后,细胞上清液中AChE的活性在刺激后12 h上升,随后呈下降趋势,于LPS作用后24 h低于对照组水平。见图4。
3 讨论
LPS是革兰氏阴性菌外壁的主要成分,它可以通过作用肺内巨噬细胞表面Toll样受体4(Toll-like receptor 4, TLR4),依次磷酸化一系列蛋白激酶,最终活化核转录因子-κB(nuclear factor kappa B, NF-κB),引起多种炎症因子如TNF-α基因转录,启动炎症反应,导致脓毒症肺损伤,甚至急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)发生[4-6]。本研究结果显示LPS刺激大鼠肺泡巨噬细胞后TNF-α大量释放,表明成功诱导肺泡巨噬细胞炎症反应模型。碱能抗炎通路是一条神经免疫调节通路,由传出迷走神经、神经递质ACh和α7nAChR组成,炎症反应时迷走神经释放的ACh与巨噬细胞上α7nAChR 结合,通过细胞内信号通路转导,阻碍NF-κB的活化,抑制促炎因子释放,从而减轻炎症反应[7]。在内毒素血症、脓毒症休克、缺血-再灌注损伤等均有研究表明胆碱能抗炎通路发挥着重要的作用[8-9]。Sun等[10]研究发现在LPS诱导的RAW264.7巨噬细胞和小鼠中,胆碱能激动剂尼古丁通过上调miR-124的表达水平,降低白细胞介素-6(interleukin-6, IL-6)等炎症因子的表达。AChE是一种特异性水解ACh的酶,它不仅存在于神经元细胞中,也存在于免疫细胞上,其中巨噬细胞表达最丰富[11]。炎症反应时巨噬细胞分泌的AChE将迅速水解ACh,阻碍ACh的抗炎作用,因此AChE成为调控炎症反应的新靶点。研究表明使用胆碱酯酶抑制剂可减轻脓毒症动物炎症反应,如胆碱酯酶抑制剂加兰他敏可通过抑制中枢AChE活性,降低LPS动物模型的血清TNF-α和IL-6水平及提高生存率[12]。另外有研究发现血清胆碱酯酶可能参与了老年人全身炎症反应综合征的发生和发展过程,并且对该类患者的预后有一定的预测作用[13]。但胆碱能抗炎通路在ARDS中的调控作用及机制尚不确定。
本研究中,通过检测对照组AChE mRNA、蛋白的表达及AChE活性均证实AChE在大鼠肺泡巨噬细胞中存在表达。更为重要的是,本研究观察到LPS刺激肺泡巨噬细胞后12 h,AChE mRNA、蛋白及活性均较对照组升高,这说明LPS诱导的肺泡巨噬细胞炎症反应能引起AChE的表达增加,提示其可能参与肺泡巨噬细胞炎症反应的调控;刺激后24 h,AChE mRNA仍处于高表达水平,但AChE蛋白及活性均低于对照组,这与de Oliveira等[14]对人急性白血病单核细胞细胞株(the human acute leukaemia monocytyc cell line, THP-1)的研究结果一致,提示在肺泡巨噬细胞炎症反应中可能存在AChE转录后水平的调控。
转录后调控通常是由成熟mRNA的5或3 端非翻译区(untranslated region, UTR)与相应蛋白或microRNA等相互作用,介导mRNA的出核转运、翻译起始及降解等过程,从而调节基因的表达。近来有研究[15-16]对小鼠和人初级巨噬细胞的研究发现AChE是miR-132的靶基因,miR-132能靶向作用AChE mRNA的3UTR,抑制AChE蛋白翻译表达,加强胆碱能抗炎通路作用从而使炎症消退。笔者的前期研究表明LPS刺激肺泡巨噬细胞能引起miR-132表达上调。因此笔者推测肺泡巨噬细胞中AChE转录后水平的调控可能与miR-132有关,但仍有待今后进一步实验证实。
参考文献
[1]Meshorer E, Soreq H. Virtues and woes of AChE alternative splicing in stress-related neuropathologies [J]. Trends Neurosci, 2006, 29(4): 216-224.
[2]Wang H, Yu M, Ochani M, et al. Nicotinic acetylcholine receptor alpha7 subunit is an essential regulator of inflammation [J]. Nature, 2003, 421(6921): 384-388.
[3]Tracey KJ. Physiology and immunology of the cholinergic antiinflammatory pathway [J]. J Clin Invest, 2007, 117(2): 289-296.
[4]Guha M, Mackman N. LPS induction of gene expression in human monocytes [J]. Cell Signal, 2001, 13(2): 85-94.
[5]Salomao R, Brunialti MK, Rapozo MM, et al. Bacterial sensing, cell signaling, and modulation of the immune response during sepsis [J]. Shock, 2012, 38(3): 227-242.
[6]黄日红, 万献尧. 乌司他丁对脂多糖诱导的大鼠肺组织Toll样受体4信号通路表达的影响 [J]. 中华急诊医学杂志, 2012, 21(11): 1226-1229.
[7]Parrish WR, Rosas-Ballina M, Gallowitsch-Puerta M, et al. Modulation of TNF release by choline requires alpha7 subunit nicotinic acetylcholine receptor-mediated signaling [J]. Mol Med, 2008, 14(9-10): 567-574.
[8]马岳峰, 徐正宽, 刘志海. 重视胆碱能抗炎通路的研究 [J]. 中华急诊医学杂志, 2009, 18(10): 1016-1019.
[9]李辉, 刘志海, 马岳峰. 胆碱酯酶抑制剂用于脓毒症治疗的研究进展 [J]. 中华急诊医学杂志, 2010, 19(12): 1336-1338.
[10]Sun Y, Li Q, Gui H, et al. MicroRNA-124 mediates the cholinergic anti-inflammatory action through inhibiting the production of pro-inflammatory cytokines [J]. Cell Res, 2013, 23 (11): 1270-1283.
[11]王金荣, 王宏伟, 刘胜洪, 等. 大鼠免疫细胞及器官的固有胆碱能系统 [J]. 中华神经医学杂志, 2005, 4(1): 28-31.
[12]Pavlov VA, Parrish WR, Rosas-Ballina M, et al. Brain acetylcholinesterase activity controls systemic cytokine levels through the cholinergic anti-inflammatory pathway [J]. Brain Behav Immun, 2009, 23(1): 41-45.
[13]李天瑯, 金启辉, 陈怀红. 血清胆碱酯酶对老年全身炎症反应综合征患者预后的预测作用 [J]. 中华急诊医学杂志, 2011, 20(7): 730-733.
[14]de Oliveira P, Gomes AQ, Pacheco TR, et al. Cell-specific regulation of acetylcholinesterase expression under inflammatory conditions [J]. Clin Hemorheol Microcirc, 2012, 51(2): 129-137.
[15]Shaked I, Meerson A, Wolf Y, et al. MicroRNA-132 potentiates cholinergic anti-inflammatory signaling by targeting acetylcholinesterase [J]. Immunity, 2009, 31(6): 965-973.
[16]Shaltiel G, Hanan M, Wolf Y, et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target [J]. Brain Struct Funct, 2013, 218(1): 59-72.
(收稿日期:2014-02-18)
(本文編辑:何小军)
P871-875

