热打击对人骨骼肌细胞通透性、细胞骨架及细胞周期的影响
潘志国 邵玉 万军 耿焱 陈镜合 苏磊


DOI:10.3760/cma.j.issn.1671-0282.2014.08.008
基金項目:全军医学科学技术研究“十二五”发展计划重点项目(BWS12J018);国家自然科学基金(81071529,81101467,81101406)
作者单位:510010 广州,广州军区广州总医院重症医学科 全军热区创伤救治与组织修复重点实验室
通信作者:苏磊,Email: slei_icu@163.com
【摘要】目的 研究热打击对培养人骨骼肌细胞(HSKMC)通透性、细胞骨架及细胞周期影响。
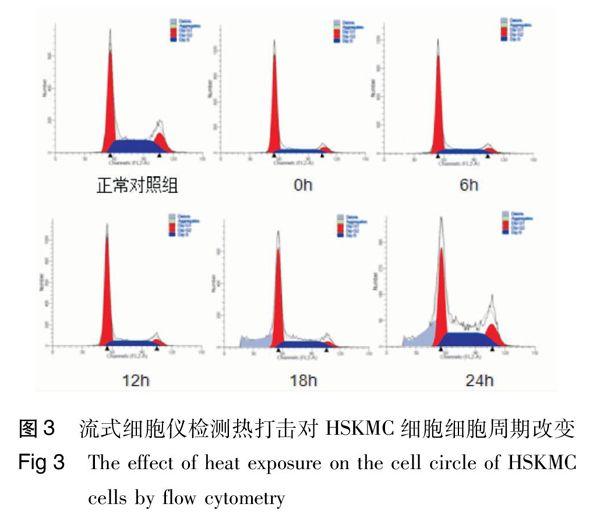
访法 流式细胞仪钙离子内流检测热打击对HSKMC细胞膜通透性的影响,考马斯亮蓝R-250染色法检测热打击对HSKMC细胞骨架影响,流式细胞仪检测热打击对HSKMC细胞周期改变。结果 给予培养人HSKMC细胞不同温度梯度热打击1 h后, 43 ℃热打击组钙离子流式检测的中位数为91.63,37 ℃对照组中位数为22.98。同对照组相比,随着热打击程度加强,显微镜高倍镜下可见骨骼肌细胞骨架逐渐出现变粗、变短、出现明显的应力纤维。骨骼肌细胞在热打击情况下,各组G0/G1期DNA含量在44.13~62.98之间,与正常对照组对比,当细胞离开热打击环境后培养18 h前G0/G1期DNA含量明显高于对照组,培养第18 小时恢复才同对照组基本相同。
结论 热打击的情况下造成细胞钙离子内流效应,导致细胞内钙超载。可改变HSKMC骨架结构,使骨架失去正常的网状有序排列结构,间隙增大。细胞周期出现阻滞,细胞被阻滞在G0/G1期。
【关键词】热打击;骨骼肌细胞;通透性;钙超载;细胞骨架;细胞周期;考马斯亮蓝染色;流式检测
The effect of heat stress on the permeability, cytoskeleton and cell cycle of human skeletal muscle cellPan Zhiguo, Shao Yu, Wan Jun, Geng Yan, Chen Jinghe, Su Lei.ICU Department of Guangzhou General Hospital of Guangzhou Military Command, Guangzhou 510010, China
Corresponding author:Su Lei, Email: slei_icu@163.com
【Abstract】Objective To study the effect of heat stress on the permeability, cytoskeleton and cell cycle of human skeletal muscle cell (HSKMC). Methods The HSKMC membrane permeability was detected by calcium ion inflow with flow cytometer, the cytoskeleton was stained by CBB 250, and the cell cycle was determined by flow cytometer.Results After 1 h of heat stress on human HSKMC cells under different temperature gradient, the median level of calcium ion was 91.63 in 43 ℃ heat stress group compared with 22.98 in 37 ℃control group. As temperature increased, thicker and shorter cytoskeleton and stress fiber were shown under the high power lens of microscope. The DNA expression of skeleton cells at G0/G1 stage was 44.13-62.98 in groups under heat stress. Compared with normal control group, DNA expression was much higher in heat stress group, when HSKMC was cultured under 37℃ temperature for another 18 h, it kept decreasing DNA expression to a similar level as control group.Conclusions Heat stress can cause calcium iron inflow resulting in intracellular calcium overload, and affect the cytoskeleton leading to loss of normal web ordered arrangement and increased gap in HSKMC cells, which give rise to blocking cell cycle into G0/G1 stage.
【Key words】Heat stress;Skeletal muscle cells;Permeability;Calcium overload;Cytoskeleton;Cell cycles;Coomassie brilliant blue; Coomassie brilliant blue;Flow cytometry
中暑的特征为中心体温过高伴随着系统炎症反应致多脏器功能障碍,患者中心体温可超过40 ℃,导致机体主要脏器如心、肝、肺、肾、肠、血管和骨骼肌等发生一系列损伤[1-7]。中暑并发横纹肌溶解症的发病率约为25%[8]。骨骼肌占成人体质量的40%~50%,骨骼肌细胞内外的电解质失衡、炎症因子变化对整个机体的影响十分巨大。本课题组前期实验证实热打击对骨骼肌细胞具有细胞毒效应,抑制骨骼肌细胞的增殖,并促进细胞因子IL-6和TNF-α的释放,提出重症中暑的“第二关键点”理论[9-10]。笔者在前期的研究中发现热打击是导致横纹肌溶解的重要原因[11-12],本实验拟通过研究在热打击条件下骨骼肌细胞的钙离子内流情况、细胞骨架改变和细胞周期变化情况,观察热打击对于骨骼肌细胞的影响,进一步研究骨骼肌在重症中暑发生、发展中的作用和机制。
1 材料与方法
1.1 实验材料及试剂
人骨骼肌细胞株(HSKMC)从中国科学院昆明细胞所购买。流式细胞仪购自BD公司,Fluo-3 AM钙离子荧光探针试剂盒购自invitrogen公司,Olympus荧光显微镜,细胞周期与凋亡检测试剂盒购自武汉碧云天公司。
1.2 方法
1.2.1 HSKMC细胞培养 HSKMC细胞复苏后,将细胞收入离心管中,1000 r/min离心10 min,弃上清,用高糖DMEM培养液(含20%胎牛血清,10 0000 U/L青霉素、100 mg/L链霉素)混匀细胞,转入25 mL玻璃培养瓶中,在37 ℃、5% CO2浓度及饱和湿度条件下培养,次日换液,以后根据细胞生长情况每48~72 h更换培养液一次,每周传代1~2次。
1.2.2 流式细胞仪钙离子内流检测热打击对HSKMC细胞膜通透性的影响 将Fluo-3AM钙离子荧光探针溶于1 mL DMSO中,制成1 μg/μL,取对数生长期细胞,按1×104个/皿密度铺入60 mm×15 mm细胞培养皿,培养至单层融合后,给予消化,然后将悬浮液按下述方法给予刺激:①对照组(即将细胞置于标准37 ℃、5%CO2浓度培养箱中同其余各组等时间培养);②43 ℃热打击组(将细胞置于43 ℃细胞培养箱中培养1 h)。打击后同一时间每瓶悬浮液按2 μL/100 μL加入Fluo-3AM钙离子荧光探针,置于标准37 ℃、5%CO2浓度培养箱共同避光孵育1 h,予以上機检测。
1.2.3 考马斯亮蓝R-250染色法检测热打击对HSKMC细胞骨架影响 取对数生长期细胞,消化后按5×103个/片密度铺入6孔板培养玻片,培养至单层融合后,按下述方法给予刺激:①对照组(即将细胞置于标准37 ℃、5%CO2浓度培养箱中同其余各组等时间培养);②43 ℃热打击组(将细胞置于43 ℃细胞培养箱中培养1 h)。应用考马斯亮蓝R250染色:①配制M-缓冲液;②倾弃培养上清,加入1 mL PBS冲洗3次;③吸去PBS,用1.5%TritonX-100摇床震荡处理8 min,3次;④吸去TritonX-100,用M-缓冲液摇床震荡洗4次,每次3 min;⑤用3%戊二醛固定10 min,给予M-缓冲液洗3次,每次3 min;⑥用0.2%考马斯亮蓝R250震荡染色40 min;⑦蒸馏水洗3次,每次孵箱烘干;⑧然后将细胞玻片置于载玻片上,加盖玻片,于普通光学显微镜下观察;⑨如染色效果好,可用二甲苯处理样品,5 min,两次,最后一次不要等样品干;⑩加一滴中性树胶,加盖玻片封片,制成永久切片。普通光学显微镜高倍镜下照片。
1.2.4 流式细胞仪检测热打击对HSKMC细胞周期改变 取对数生长期细胞,按1×104个/皿密度铺入60 mm×15 mm细胞培养皿,培养至单层融合,按下述方法给予刺激:①对照组(即将细胞置于标准37 ℃、5%CO2浓度培养箱中同其余各组等时间培养);②43 ℃热打击组(将细胞置于43 ℃细胞培养箱中培养1 h)。将43 ℃热打击组继续置于标准37 ℃、5%CO2浓度培养箱孵育,于0、6、18、24 h分别取出后消化,用胰酶消化细胞,至细胞可以被轻轻用移液管或枪头吹打下来时,加入培养液,吹打下所有的贴壁细胞,并轻轻吹散细胞。具体操作按武汉碧云天公司细胞周期与凋亡检测试剂盒说明书进行。染色完成后在24 h内完成流式检测。用流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况。采用适当分析软件进行细胞DNA含量分析和光散射分析。
2 结果
2.1 热打击对HSKMC细胞膜通透性的影响
流式细胞仪检测结果提示,给予培养人HSKMC细胞不同温度梯度热打击1 h后,如图1所示,43 ℃热打击组钙离子流式检测的中位数为91.63,37 ℃对照组中位数为22.98。
2.2 热打击对HSKMC细胞骨架影响
本实验中,同对照组相比,随着热打击程度加强,显微镜高倍镜下可见骨骼肌细胞骨架逐渐出现变粗、变短、出现明显的应力纤维,见图2。
2.3 热打击对HSKMC细胞细胞周期改变
同正常对照组相比,骨骼肌细胞在热打击情况下,DNA含量与细胞周期中各期百分构成比统计结果分别见图3及表1。3 讨论
胞浆Ca2+是细胞的第2信使。细胞内钙不仅作为一种重要的第2信使广泛参与细胞的运动、分泌、代谢和分化等多种细胞功能活动的调节,而且胞内钙离子浓度的变化与调控对于参与维持存在于细胞质膜或细胞器膜两侧的跨膜梯度差,以及介导细胞对外界刺激的应答反应具有重要的调节作用[13]。研究发现, 钙在细胞损伤过程中起重要作用,各种因素导致的细胞或细胞器内钙过度集聚可引起细胞结构和功能损害,线粒体和细胞内钙异常增加程度常作为细胞损伤指征之一[14]。
引起横纹肌溶解的一个重要的理论就是线粒体Ca2+超载导致线粒体功能障碍[15]。细胞内外的Ca2+水平变化是微小和迅速的,极难测定,目前定量这些变化在技术上仍存在一定困难[16]。通过测定荧光强度来反映细胞中的钙离子浓度是目前普遍采用的细胞内钙离子检测方法。本实验通过应用流式细胞仪及Fluo-3/AM检测不同温度热打击后细胞内钙离子变化。本实验结果显示,Fluo-3/AM负载的HSKMC细胞在37 ℃基础状态下就有少量钙离子内流,但随着热打击温度及时间延长,43 ℃热打击组钙离子流式检测的中位值为91.63,而37 ℃对照组中位值仅为22.98,提示细胞内钙离子浓度明显增加,说明在热打击的情况下造成细胞钙离子内流效应,导致细胞内钙超载,最终导致骨骼肌细胞损伤、坏死。
细胞骨架是细胞内不同蛋白质纤维的聚合物和各种调控蛋白交错连接的网络结构,它参与细胞分裂及运动、细胞内物质运输等多种功能,在维持真核细胞的形态、承受外力、胞内运输、变形运动、信号转导等方面发挥着重要的作用,而且还参与许多重要的生命活动,包括染色体分离、细胞中各类小泡和细胞器的定向转运以及白细胞迁移、精子游动、神经细胞轴突伸展等[17-18]。一般而言,应力纤维是支撑细胞形态的主要结构,其表达的改变往往代表细胞的变形和增殖等变化[19]。本实验通过应用考马斯亮蓝R250染色法检测热打击对HSKMC细胞骨架影响,随着热打击时间及程度加强,同对照组相比,显微镜高倍镜下可见HSKMC细胞骨架逐渐出现变粗、变短,出现明显的应力纤维。提示热打击可改变HSKMC骨架結构,增加HSKMC通透性,同时使骨架失去正常的网状有序排列结构,引起细胞收缩,使HSKMC间隙增大,最终会导致HSKMC结构和功能出现改变。
多细胞有机体的发生与发育有赖于细胞增殖、分化和死亡的精密结合, 即细胞周期的正常运行。本研究通过流式细胞仪检测热打击后骨骼肌细胞细胞周期分布,发现骨骼肌细胞在热打击情况下,各组G0/G1期DNA相对含量在44.13~62.98之间,与正常对照组对比,当细胞离开热打击环境后培养18 h前G0/G1期DNA相对含量明显高于对照组,培养第18小时才恢复同对照组基本相同,说明热打击情况下,细胞周期出现阻滞,细胞被阻滞在G0/G1期,细胞内部活动减缓,处于“休眠”状态,不能进一步发展到S期和G2/M期,从而不能完成整个细胞的分裂过程,大约18 h左右才恢复至正常状态。
参考文献
[1]Glazer JL. Management of heatstroke and heat exhaustion[J]. Am Fam Physician,2005,71(11):2133-2140.
[2] Carter RR, Cheuvront SN, Williams JO, et al. Epidemiology of hospitalizations and deaths from heat illness in soldiers[J]. Med Sci Sports Exerc,2005,37(8):1338-1344.
[3] 刘志锋,唐柚青,徐秋林,等. 热打击后小鼠肺和脑组织病理学的改变[J]. 中华急诊医学杂志,2011,20(6):623-626.
[4] 肖桂珍,苏磊. 中暑时肠黏膜机械屏障功能的变化[J]. 中国危重病急救医学,2012,24(9):568-570.
[5] 潘志国,邵玉,刘亚楠,等. 重症中暑患者入院早期凝血功能指标与预后的关系[J]. 中华危重病急救医学,2013,25(12):725-728.
[6] 肖桂珍,袁芳芳,古正涛,等. 二十碳五烯酸对热打击后肠上皮细胞的影响[J]. 感染、炎症、修复,2013,14(1):11-14.
[7] 耿焱,彭娜,刘亚楠,等. 热打击对培养人脐静脉内皮细胞增殖能力的影响[J]. 感染、炎症、修复,2013,14(1):7-10.
[8] Kozack J K, Macintyre D L. Malignant hyperthermia[J]. Phys Ther,2001,81(3):945-951.
[9] 潘志国,耿焱,刘灏,等. 热打击对培养人骨骼肌细胞的损伤和释放IL-6、TNF-α的影响[J]. 实用医学杂志,2012(9):1405-1407.
[10]苏磊. 重症中暑防治回顾与启示[J]. 解放军医学杂志,2011(9):883-885.
[11] 苏磊,孟繁苏. 横纹肌溶解的病理生理及诊治[J]. 中华急诊医学杂志,2007,16(11):1231-1232.
[12] 周伟梁,张涛,苏磊. 中暑与横纹肌溶解及脓毒症的关系[J]. 中国全科医学,2006,9(20):1738-1739.
[13] Loughrey CM, Maceachern KE, Cooper J, et al. Measurement of the dissociation constant of Fluo-3 for Ca2+ in isolated rabbit cardiomyocytes using Ca2+ wave characteristics[J]. Cell Calcium,2003,34(1):1-9.
[14] 张旭,梅晓云,卞慧敏,等. 骨骼肌细胞损伤模型的建立[J]. 解放军药学学报,2003(02):85-86.
[15] 潘志国,苏磊,孟繁甦. 横纹肌溶解症病理生理及其与脓毒症关系[J]. 岭南急诊医学杂志,2008,13(5):398-399, 402.
[16] Sobie EA, Kao JP, Lederer WJ. Novel approach to real-time flash photolysis and confocal [Ca2+] imaging[J]. Pflugers Arch,2007,454(4):663-673.
[17] Akhmanova A, Steinmetz MO. Tracking the ends: a dynamic protein network controls the fate of microtubule tips[J]. Nat Rev Mol Cell Biol,2008,9(4):309-322.
[18] Pellegrin S, Mellor H. Actin stress fibres[J]. J Cell Sci,2007,120(Pt 20):3491-3499.
[19] Svoboda KK, Orlow DL, Ashrafzadeh A, et al. Zyxin and vinculin distribution at the cell-extracellular matrix attachment complex (CMAX) in corneal epithelial tissue are actin dependent[J]. Anat Rec,1999,254(3):336-347.
(收稿日期:2014-01-17)
(本文编辑:何小军)
P862-865

