药物性胆汁淤积型肝病的治疗研究
朱超慧,董迎华,艾正琳,吴 凯,胡 静
解放军309医院1.消化科;2.结核科,北京 100091;3.首都医科大学附属北京地坛医院消化科
肝脏是药物代谢的主要器官,大部分药物均要经过肝脏进行氧化、还原、水解、羟化、脱巯或脱羧等化学反应和排出体外的过程。因而,临床应用各种药物常可导致药物性肝损伤(drug-induced liver injury,DILI)。近年来,随着新药的不断问世及中草药的广泛应用,药物性肝损伤发生率呈逐年增高的趋势[1]。根据国际药物性肝损害标准,将药物性肝损害分为3型:肝细胞损伤型、胆汁淤积型、混合型。其中胆汁淤积型常在停用药物后病情仍进展,导致疾病迁延不愈或发展为肝衰竭,目前尚无标准治疗方案[2]。现将309医院2001年1月-2013年1月收治的药物性肝损害中217例符合胆汁淤积型药物性肝损伤患者,根据其临床特点和治疗效果确定治疗药物性胆汁淤积型肝病的最佳治疗方案。
1 资料与方法
1.1 病例选择标准 纳入标准:有明确的用药史,用药后出现肝损伤的表现,且符合Danan和Benichou于1993年修订的“药物性肝损害因果关系评价表(RUCAM简化评分系统)”的诊断标准[3];确定为胆汁淤积型:ALP>2倍正常值上限,或ALT/ALP比值≤2。
排除标准:① 年龄>65岁或<18岁;② 合并其他脏器功能不全及活动性肺结核者;③ 病毒性、自身免疫性、酒精性及其他特定类型肝损害;④有肝硬化、肝功能衰竭或严重感染等并发症者;⑤连续治疗时间不足4周者。
1.2 基本临床资料 符合上述入选条件的患者共217 例,男31(14.3%)例,女 186(85.7%)例,年龄 20~63岁,平均年龄(38.1±10.3)岁。其中结核药所致189(87.1%)例,中药及中成药所致 21(9.7%)例,抗真菌药物所致 4(1.8%)例,免疫抑制剂所致 2(0.9%)例,解热镇痛药物所致1(0.5%)例。
临床表现:主要临床症状为乏力、尿黄、纳差、腹胀、皮肤瘙痒、厌油、肝区不适。主要体征为黄疸、肝脏肿大,部分患者有皮疹。
用药至发现肝功能异常时间,结核药为4~121 d,平均(23.9 ±21.7)d;服用中药及中成药为6 ~38 d,平均(19.2 ±10.6)d;抗真菌药物为 14 ~25 d,平均(17.5±5.6)d;免疫抑制药为183 ~275 d,平均227.5 d,解热镇痛药物为6 d。
1.3 检测项目及方法
1.3.1 217例患者晨起空腹时肘静脉血采集:用日立7600全自动生化仪,对血清总胆红素(TBil)、丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、总胆汁酸(TBA)、白蛋白(ALB)、γ-谷氨酰转肽酶(r-GT)、总胆固醇(TC)、甘油三酯(TG)、胆碱酯酶(CHE)、血糖(Glu)等进行测定。复测每份标本。
1.3.2 病毒标志物及自身抗体检测:采用化学发光法检测甲、乙、丙型肝炎病毒感染情况。甲型肝炎IgM抗体检测,乙型肝炎微粒法检测两对半,以上两种均采用罗氏C6000试剂盒检测,丙型肝炎抗体检测采用强生ECI试剂盒。自身抗体检测采用欧蒙试剂盒。复测每份标本。
1.4 分组及给药方法 所有患者均给予基础保肝治疗。将患者共分为5个治疗组:SAM+H+UDCA组、SAM+H组、SAM+UDCA组、H+UDCA组、中药组。各组除基础保肝、支持治疗外,给予如下治疗:①SAM+H+UDCA组:给予S-腺苷蛋氨酸(德国基诺药厂,商品名思美泰)1000 mg+5%葡萄糖溶液250 ml静脉滴注,1次/d;泼尼松片 30~60 mg口服,1次/d,7 d后酌情减量;熊去氧胆酸胶囊(德国Falk公司,商品名优思弗)250 mg口服,3次/d;② SAM+H组:S-腺苷蛋氨酸1000 mg+5%葡萄糖溶液250 ml静脉滴注,1次/d;泼尼松片30~60 mg口服,1次/d,7 d后酌情减量;③ SAM+UDCA组:给予S-腺苷蛋氨酸1000 mg+5%葡萄糖溶液250 ml静脉滴注,1次/d;熊去氧胆酸胶囊250 mg口服,3次/d;④ H+UDCA组:泼尼松片30~60 mg口服,1次/d,7 d后酌情减量;熊去氧胆酸胶囊250 mg口服,1次/d;⑤ 中药组:由309医院中医科一位长期从事肝病治疗的主任医师,开具中药汤剂治疗。
1.5 观察项目 观察临床症状体征变化:皮肤瘙痒、黄疸、乏力、纳差等情况,并于治疗前和治疗后4周记录瘙痒评分。瘙痒评分标准采用Ribalta评分标准[4]:0分为无瘙痒;1分为偶发瘙痒;2分为间断性瘙痒,无症状波动;3分为间断性瘙痒,有症状波动;4分为持续性瘙痒,日夜无变化。观察治疗前后血清TBiL、ALT、AST、ALP、r-GT、CHE的变化。复测每份标本。
1.6 统计学处理 应用SPSS 13.0软件,采用配对设计t检验和单因素方差分析方法,P<0.05为差异有统计学意义。
2 结果
2.1 各组临床症状的缓解 疗程满4周后,各治疗组临床症状如:尿黄、皮肤瘙痒、乏力、纳差、厌油、肝区不适等均有不同程度的缓解。与其他治疗组比较,SAM+H+UDCA组和SAM+H组皮肤瘙痒及纳差症状缓解更明显。但随着治疗时间的延长,使用激素出现的副作用增多。其中7例出现低钾血症(最低为2.6 mmol/L)。5例出现高血糖(用药前血糖正常,用药后空腹血糖 >6.1 mmol/L,其中 2例空腹 >7.0 mmol/L)。但经处理后均坚持至4周的疗程。
2.2 瘙痒症状评分的变化 治疗前各组的瘙痒评分差异无统计学意义(P>0.05)。治疗后,各组的瘙痒指数均较治疗前差异有显著统计学意义(P<0.01)。SAM+H+UDCA组与SAM+H组比较,瘙痒指数差异无统计学意义(P>0.05)。SAM+H+UDCA组、SAM+H组与其余三组之间比较差异有统计学意义(P<0.01)。即SAM+H+UDCA组、SAM+H组瘙痒症状的缓解明显优于其余各组。治疗后,SAM+UDCA组、H+UDCA组与中药组的瘙痒指数比较,差异无统计学意义(P >0.05)。
表1 治疗前后瘙痒症状评分的变化()Tab1 The changes of pruritus grades before and after treatment()
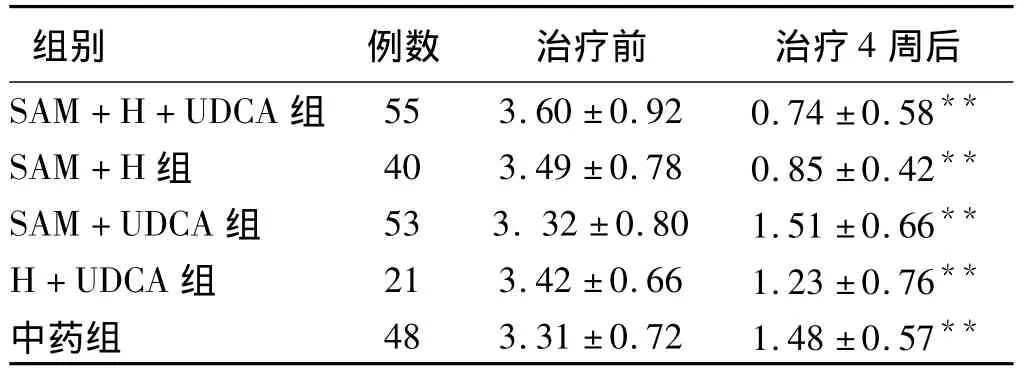
表1 治疗前后瘙痒症状评分的变化()Tab1 The changes of pruritus grades before and after treatment()
注:与治疗前比较,**P <0.01。
周后SAM+H+UDCA 组 55 3.60 ±0.92 0.74 ±0.58组别 例数 治疗前 治疗4**SAM+H 组 40 3.49 ±0.78 0.85 ±0.42**SAM+UDCA 组 53 3.32 ±0.80 1.51 ±0.66**H+UDCA 组 21 3.42 ±0.66 1.23 ±0.76**中药组 48 3.31 ±0.72 1.48 ±0.57**
2.3 血生化指标的改变 治疗前各组的血清TBil、ALT、AST、ALP、r-GT、TBA 差异无统计学意义(P >0.05)。治疗后,各治疗组的血清 TBil、ALP、r-GT、ALT、AST、TBA均明显下降(见表2)。其中,与其他治疗组比较SAM+H+UDCA组和SAM+H组的TBiL、r-GT、ALT、AST、ALP、TBA 下降速度快、幅度大,差异有统计学意义(P<0.05)。但两组之间治疗后的水平差异无统计学意义(P>0.05)。其余三组中,与SAM+UDCA组、中药组比较,H+UDCA组治疗后的血清TBil、ALP、r-GT、ALT、AST、TBA 下降明显,差异无统计学意义(P >0.05)。
表2 治疗前后血生化指标的变化()Tab2 The changes of the tests of blood biochemisty()
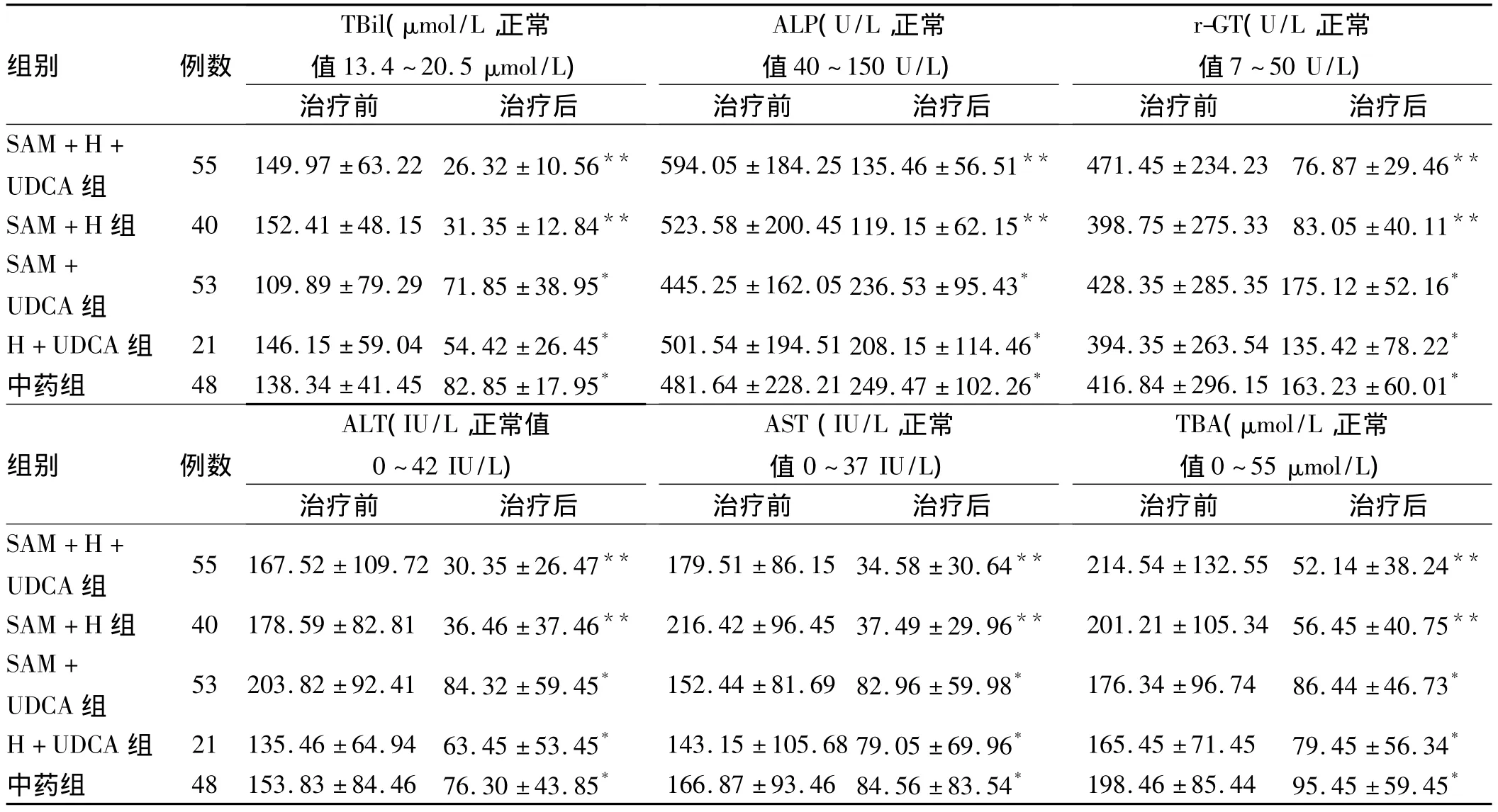
表2 治疗前后血生化指标的变化()Tab2 The changes of the tests of blood biochemisty()
注:与治疗前比较,*P <0.05,**P <0.01。
组别 例数TBil(μmol/L,正常值 13.4 ~20.5 μmol/L)ALP(U/L,正常值40~150 U/L)r-GT(U/L,正常值7~50 U/L)治疗前 治疗后SAM+H+UDCA组治疗前 治疗后 治疗前 治疗后55 149.97 ±63.2226.32 ±10.56** 594.05 ±184.25135.46 ±56.51** 471.45 ±234.23 76.87 ±29.46**SAM+H 组 40 152.41 ±48.1531.35 ±12.84** 523.58 ±200.45119.15 ±62.15** 398.75 ±275.33 83.05 ±40.11**SAM+UDCA 组 53 109.89 ±79.2971.85 ±38.95* 445.25 ±162.05236.53 ±95.43* 428.35 ±285.35175.12 ±52.16*H+UDCA 组 21 146.15 ±59.0454.42 ±26.45* 501.54 ±194.51208.15 ±114.46* 394.35 ±263.54135.42 ±78.22*中药组 48 138.34 ±41.4582.85 ±17.95* 481.64 ±228.21249.47 ±102.26* 416.84 ±296.15163.23 ±60.01*组别 例数ALT(IU/L,正常值0~42 IU/L )AST(IU/L,正常值0~37 IU/L)TBA(μmol/L,正常值0 ~55 μmol/L)治疗前 治疗后SAM+H+UDCA组治疗前 治疗后 治疗前 治疗后55 167.52 ±109.7230.35 ±26.47** 179.51 ±86.1534.58 ±30.64** 214.54 ±132.55 52.14 ±38.24**SAM+H 组 40 178.59 ±82.81 36.46 ±37.46** 216.42 ±96.4537.49 ±29.96** 201.21 ±105.34 56.45 ±40.75**SAM+UDCA 组 53 203.82 ±92.41 84.32 ±59.45* 152.44 ±81.6982.96 ±59.98* 176.34 ±96.74 86.44 ±46.73*H+UDCA 组 21 135.46 ±64.94 63.45 ±53.45* 143.15 ±105.6879.05 ±69.96* 165.45 ±71.45 79.45 ±56.34*中药组 48 153.83 ±84.46 76.30 ±43.85* 166.87 ±93.4684.56 ±83.54* 198.46 ±85.44 95.45 ±59.45*
3 讨论
DILI是指应用治疗剂量的药物时,肝脏受药物毒性损害或发生过敏反应所引起的疾病。近年来,由于药物种类的增加,新药的不断涌现及各类保健药物的应用,药物性肝损害的发病率呈明显增高趋势[5]。
在药物性肝损害的3种类型中,肝细胞损伤型最为常见,其于停药后多数患者的肝损伤可停止并逐渐恢复,因而预后较好[6]。而胆汁淤积型,由于停药后肝损伤仍进行性加重,因此预后较差[7]。本研究显示,胆汁淤积型肝损害中女性多于男性,这与国内外报道的女性患者易发生重型药物性肝损害相符[8]。本研究中,抗结核药引起的肝损害所占比例最高,是由于我院有结核病研究所,且近年随着流动人口增多,结核病患病率增高,因而结核药致肝损害所占比例较高[9]。
胆汁淤积型药物性肝损害在临床中尚无标准、特效的治疗方法。2009年欧洲肝病学会胆汁淤积性肝病诊治指南建议立即停用可疑药物并严密监测临床表现和生化指标[10]。由于缺乏适当的有对照的临床试验,熊去氧胆酸(UDCA)、糖皮质激素(H)、腺苷蛋氨酸(SAM)只能作为试验性治疗[11]。在临床工作中常几种药物联合应用,何为最佳联合方案,一直困扰着临床医师。研究显示:SAM+H+UDCA组与SAM+H组治疗效果、临床表现及生化指标好转均优于SAM+UDCA组、H+UDCA组及中药组。SAM可通过促进胆汁流动:加速SAM依赖性质膜磷脂的合成,降低胆固醇/磷脂的比例,改善细胞质膜的流动性;增加内源性解毒过程中硫基的合成,促进半胱氨酸、牛磺酸、谷胱甘肽和辅酶A的代谢,从而减轻胆汁淤积。而H的非特异性抗炎作用,可促进汇管区和胆小管炎症水肿消退,增加胆汁排泄;激素可改善与胆汁生成有关的肝细胞内亚微结构的功能,增加胆汁流的生成;抗过敏和免疫抑制反应,减轻药物对肝脏的免疫损害。因而两种药物联合应用时可明显改善胆汁淤积型药物性肝损害患者的临床症状及生化指标。尤其是患者的瘙痒及TBil明显好转。但激素应用时,部分患者出现不良反应。
UDCA可通过改善胆汁淤积保护受损胆管细胞免遭胆汁酸的毒性作用;刺激胆汁排泌,促进胆盐和其他有机离子排出,促进有毒胆汁化合物的代谢;激活疏水性胆汁酸的解毒作用;抑制肝细胞的凋亡等途径改善胆汁淤积。本研究显示与SAM+H组相比,SAM+H+UDCA组无论临床表现及生化指标,差异均无统计学意义。与SAM+UDCA组及中药组比较,H+UDCA组临床表现及生化指标下降明显,差异无统计学意义,可能与样本量小有关,另外,UDCA为口服制剂,起效较慢,对较重的胆汁淤积型肝病的短期疗效较差。
本研究结果表明,胆汁淤积型药物性肝损害患者给予SAM及H治疗效果更为理想,但需注意H的不良反应的发生。
[1]Suk KT,Kim DJ.Drug-induced liver injury:present and future[J].Clin Mol Hepatol,2012,18(3):249-257.
[2]Stine JG,Lewis JH.Drug-induced liver injury:a summary of recent advances[J].Expert Opin Drug Metab Toxicol,2011,7(7):875-890.
[3]Danan G,Benichou C.Causality assessment of adverse reaction to drugs-I.A novel method based on the consensus meeting:application to drug-induced liver injuries[J].J Clin Epidemiol,1993,46(11):1323-1330.
[4]Ribalta J,Reyes H,Gonzalez MC,et al.S-adenosyl-L-methionine in the treatment of patients with intrahepatic cholestasis of pregnancy:arandomized,double-blind,placebo-controlled study with negative results[J].Hepatology,1991,13(6):1084-1089.
[5]Davern TJ.Drug-induced liver disease[J].Clin Liver Dis,2012,16(2):231-245.
[6]Andrade RJ,Lucena MI,Fernandez MC,et al.Drug-induced liver injury:an analysis of 461 incidences submitted to the Spanish registry over a 10-year period[J].Gastroenterology,2005,129(2):512-521.
[7]Tujios S,Fontana RJ.Mechanisms of drug-induced liver injury:from bedside to bench[J].Nat Rev Gastroenterol Hepatol,2011,8(4):202-211.
[8]Hu XN,Bao ZJ.Epidemiology ofdrug-induced liverinjury[J].Chin J Hepatol,201l,19(1):78-80.胡晓娜,保志军.药物性肝损害的流行病学[J].中华肝脏病杂志,2011,19(1):78-80.
[9]Devarbhavi H,Singh R,Patil M,et al.Outcome and determinants of mortality in 269 patients with combination anti-tuberculosis drug-induced liver injury [J].J Gastroenterol Hepatol,2013,28(1):161-167.
[10]European Association for the Study of the Liver.EASL Clinical Practice Guidelines:management of cholestatic liver diseases[J].J Hepatol,2009,51(2):237-267.
[11]Cholestasis Liver Disease Diagnosis and Treatment of the Expert Committee.Cholestasis liver disease diagnosis and treatment expert consensus[J].Chin J Gastroenterol Hepatol,2010,19(6):492-500.胆汁淤积性肝病诊断治疗专家委员会.胆汁淤积性肝病诊断治疗专家共识[J].胃肠病学和肝病学杂志,2010,19(6):492-500.

