p38MAPK信号通路与肝缺血再灌注损伤的关系研究
谭金锋 综述,崔晓光 审校
哈尔滨医科大学附属第二医院麻醉科,黑龙江 哈尔滨 150086
丝裂原活化蛋白激酶 (mitogen activated protein kinase,MAPK)是脊椎动物体内广泛存在的一类丝氨酸/苏氨酸蛋白激酶。MAPKs是一种信号蛋白,当机体受到各种外界刺激时会使外界应激信号通过信号转导、接替、放大、整合导致基因及生理改变而调控一系列细胞活动,p38MAPK是MAPKs家族中的成员之一,其激活后所介导的信号转导主要与细胞的应激、损伤和凋亡有关[1]。肝缺血再灌注损伤(hepatic ischemiareperfusion injury,HIRI)发生在诸如肝移植、肝肿瘤切除、创伤及失血性休克后的肝衰竭中,并在此过程中产生严重的病理生理问题[2]。由于病理生理复杂,迄今尚无明确认识。本文旨在探讨一下p38MAPK的作用机制及其在HIRI中所起的作用。
1 MAPKs家族及其信号转导通路
目前,MAPKs家族发现的成员至少有数十种之多,然而近些年关注最多的是细胞外信号调节激酶1/2(ERK1/2)、c-jun N端激酶(JNK)或称作应激活化蛋白 激 酶 (stressactivatedproteinkinase,SAPK)、p38MAPK 以 及 最 新 发 现 的 ERK5[3]。ERK、JNK、P38MAPK、ERK5/BMK1由不同的外界刺激激活,而形成不同的转导通路,导致各种转录因子活化而介导不同的生物学效应,但这几条通路又存在广泛的交叉,从而导致通路间产生相互协同或拮抗作用。MAPK信号转导是以三级激酶级联的方式进行,即MAPK激酶的激酶(MAPKKK或MEKK)磷酸化激活 MAPK激酶(MAPKK或MEK)进而再磷酸化MAPK使其活化,进而转入核内来调节细胞的基本生理过程。
2 p38MAPK信号通路
2.1 p38MAPK家族 p38MAPK是由360个氨基酸残基组成的分子量为38 kDa的蛋白,p38MAPK共有4种亚型(6 种异构体),分别为 p38α1、p38α2、p38β1、p38β2、p38γ 和 p38δ,其中亚型 α 分别与 β、δ、λ 的序列同源性为74%、57%和60%[4]。不同亚型不但分布具有组织特异性,而且对相同刺激也会产生不同的效应。肝脏中主要存在的亚型是p38α。
2.2 p38MAPK的信号调节 p38MAPK级联反应包括4种激酶:PAK(MAPKKKK)、MLK(MAPKKK)、MKK3/6/4(MAPKK)、p38MAPK(MAPK),共同构成了一个连续的蛋白激酶反应链。胞外刺激信号与相应受体特异性结合后,会磷酸化 PAK和 MLK(主要为MLK3),促进 MKK3/MKK6基因表达,并使其表达蛋白磷酸化,进而诱导 p38MAPK基因转录,表达其生物功能,p38MAPK活化的大体过程可概括为:胞外一些应激情况下激活MLK,并进一步激活MKK3/6/4,而达到使p38MAPK活化的目的,最终活化的p38MAPK通过上调某些转录因子基因的表达和生物活性,影响细胞的各种生理活动。p38MAPK信号通路调控着多种转录因子的基因表达活性,如激活作用转录因子、生长停滞及DNA损伤基因、IRF-3、NF-κB、热休克转录因子等,从而表现出不同的生理作用[5]。
3 肝缺血再灌注损伤
HIRI发生在诸如肝移植、肝肿瘤切除、创伤及失血性休克后的肝衰竭中,HIRI代表着一系列导致细胞和组织损伤的复杂病理生理事件。由于血流与氧的短暂中断和恢复会伴随产生多种氧自由基、细胞因子/细胞趋化因子以及黏附因子,导致细胞、器官的功能障碍[6];HIRI不仅导致细胞的坏死而且会使肝细胞凋亡;HIRI也是缺少适合器官移植供体的主要原因之一。由于没有特别有效的手段来对抗HIRI造成的器官损伤,因此,HIRI是导致肝手术、肿瘤、移植病死率上升的一个重要原因。为了探寻有效的防治HIRI方法,专家们对HIRI发生机制以及治疗手段做了大量的研究。而新近发现HIRI发生的一个重要机制就是MAPKs家族的激活,它在应对胞外刺激的胞内信号转导中起着重要作用。在哺乳动物的MAPKs家族中,p38MAPK可以被诸如缺血再灌注这样的外界细胞应激所激活,来参与HIRI的发生。
4 p38MAPK与HIRI
p38MAPK在HIRI所介导的信号转导过程大致可简单概括为图1。肝缺血再灌注给予机体(细胞)刺激,该刺激会与细胞膜上的相应受体如酪氨酸激酶受体、G蛋白偶联受体等结合,并将刺激信号转导到细胞浆中并作用于胞浆中的p38MAPK,p38MAPK磷酸化激活后(p-p38MAPK),转移到细胞核中,磷酸化并激活不同的转录因子而最终激活相应基因,从而发挥出不同的生理效应。
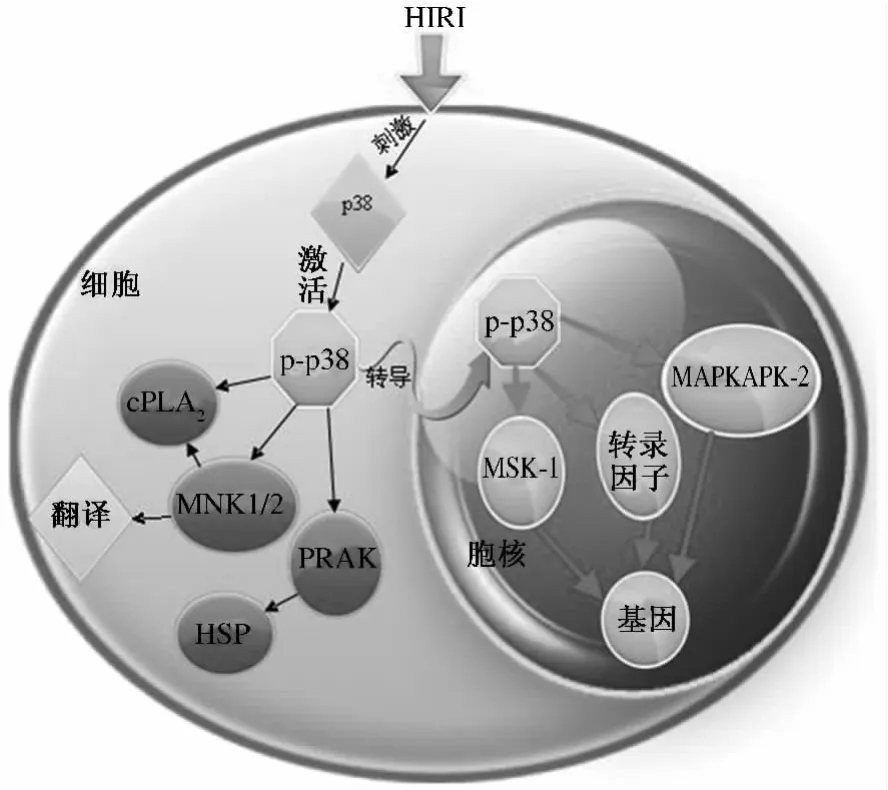
图1 p38MAPK介导的信号转导过程Fig1 Signal transduction pathway of p38MAPK
大量证据证明p38MAPK在HIRI中起着重要作用,p38MAPK在肝再灌注后数分钟内磷酸化而被激活,其激活与诱导细胞凋亡坏死有着密切的关系[7];并且p38MAPK也与肝纤维化有关。p38MAPK信号通路主要通过调节转化生长因子、瘦素、血小板源性生长因子等因素来实现对肝星形细胞(HSC)的作用。一个最新研究显示p38MAPK的活性在活化的HSC中比休眠状态下的HSC有更高的表达。肝损伤后由于HSC的激活会导致Ⅰ型胶原的合成而导致肝的纤维化;随着HIRI的进展,一些炎症介质如类花生酸类、TNF-α、IL-1、黏附分子、NO以及胞内钙离子都会产生一系列的级联反应,p38MAPK家族在这个病理事件中起着重要作用,而它们介导的信号转导取决于HIRI的程度。已经有实验证明,用p38MAPK拮抗剂如SB203580可以抑制上述炎症介质产生的炎症级联反应从而减轻肝缺血再灌注带来的炎症性损伤[8]。而且王雨等[1]在肝移植实验中发现缺血再灌注期间p38MAPK信号转导途径对供肝组织ICAM-1mRNA的表达具有重要影响,p38MAPK信号转导途径能促进供肝组织中ICAM-1 mRNA的表达。而ICAM-1的表达在介导HIRI时血流中白细胞与肝窦内皮细胞间的黏附、导致供肝微循环功能障碍中起关键性作用。有研究发现类似的SB203580的使用能显著降低由脂多糖或TNF-α诱导的人类肺微血管内皮细胞表达ICAM-1。
p38MAPK在3个独立方面起着作用:(1)作为用炎症因子处理过的细胞中的酪氨酸磷蛋白;(2)作为咪唑安定类药物的靶点来阻止TNF-α的产生;(3)作为MAPK激活蛋白的复活激酶。p38MAPK可以被细胞因子、激素、G蛋白偶联受体、渗透冲击、热应激以及其他应激激活,p38MAPK的激活是通过上游促分裂原活化蛋白激酶(MAPKK)而发生的苏氨酸180和酪氨酸182的双重磷酸化的过程,主要生物反应涉及促使能够启动白细胞集聚并激活的炎症介质的产生、活化。许多活化的p38MAPK下游靶点与编码炎症因子的反式激活基因有关[9]。可见p38MAPK通路及与之相关的炎症过程的激活在肝的缺血后损伤中起着至关重要的作用[7]。研究表明p38MAPK在细胞凋亡中起重要作用,细胞凋亡因素均可能启动细胞内的一系列反应,最终导致双位点特异激酶 MEK/MKK磷酸化邻近的酪氨酸与苏氨酸,激活 p38MAPK通路,之后移位于相应的转录因子,启动基因转录[10]。在HIRI中,组织会产生大量的TNF-α。p38MAPK亦可增强 TNF-α表达,进而 TNF-α活化 p38MAPK,诱导凋亡。Jung等[11]证实p38MAPK磷酸化进而诱导下游转录因子以及Caspase-3的表达引起凋亡,给予SB203580后可有效抑制细胞凋亡,也能通过磷酸化 Bcl-2家族中的成员,如磷酸化Bim65位丝氨酸,破坏凋亡与抗凋亡的平衡,以及通过线粒体发起的内在的细胞死亡途径诱发凋亡。
近些年,人们已经把注意力集中到对p38MAPK的阻滞及由此带来的应用价值。(1)p38MAPK拮抗剂能够阻滞炎症因子的产生和活化[8]。在脂多糖刺激的巨噬细胞中,对p38MAPK的阻滞可以编码IL-1的IL-1α、IL-1β基因的反式激活[12]。在大鼠肝移植模型中,应用p38MAPK拮抗剂可以阻断再灌注后阻滞中p38MAPK的激活,从而减轻供体的再灌注损伤,可以增加受体鼠的生存率[13]。由于p38拮抗剂能使促炎因子的产生及由此引发的信号转导得到抑制,其在HIRI上的应用已经形成一种可行的、值得期待的防治手段。(2)HIRI发生后细胞因子的活化及对肝组织的破坏都与细胞骨架的改变有关,细胞骨架改变可引起缺血再灌注后胞内运输过程、细胞能动性、微循环的失衡,导致器官功能障碍。而p38MAPK的激活则能通过增加肝细胞丝状肌动蛋白成分而引发细胞骨架改变。由此可见,有效的抑制p38MAPK通路可以减轻肝缺血再灌注引发的细胞骨架的改变,进而减轻HIRI。
5 p38MAPK在HIRI中的双重作用
大多数文献报道p38MAPK都具有加重各器官缺血再灌注损伤的作用,然而也有实验证明p38MAP在特定环境下可以作为一种保护性因素。Kiemer等[14]证实心房钠尿肽(ANP)可以减轻HIRI,而它也可导致p38MAPK的激活。在大鼠体内实验中,用ANP预处理提高了肝细胞中p38MAPK的活性,ANP介导肝细胞保护作用的关键在于预处理阶段的p38MAPK的激活;而且在鼠的心肌缺血再灌注损伤模型中,再灌注后,磷酸化的p38MAPK在ANP预处理组明显比对照组表达更多。
缺血预处理是为了提高肝脏对IRI的耐受力而采取的一种提前短时间血管闭塞的技术,并且已经成功应用在肝肿瘤切除术中。缺血预处理激活了p38MAPK,其激活与细胞周期蛋白d1(cyclin D1)的增多及进入细胞循环有直接联系[15]。cyclin D1的表达是静息细胞进入细胞循环途径中最早也是最关键的一步。而p38MAPK恰恰控制着cyclin D1的表达。
由此可见,p38MAPK在HIRI中具有双重作用,它不仅可以通过促进炎症细胞因子的产生导致肝损伤,也可以作为一种保护剂来刺激如ANP的产生、诱生表达cyclin D1进而保护肝IR造成的肝损伤。
p38MAPK,可由胞外刺激诱导产生,与缺血再灌注引起的肝损伤有很大关系。调节p38MAPK及其活性的治疗手段的发现将会对防治肝损伤起到积极的作用,p38MAPK拮抗剂有极大的治疗潜能,它们可以降低HIRI后的细胞损伤、凋亡和坏死。然而由于p38MAPK具有多效的生物功能,需要对其进行更深入的研究,争取未来针对p38MAPK的药物能扩大其优点规避其缺点,最终成功应用于临床,更好的服务于HIRI领域。
[1]Wang Y,Tian FZ,Tang LJ,et al.The role of p38MAPK pathway in ischemia-reperfusion injury of isolated liver [J].Chin J Hepatol,2003,11(3):170-172.王雨,田伏洲,汤礼军,等.P38信号转导途径对离体肝脏缺血再灌注损伤的影响[J].中华肝脏病杂志,2003,11(3):170-172.
[2]Desai KK,Dikdan GS,Shareef A,et al.Ischemic preconditioning of the liver:a few perspectives from the bench to bedside translation[J].Liver Transpl,2008,14(11):1569-1577.
[3]Wu D,Ou J,Hui N.MAPK signal transduction pathway and epithelial ovarian cancer[J].Tumor,2007,8(27):676.吴东,欧俊,惠宁.丝裂原激活的蛋白激酶信号转导通路与卵巢上皮癌[J].肿瘤,2007,27(7):676.
[4]Tamura DY,Moore EE,Johnson JL,et al.p38 mitogen-activated protein kinase inhibition attenuates intercellular adhesion molecule-1 upregulation on human pulmonary microvascular endothelial cells[J].Surgery,1998,124(2):403-407.
[5]Obata T,Brown GE,Yaffe MB.MAP kinase pathways activated by stress:the p38 MAPK pathway[J].Crit Care Med,2000,28(4 Suppl):N67-N77.
[6]Guo MZ,Liu XL,Feng ZJ,et al.Relationship between NF-κB and liver ischemia and reperfusion injury[J].Chin J Gastroenterol Hepatol,2012,21(6):583-585.郭慕真,刘晓玲,冯志佳,等.肝缺血再灌注损伤与NF-κB[J].胃肠病学与肝病学杂志,2012,21(6):583-585.
[7]Kobayashi M,Takeyoshi I,Yoshinari D,et al.p38 mitogen-activated protein kinase inhibition attenuates ischemia-reperfusion injury of the rat liver[J].Surgery,2002,131(3):344-349.
[8]Toledo-Pereyra LH,Toledo AH,Walsh J,et al.Molecular signaling pathways in ischemia/reperfusion[J].Exp Clin Transplant,2004,2(1):174-177.
[9]Kumar S,Boehm J,Lee JC.p38 MAP Kinases:key signaling molecules as therapeutic targets for inflammatory diseases[J].Nat Rev Drug Discov,2003,2(9):717-725.
[10]Cursio R,Filippa N,Miele C,et al.Involvement of protein kinase B and mitogen-activated protein kinases in experimental normothermic liver ischemia-reperfusion injury[J].Br J Surg,2006,93(6):752-761.
[11]Jung JY,Yoo CI,Kim HT,et al.Role of mitogen-activated protei n kinase(MAPK)in troglitazone-induced osteoblastic cell death[J].Toxicology,2007,234(1-2):73-82.
[12]Karin M.Mitogen activated protein kinases as targets for development of novel anti-inflammatory drugs[J].Ann Rheum Dis,2004,63(Suppl 2):ii62-ii64.
[13]Yoshinari D,Takeyoshi I,Kobayashi M,et al.Effects of a p38 mitogen-activated protein kinase inhibitor as an additive to University of Wisconsin solution on reperfusion injury in liver transplantation [J].Transplantation,2001,72(1):22-27.
[14]Kiemer AK,Kulhanek-Heinze S,Gerwig T,et al.Vollmar AM.Stimulation of p38 MAPK by hormonal preconditioning with atrial natriuretic peptide[J].World J Gastroenterol,2002,8(4):707-711.
[15]Teoh N,Laclercq I,Pena AD,et al.Low dose TNF-α protects against hepatic ischemia-reperfusion injury in mice:implications for preconditioning[J].Hepatology,2003,37(1):118-128.

