Me-OL-1s催化叔丁基过氧化氢歧化分解制叔丁醇
王丽丽,冯利利,齐 麟,卢书培,齐兴义
(1. 北京航空航天大学 化学与环境学院 仿生智能界面科学与技术教育部重点实验室,北京 100191;2. 北京建筑大学 城市雨水系统与水环境教育部重点实验室,北京 100044)
Me-OL-1s催化叔丁基过氧化氢歧化分解制叔丁醇
王丽丽1,冯利利2,齐 麟1,卢书培1,齐兴义1
(1. 北京航空航天大学 化学与环境学院 仿生智能界面科学与技术教育部重点实验室,北京 100191;2. 北京建筑大学 城市雨水系统与水环境教育部重点实验室,北京 100044)
采用静态水热法合成了水钠锰矿型层状氧化锰Me-OL-1s(Me:K,Mg,Fe,Ni,Cu)催化剂,对所合成的催化剂进行了XRD和ICP-AES表征,并将该系列催化剂用于叔丁基过氧化氢(TBHP)歧化分解制备叔丁醇的反应,考察了反应温度、反应时间及催化剂用量对TBHP歧化分解反应的影响。实验结果表明,所合成的Me-OL-1s催化剂均为水钠锰矿型氧化锰;在温和的反应条件(323~338 K)下,Me-OL-1s催化剂均对TBHP歧化分解反应具有活性,其中Cu-OL-1催化剂的活性最高,在65%(w)TBHP水溶液 1 mL、反应介质乙腈5 mL、Cu-OL-1催化剂用量(基于TBHP水溶液和乙腈的总体积)1.67~8.33 mg/mL、338 K下反应1 h时,TBHP的转化率均达到96%以上,且叔丁醇的选择性均为100%。
叔丁基过氧化氢;歧化分解;叔丁醇;水钠锰矿;Me-OL-1s催化剂
叔丁醇是一种重要的精细化工产品,可用作内燃机的燃料添加剂和抗爆剂,也可用作有机合成的中间体及生产叔丁基化合物的烷基化剂。叔丁醇的传统制备方法主要有异丁烯硫酸水合法、异丁烯直接水合法和丙烯/叔丁烷共氧化法(简称哈康法)[1],其中哈康法是目前叔丁醇的主要工业制备方法,由叔丁烷自氧化、丙烯催化环氧化和产物混合物(环氧丙烷+叔丁醇)纯化分离三步组成。因哈康法工艺步骤冗长、繁杂,致使多数采用该方法制备叔丁醇的企业难以获得生产过程的最大经济效益。
叔丁烷自氧化反应产物为叔丁醇和叔丁基过氧化氢(TBHP)的混合物。若将该产物混合物中的TBHP在反应条件下以可控方式歧化分解为叔丁醇和氧气[2],则可使叔丁烷自氧化反应直接延伸为简单易行和绿色友好的叔丁醇制备过程,从而避免哈康法的工艺缺陷。能催化烷基过氧化氢(ROOH)歧化分解的催化剂大都含有第4周期过渡金属离子;与其他过渡金属元素相比,含Mn和Co的催化剂通常表现出较高的催化ROOH歧化分解的活性[3-8]。
Me-OL-1(Me为可交换层间正离子)为水钠锰矿型层状氧化锰。因具有二维微孔结构和骨架锰离子(Mn4+)可变价性(如Mn4+→Mn3+),Me-OL-1多用于催化氧化还原反应过程,如K-OL-1催化甲醛氧化分解反应[9-10]、烯烃环氧化反应[11]、碳质烟灰燃烧反应[12]及Ca-OL-1催化水氧化反应[13]等。
本工作采用静态水热法合成了系列Me-OL-1s(Me:K,Mg,Fe,Ni,Cu)催化剂,并考察了该系列催化剂对TBHP歧化分解反应的催化性能。
1 实验部分
1.1 Me-OL-1s催化剂的制备
参照文献[14]报道的方法合成Me-OL-1s催化剂。第一步:采用静态水热法合成K-OL-1催化剂,KMnO4为氧化剂,乙醇为还原剂;第二步:以K-OL-1催化剂为前体,采用离子交换法制备Mg-OL-1,Fe-OL-1,Ni-OL-1,Cu-OL-1催化剂。实验所用试剂均为分析纯。
具体制备过程:1)将50 mL无水乙醇和50 mL去离子水于室温下搅拌混合后,逐量加入0.375 mol的KOH,继续搅拌20 min得到乙醇还原剂溶液;将150 mL浓度0.316 mol/L的KMnO4溶液在搅拌下逐滴加入上述乙醇还原剂溶液中,生成棕褐色沉淀后,继续搅拌30 min;将所得棕褐色悬浮液转移至含有聚四氟乙烯内衬的不锈钢反应釜内,在自生压力下完成晶化过程,晶化温度353 K,晶化时间72 h;晶化完成后,将生成的棕褐色沉淀用去离子水离心洗涤至洗液pH=9,得到K-OL-1催化剂。2)将得到的K-OL-1催化剂分别加入到300 mL浓度1 mol/L的Mg,Fe,Ni,Cu盐的水溶液中,室温下搅拌过夜,再经过滤和去离子水洗涤3次得到Mg-OL-1,Fe-OL-1,Ni-OL-1,Cu-OL-1催化剂。
1.2 Me-OL-1s催化剂的表征
采用Rigaku公司D/max 2200PC型自动X射线衍射仪测定Me-OL-1s催化剂的XRD谱图,CuKα射线,Ni滤光,扫描速率3(°)/min,扫描范围2θ=5°~60°。采用Varian公司Vista-M PX型电感藕合等离子体发射光谱仪分析Me-OL-1s催化剂的元素组成。
1.3 Me-OL-1s催化剂性能的评价
在配有气体计量装置的间歇式玻璃反应器上考察Me-OL-1s催化剂对TBHP歧化分解反应的催化性能。在反应器中依次加入一定量的催化剂和5 mL反应介质乙腈,用恒温水浴将反应体系加热至指定反应温度后,加入1 mL 65%(w)的TBHP水溶液,随后即刻封闭反应体系,并开始记录反应时间以及反应时间为t时量气管中的水面在反应前后的高度差,依据该高度差计算出氧气释放体积,并根据实验水温将其转化为标准状态下的体积,即得反应时间为t时TBHP 歧化分解反应的氧气释放体积(Vt)。在无副反应条件下,记录TBHP完全歧化分解(反应温度353 K)时的氧气释放体积并转化为标准状态下的体积,即得氧气释放总体积(V∞)。利用Vt/V∞可计算反应时间为t时TBHP的转化率。
反应完成后,通过离心分离除去反应母液中的固体催化剂颗粒,对采集的清液用Varian公司CP-3800型气相色谱仪(25 m长SE-30毛细管柱,FID)进行分析,采用面积归一化法计算其中的TBHP、叔丁醇和其他有机化合物的含量,并由此得出TBHP的转化率和叔丁醇的选择性。经验证,该方法计算的TBHP转化率与利用Vt/V∞计算的结果相近。本实验的TBHP转化率数据均由气相色谱分析结果计算而得。
2 结果与讨论
2.1 Me-OL-1s催化剂的表征结果
Me-OL-1s催化剂的XRD谱图见图1。

图1 Me-OL-1s催化剂的XRD 谱图Fig.1 XRD spectra of Me-OL-1s catalysts.
由图1可见,合成的所有Me-OL-1s催化剂均在2θ=12.52°,25.28°处出现对应于(001)和(002)晶面的水钠锰矿型氧化锰的特征峰,说明所合成的Me-OL-1s催化剂属于单斜晶系的水钠锰矿型氧化锰,由Bragg方程计算得到相应的晶面间距为0.71,0.35 nm。从图1还可看出,除水钠锰矿型氧化锰物相的特征峰外,所有Me-OL-1s催化剂的XRD谱图中均未出现其他杂相峰,说明所合成的Me-OL-1s催化剂的物相纯度很高。
表1为Me-OL-1s催化剂的ICP-AES元素分析结果,并同时给出了依据元素组成数据和文献[14]报道的方法计算出的各催化剂的分子式。由表1可看出,所合成的Me-OL-1s催化剂均含有所预期的层间正离子。

表1 Me-OL-1s催化剂的ICP-AES元素分析结果Table 1 ICP-AES elemental analysis of Me-OL-1s catalysts
2.2 Me-OL-1s催化剂对TBHP歧化分解反应的催化性能
2.2.1 反应温度的影响
反应温度对Me-OL-1s催化剂上TBHP歧化分解反应的影响见图2。
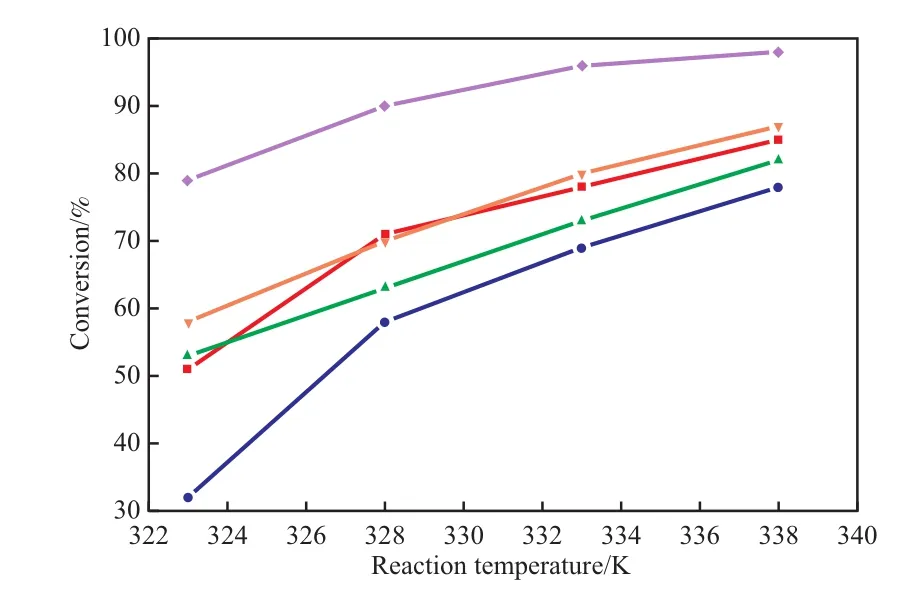
图2 反应温度对Me-OL-1s催化剂上TBHP歧化分解反应的影响Fig.2 Effects of reaction temperature on the disproportionation decomposition of tert-butyl hydroperoxide(TBHP)over the Me-OL-1s catalysts.
由图2可见,合成的所有Me-OL-1s催化剂均可催化TBHP的歧化分解反应,其中Cu-OL-1催化剂的活性最高。由图2还可看出,TBHP的转化率随反应温度的升高而增加,在323 K下Cu-OL-1催化剂上的TBHP转化率为79%;当反应温度升至338 K时,Cu-OL-1催化剂上的TBHP转化率达到98%。
2.2.2 反应时间的影响
反应时间对Me-OL-1s催化剂上TBHP歧化分解反应的影响见图3。

图3 反应时间对Me-OL-1s催化剂上TBHP歧化分解反应的影响Fig.3 Effects of reaction time on the disproportionation decomposition of TBHP over the Me-OL-1s catalysts.
由图3可看出,所合成的Me-OL-1s催化剂上的TBHP转化率均随反应时间的延长而增加。当反应时间为2 h时,Cu-OL-1催化剂上的TBHP转化率达100%,即TBHP全部歧化分解成叔丁醇和氧气;当反应时间为3 h时,Ni-OL-1催化剂上的TBHP转化率也达到100%,此时其他3种催化剂(K-OL-1,Mg-OL-1,Fe-OL-1)上的TBHP转化率均高于90%;当反应时间为4 h时,Fe-OL-1和Mg-OL-1催化剂上的TBHP转化率达到99%,明显高于K-OL-1催化剂。
2.2.3 催化剂用量的影响
从化学热力学和反应动力学的角度分析,对于一个选定的化学反应,催化剂用量不会影响其化学平衡,即不会影响反应底物的转化率和产物分布;但增加催化剂用量,通常会提高反应速率,缩短反应达到平衡的时间。对于工业固定床反应器,若所用催化剂的催化效率高,则可提高反应速率,缩短反应周期,并可在满足反应底物有一定转化率的前提下,最大限度地降低催化剂的用量,从而降低反应过程的生产成本,提高经济效益。
Me-OL-1s催化剂用量(基于TBHP水溶液和乙腈的总体积)对TBHP歧化分解反应的影响见图4。

图4 Me-OL-1s 催化剂用量对TBHP歧化分解反应的影响Fig.4 Effects of Me-OL-1s catalyst dosage on the disproportionation decomposition of TBHP.
由图4可看出,随Me-OL-1s催化剂用量的增大,TBHP的转化率增加。以K-OL-1催化剂为例,当K-OL-1催化剂用量为1.67 mg/mL时,TBHP的转化率为33%;当K-OL-1催化剂用量增至8.33 mg/mL时,TBHP的转化率提高至78%。由图4还可看出,Cu-OL-1催化剂具有极高的TBHP歧化分解反应活性,Cu-OL-1催化剂用量在1.67~8.33 mg/mL内,TBHP的转化率均达到96%以上。由此可见,相对于其他4种层间正离子(K+,Mg2+,Fe3+,Ni2+),Cu2+对于TBHP歧化分解反应的助催化作用较强,说明层间正离子Cu2+与骨架正离子Mn4+(或Mn3+)之间存在某种强协同效应,值得进一步深入研究。
此外,气相色谱分析发现,上述所有反应条件下均无有机副产物(如二叔丁基过氧化物、丙酮和甲醇等)生成,叔丁醇的选择性均为100%。在323~343 K、无催化剂条件下进行空白实验时无氧气释放,且气相色谱分析亦未发现有TBHP热分解产物生成,说明在选定的反应温度范围(323~338 K)内无TBHP热分解反应发生。
65%(w)TBHP水溶液和不同催化剂催化下反应产物的GC谱图见图5。由图5(a)可看出,338 K下反应体系中不加催化剂时,反应产物中只含有TBHP和乙腈;由图5(b)可看出,当用K-OL-1催化剂催化反应时,TBHP的转化率较低,反应产物中除反应底物TBHP和反应介质乙腈外还含有TBHP歧化分解反应的产物叔丁醇,未见其他有机物生成,表明叔丁醇的选择性为100%;由图5(c)可看出,当用Cu -OL-1催化剂催化反应时,TBHP完全歧化分解,反应产物中不含有TBHP,只含有乙腈和叔丁醇,叔丁醇的选择性仍为100%。

图5 TBHP歧化分解反应产物的GC谱图Fig.5 GC spectra of the products from the disproportionation decomposition of TBHP.
3 结论
1) 采用静态水热法合成的Me-OL-1s催化剂均为单斜晶系的水钠锰矿型氧化锰。
2) 在温和的反应条件(323~338 K)下,所合成的Me-OL-1s催化剂均对TBHP歧化分解反应具有活性,其中Cu-OL-1 催化剂的活性最高。
3) TBHP的转化率随反应温度的升高、反应时间的延长和Me-OL-1s催化剂用量的增大而增加。
4) 在65%(w)TBHP水溶液 1 mL、乙腈5 mL、Cu-OL-1催化剂用量8.33 mg/mL、反应温度338 K、反应时间2 h的条件下,TBHP歧化分解反应的TBHP转化率和叔丁醇选择性均达到100%。
[1] 崔云梓,付静,王喜正. 叔丁醇的生产技术及市场应用[J].齐鲁石油化工,2004,32(4):294 - 297.
[2] 张效龙,王志亮,高文斌. 铁卟啉催化叔丁基过氧化氢分解[J]. 山东化工,2012,41(3):20 - 27.
[3] Richardson W H. Metal Ion Decomposition of Hydroperoxides:Ⅳ. Kinetics and Products of Copper Salt Catalyzed Decomposition oft-Butyl Hydroperoxide[J].J Am Chem Soc,1966,88(5):975 - 979.
[4] Hendriks C F,Beek H C A. Reactions of Some Peracids and Hydroperoxides with Cobalt(Ⅱ) and Cobalt(Ⅲ) Acetate in Acetic Acid Solution[J].Ind Eng Chem Prod Res Dev,1979,18(1):38 - 43.
[5] Houghton R P,Rice C R. Cobalt(Ⅱ)-Catalyzed Decomposition of Hydroperoxides Implications for Alkane Functionalization[J].Polyhedron,1996,15(11):1893 - 1897.
[6] Hajdu P,Nemes I,Sűmegi L,et al. On the Kinetics of the Transition Metal Catalyzed Decomposition of Secondary Hydroperoxides[J].Int J Chem Kinet,1981,13(11):1191 -1202.
[7] Turrá N,Neuenschwander U,Baiker A,et al. Mechanism of the Catalytic Deperoxidation oftert-Butylhydroperoxide with Cobalt(Ⅱ) Acetylacetonate[J].Chem Eur J,2010,16(44):13226 - 13235.
[8] West Z J,Adams R K,Zabarnick S. Homogeneous Catalysis of Liquid-Phase Hydroperoxide Decomposition in Hydrocarbons[J].Energy Fuels,2011,25(3):897 - 904.
[9] Zhou Li,He Junhui,Zhang Jie,et al. Facile In-Situ Synthesis of Manganese Dioxide Nanosheets on Cellulose Fibers and Their Application in Oxidative Decomposition of Formaldehyde[J].J Phys Chem C,2011,115(34):16873 - 16878.
[10] Liu Linin,Tian Hua,He Junhui,et al. Preparation of Birnessite-Supported Pt Nanoparticles and Their Application in Catalytic Oxidation of Formaldehyde[J].J Environ Sci,2012,24(6):1117 - 1124.
[11] Amini M,Najafpour M M,Nayeri S,et al. Nano-Layered Manganese Oxides as Low-Cost,Easily Synthesized,Environmentally Friendly and Ef fi cient Catalysts for Epoxidation of Ole fi ns[J].RSC Adv,2012,2(9):3654 - 3657.
[12] Atribak I,Bueno-López A,García-García A,et al. Catalytic Activity for Soot Combustion of Birnessite and Cryptomelane[J].Appl Catal,B,2010,93(3/4):267 - 273.
[13] Wiechen M,Zaharieva I,Dau H,et al. Layered Manganese Oxides for Water-Oxidation:Alkaline Earth Cations In fl uence Catalytic Activity in a Photosystem Ⅱ-Like Fashion[J].Chem Sci,2012,3(7):2330 - 2339.
[14] Ma Ying,Luo Jian,Suib S L. Syntheses of Birnessites Using Alcohols as Reducing Reagents:Effects of Synthesis Parameters on the Formation of Birnessites[J].Chem Mater,1999,11(8):1972 - 1979.
(编辑 安 静)
Disproportionation Decomposition oftert-Butyl Hydroperoxide totert-Butyl Alcohol over Me-OL-1s Catalysts
Wang Lili1,Feng Lili2,Qi Lin1,Lu Shupei1,Qi Xingyi1
(1. Key Laboratory of Bio-Inspired Smart Interfacial Science and Technology of Ministry of Education, School of Chemistry and Environment, Beihang University, Beijing 100191, China; 2. Key Laboratory of Urban Stormwater System and Water Environment of Ministry of Education, Beijing University of Civil Engineering and Architecture, Beijing 100044, China)
Birnessite-type manganese oxides Me-OL-1s(Me:K,Mg,Fe,Ni and Cu) were synthesized by static hydrothermal method and characterized by XRD and ICP-AES. The oxides were used in the disproportionation decomposition oftert-butyl hydroperoxide(TBHP) totert-butyl alcohol.The effects of reaction temperature,reaction time and catalyst dosage were investigated. The results showed that all the Me-OL-1 catalysts had the catalytic activity under mild reaction conditions(323-338 K) and the activity of the Cu-OL-1 catalyst was the highest. The conversion of TBHP and the selectivity totert-butyl alcohol reached more than 96% and 100% under the conditions of 65%(w)TBHP aqueous solution 1 mL,reaction medium acetonitrile 5 mL,the Cu-OL-1 catalyst dosage(based on the total volume of TBHP aqueous solution and acetonitrile) 1.67-8.33 mg/mL,338 K and 1 h.
tert-butyl hydroperoxide;disproportionation decomposition;tert-butyl alcohol;birnessite;Me-OL-1s catalyst
1000 - 8144(2014)04 - 0430 - 05
TQ 223.1
A
2013 - 11 - 08;[修改稿日期]2013 - 12 - 08。
王丽丽(1989—),女,河南省许昌市人,硕士生,电邮 wangli20110101@126.com。联系人:冯利利,电话 010 -68322124,电邮 fenglili@bucea.edu.cn;齐兴义,电话 010 -82317126,电邮 qixy@buaa.edu.cn。
国家自然科学基金项目(51206009);北京市青年英才项目(21271413119)。

