参灵方对佐剂性关节炎大鼠胃黏膜损伤的保护机制研究
赵存方 张 竟 于荣屏
(中国人民解放军白求恩国际和平医院干部病房,河北 石家庄 050082)
1 中国人民解放军北京军区联勤部石家庄第二离职工部休养所,河北 石家庄 050000
类风湿关节炎(rheumatoid arthritis,RA)是一种以累及周围关节为主的多系统炎症性自身免疫性疾病[1],目前尚无特效治疗药物。RA可侵袭患者消化系统,且治疗药物也常可造成胃肠黏膜的损伤,使患者消化系统症状更加明显,是影响RA患者长期治疗的关键问题之一。本实验研究拟通过建立佐剂性关节炎(adjuvant arthritis,AA)大鼠模型,然后在给予参灵方灌胃干预治疗后,采用皮下注射吲哚美辛进一步诱导药源性胃黏膜损伤的疾病模型,观察大鼠胃黏膜组织的病理变化及胃黏膜细胞的凋亡情况,来探讨参灵方对AA大鼠胃黏膜损伤的干预保护机制,为临床用药提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠60只,雌雄各半,清洁级,体质量150~180g,由河北医科大学动物实验中心提供,合格证号:810146。
1.1.2 药品及试剂 参灵方,主要药物组成党参、黄柏、五味子,中国人民解放军白求恩国际和平医院中药房提供,取各等份中药39 g,加水超出药面2~3 cm,浸泡1 h,文火煎煮2次,每次40 min,浓缩成1 g/mL,冰箱保存备用;吲哚美辛(消炎痛)原药粉,江苏太仓制药厂,批号:070713;盐酸雷尼替丁胶囊,山西太原药业有限公司,国药准字H14022109,批号:070704;注射用卡介苗(50 mg/支),上海生物制品研究所,批号:20090312;原位缺口末端标记法(TUNEL)检测试剂盒,北京中杉金桥生物技术有限公司。
1.1.3 仪器 YSQ-SG46-280S不锈钢手提式高压蒸汽灭菌器,上海博讯实业有限公司;CS501型超级恒温水浴,上海浦东荣丰科学仪器有限公司;Olympus显微镜,日本奥林巴斯株式会社;CMIS-2011细胞医学图像分析系统,重庆天海医疗设备有限公司;Citadel2000脱水机,英国珊顿公司;YT-6B型烤片机,湖北孝亚光电子技术研究所;TMY-781B微波仪,浙江临安电子仪器厂。
1.2 实验方法
1.2.1 模型建立及分组 将60只大鼠随机抽取10只作为空白对照组,其余50只采用配制好完全弗氏佐剂,按每只大鼠0.1 mL于右后足跖皮内注射制作AA模型。次日即可出现足部肿胀,第4 d肿胀达到高峰,然后逐渐减轻,第10 d再次肿胀,造模19 d后,将出现二次反应的大鼠随机取30只,分为模型对照组、雷尼替丁对照组及参灵方组,每组10只。
1.2.2 灌胃给药 造模19 d后,雷尼替丁对照组予盐酸雷尼替丁胶囊30mg/(kg·d)灌胃;参灵方组予参灵方7 g/(kg·d)灌胃;空白对照组及模型对照组分别予等容积的0.9%氯化钠注射液灌胃。各组大鼠均灌胃28 d,于最后1次灌胃结束后各组大鼠禁食不禁水24 h,模型对照组、雷尼替丁对照组及参灵方组均腹部皮下注射吲哚美辛30 mg/Kg(溶于5%NaHCO3溶液中)进一步诱导药源性胃黏膜损伤模型,7 h后采集标本。
1.2.3 观察项目及方法
1.2.3.1 关节炎指数 观察记录各组大鼠灌胃前及灌胃28 d后全身关节病变程度,按5级评分法评价[2]。0分:无红肿;1分:有红色斑点或轻度肿胀;2分:关节部位中度肿胀;3分:严重肿胀;4分:关节变形,不能负重)。关节炎指数=四肢关节评分之和。
1.2.3.2 标本的采集及处理 将各组大鼠麻醉后打开胸腔,剖腹,在食管与贲门部做双重结扎,中间剪断,首先用镊子提起胃贲门部,切断靠近贲门的食管,一边牵拉,一边切断周围韧带,使胃同周围组织分离,结扎幽门后剪断,然后将胃取出,取胃后沿胃大弯侧剪开胃腔,采用磷酸盐缓冲液(PBS)冲洗净胃腔,在胃腺区的相同部位切取0.5 cm×1.0 cm组织块,以大头针放平固定在石蜡器皿上,放入4%多聚甲醛溶液中固定。光学显微镜观察胃黏膜组织病理变化,TUNEL法检测胃黏膜细胞凋亡情况.
1.3 统计学方法 采用SPSS 13.0统计软件进行统计学分析,计量资料用均数均数±标准差(±s)表示,各组间均数比较采用单因素方差分析,方差分析前进行方差齐性检验,采用LSD法进行组间两两比较。
2 结果
2.1 各组大鼠灌胃前及灌胃28 d后关节炎指数变化比较 见表1。
表1 各组大鼠灌胃前及灌胃28 d后关节炎指数变化比较分,±s
表1 各组大鼠灌胃前及灌胃28 d后关节炎指数变化比较分,±s
与空白对照组比较,* P<0.05
组 别 n 灌胃前 灌胃28 d后10 0 0模型对照组 10 15.31 ±1.43* 15.69 ±1.94*雷尼替丁对照组 10 14.38 ±1.91* 14.21 ±1.75*参灵方组 10 14.63 ±1.29* 13.09 ±1.13空白对照组*
由表1可见,灌胃前及灌胃28 d后模型对照组、雷尼替丁对照组及参灵方组关节炎指数与空白对照组比较差异均有统计学意义(P<0.05),说明AA大鼠模型复制成功。
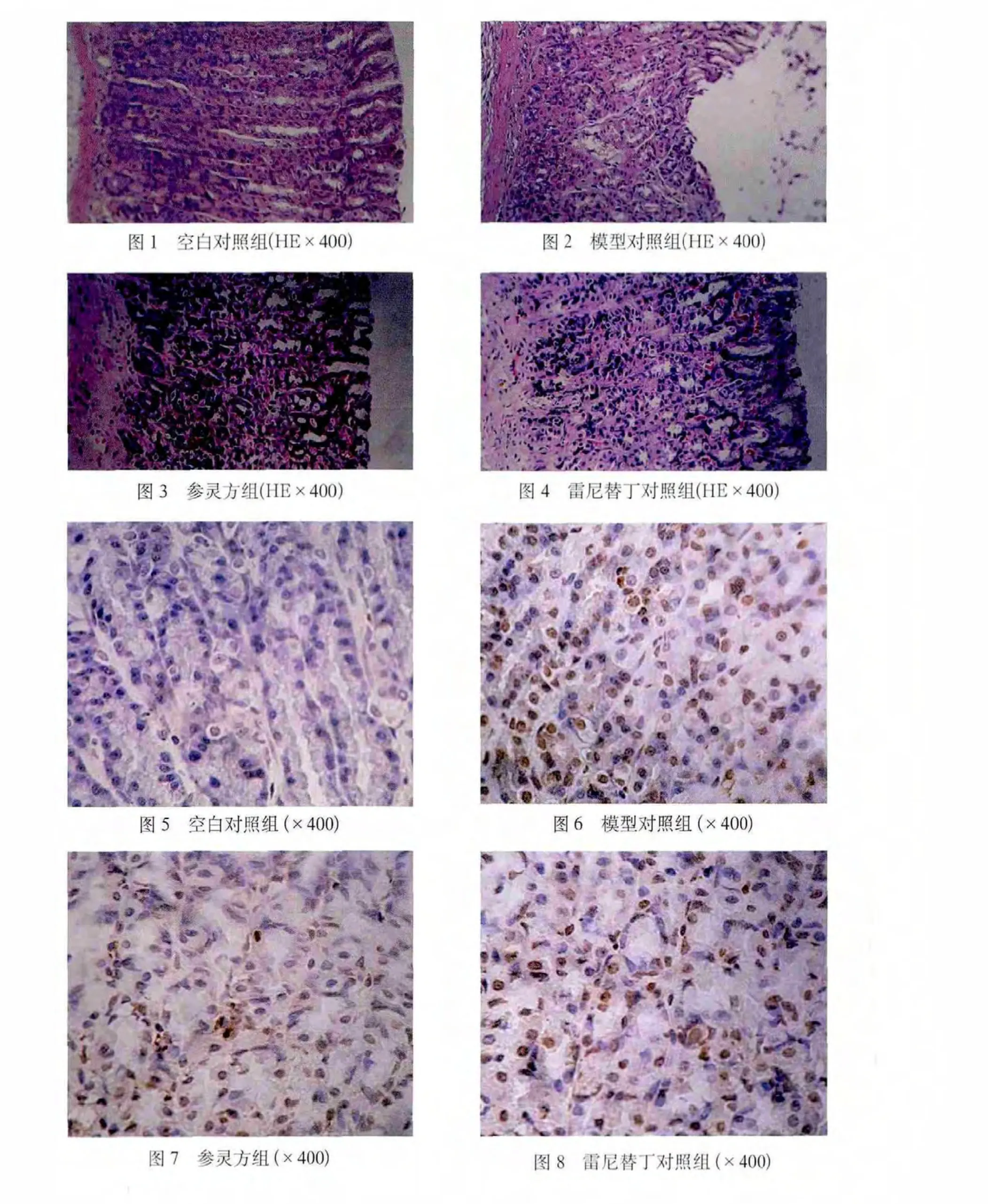
2.2 各组大鼠胃黏膜病理学观察 空白对照组大鼠胃黏膜结构层次清楚,上皮结构完整无损,腺体排列整齐(见封3,图1);模型对照组大鼠胃黏膜上皮细胞明显受损,脱落,上皮结构不完整,部分黏膜中断,局部腺体结构紊乱,黏膜表面及腺腔内较多脱落的上皮细胞碎片(坏死区可见少量含铁血黄素)及渗出物(可见大量炎性细胞浸润)(见封3,图2);参灵方组及雷尼替丁对照组大鼠胃黏膜局部上皮脱落较少,黏膜内血管充血,有少量炎细胞浸润(见封 3,图 3、图 4)。
2.3 各组大鼠胃黏膜细胞凋亡情况比较 见表2。
表2 各组大鼠胃黏膜细胞凋亡情况比较%,±s

表2 各组大鼠胃黏膜细胞凋亡情况比较%,±s
与空白对照组比较,*P<0.05;与模型对照组比较,△P<0.05
组 别 n 细胞凋亡指数空白对照组10 5.65 ±0.72模型对照组 10 56.61 ±7.82*雷尼替丁对照组 10 38.63 ±5.67△参灵方组 10 32.39 ±4.62△
空白对照组大鼠胃黏膜凋亡细胞主要位于表面上皮细胞内,呈簇状分布或单个散在分布,TUNEL阳性反应物质为棕黄色,位于细胞核内(浓缩的核质紧贴于核膜,或核质呈现均匀的染色)(见封3,图5)。由表2可见,模型对照组胃黏膜细胞凋亡指数与空白对照组比较差异有统计学意义(P<0.05),明显增加(见封3,图6);雷尼替丁对照组及参灵方组胃黏膜细胞细胞凋亡指数与模型对照组比较差异有统计学意义(P<0.05),均明显下降(见封3,图7、图8),而雷尼替丁对照组与参灵方组比较差异无统计学意义(P>0.05),说明2组均减少了AA大鼠的胃黏膜细胞凋亡,且疗效相当。
3 讨论
RA病因至今并不十分明了,在其发病过程中本身可造成消化系统损害。刘健等[3]研究表明,AA大鼠胃黏膜细胞超微结构病变率升高,表现为线粒体肿胀变性,棘突破坏和消失,胃黏膜细胞凋亡率高于正常组,这可能是RA患者胃黏膜损伤的原因之一。另外,抗风湿药物也常引起的消化系统损害。国外研究人员调查发现,RA患者服用阿司匹林胃溃疡发病率为80.6%,而正常人服用阿司匹林发病率仅为44.8%,且25%的药物副作用报告是由非甾体抗炎药(NSAIDs)引起[4-5]。
细胞凋亡是细胞程序性死亡方式,胃黏膜正常结构的维持有赖于上皮细胞凋亡与细胞增殖之间的动态消长平衡,细胞凋亡在胃黏膜损伤修复过程中起着重要的调控作用[6],已证实正常胃黏膜细胞存在凋亡,这是一种以基因表达、DNA合成为特征的细胞主动死亡过程,在正常情况下,2种蛋白在胃黏膜都有表达并保持动态平衡,如细胞凋亡过度必将破坏胃黏膜的完整性,进而造成胃黏膜的损伤,因此细胞凋亡与增殖之间的失衡是胃黏膜损伤发生的重要因素,胃黏膜损伤与各种刺激导致胃黏膜上皮细胞的凋亡密切相关[7-8]。
参灵方为纯中药方剂,具有健脾益气、和胃燥湿之功。方中党参益气健脾;黄柏清热燥湿,解毒疗疮;五味子收敛固涩,益气生津。有研究证实,党参对胃黏膜具有较好的保护作用[9],党参注射液能够上调超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSH-Px)的表达,提示党参能抵抗氧自由基损伤,属强抗氧化药物[10]。复方黄柏液具有明显的抗感染及促进伤口愈合的作用[11]。五味子具有抗损伤、抗氧化、抗溃疡、抗应激及抑菌作用,去氧五味子素可抑制胃酸分泌,有显著的抗溃疡作用[12]。
本实验结果表明,空白对照组大鼠胃黏膜结构层次清楚,上皮结构完整无损。模型组大鼠胃黏膜上皮细胞明显受损,脱落,上皮结构不完整,胃黏膜细胞凋亡明显增加。参灵方组大鼠经参灵方干预治疗后,胃黏膜局部上皮脱落较少,凋亡指数也明显下降,说明参灵方减少了AA大鼠吲哚美辛引起的胃黏膜细胞凋亡,其可能是通过增加细胞增殖、减少细胞凋亡而抑制胃黏膜细胞损伤,从而发挥胃黏膜保护作用。
[1]Firestein GS.Evolving concepts of rheumatoid arthritis[J].Nature,2003,423(6937):356-361.
[2]张均田.现代药理实验方法[M].北京:北京医科大学出版社,1997:1383.
[3]刘健,夏伦祝,冯艺戎,等.以AnnexinV/PI法检测新风胶囊对AA大鼠滑膜、胸腺及胃黏膜细胞凋亡的影响[J].安徽医药,2004,8(1):14-16.
[4]Matsukawa Y,Aoki M,Nishinarita S,et al.Prevalence of Helicobacter pylori in NSAID users with gastric ulcer[J].Rheumatology(Oxford),2003,42(8):947-950.
[5]Andrianakos A,Trontzas P,Christoyannis F et al.Prevalence and management of rheumatoid arthritis in the general population of Greece--the ESORDIG study[J].Rheumatology(Oxford),2006,45(12):1549-1554.
[6]Spyridon L,Akira N,Hiromasa K,et al.The development of the endothelin-1-induced gastric ulcer:time sequence analysis of morphologic changes[J].Int J Exp Pathol,1994,75(5):345-355.
[7]Que FG,Gores GJ.Cell death by apoptosis:basic concepts and disease relevance for the gastroenterologist[J].Gastroenterology,1996,110(4):1238-1243.
[8]Konturek PC,Brzozowski T,Konturek SJ,et al.Apoptosis in gastric mucosa with stress-induced gastric ulcers[J].J Physiol Pharmacol,1999,50(2):211-225.
[9]Wang ZT,Du Q,Xu GJ,et al.Investigations on the protectiveaction of Condonopsis pilosula(Dangshen)extract on experimentally-induced gastric ulcer in rats[J].Gen Pharmacol,1997,28(3):469-473.
[10]黄丽亚,叶嗣颖.党参注射液上调氧化酶表达作用的实验研究[J].中国老年学杂志,2006,26(1):70-71.
[11]郭鸣放,宋建徽,谢彦华,等.复方黄柏液促进伤口愈合的实验研究[J].河北医科大学学报,2001,22(1):11-14.
[12]姜燕,贾有志.日本五味子木脂素成分研究概况[J].国外医学:植物学分册,1991,6(3):106-111.

