宫颈癌患者外周血中髓源抑制细胞比例变化及CD73的表达*
封全灵,王红丽,张 毅,史惠蓉,张 斌
1)郑州大学第三附属医院妇产科 郑州 450052 2)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 3)郑州大学第一附属医院妇产科 郑州 450052 4)美国芝加哥西北大学医学院血液肿瘤中心 芝加哥 60611
宫颈癌是严重威胁妇女健康的疾病,宫颈癌的发生与机体免疫功能下降有关。肿瘤细胞与机体免疫系统相互作用,最终使肿瘤细胞产生了免疫逃逸的功能[1-2]。髓源抑制细胞(myeloid-derived suppressor cells,MDSCs)能够抑制T细胞介导的抗肿瘤免疫反应[3]。肿瘤患者外周血MDSCs的表达与肿瘤发生发展关系密切,在前列腺癌、肺癌、结肠癌、乳癌等肿瘤组织中均可检测到MDSCs,可发挥不同机制的免疫抑制功能[4]。近来发现CD73是一种重要的免疫抑制分子[5],相关动物实验[6-7]表明小鼠MDSCs上CD73表达增高,进而使胞外核苷酸酶增多,腺苷聚集,发挥免疫抑制功能。而MDSCs是否与宫颈癌患者的细胞免疫功能抑制有关及宫颈癌MDSCs介导的T细胞免疫抑制作用与CD73的表达是否有关,尚不清楚。该研究探讨了宫颈癌患者外周血中粒细胞样髓源抑制细胞(granulocytic-MDSCs,G-MDSCs)和单核细胞样髓源抑制细胞(monocytic-MDSCs,M-MDSCs)的比例变化及CD73在两群MDSCs上的表达,为宫颈癌的免疫治疗提供依据,并为进一步研究MDSCs在宫颈癌免疫抑制中的作用奠定基础。
1 材料与方法
1.1 临床资料 收集2012年12月至2013年6月郑州大学第一附属医院及第三附属医院宫颈癌初治患者术前外周血标本37例。患者年龄25~75(47.2 ±9.3)岁;鳞癌23 例,腺癌14 例;国际妇产科联盟(FIGO)临床分期:Ⅰ期11例,Ⅱ期16例,Ⅲ、Ⅳ期10例;低分化16例,中、高分化21例;有淋巴结转移13例,无淋巴结转移24例。所有患者均经宫颈活检或手术病理检查证实。21例健康者作对照,年龄26~72(45.4±11.5)岁。健康者及患者均无其他系统疾病。
1.2 标本的制备 清晨空腹状态下采用无菌静脉穿刺术采集患者及健康人外周静脉血6 mL,肝素钠抗凝。离心后弃上层血清,生理盐水稀释,以体积比2∶1加入人淋巴细胞分离液(上海华清生物高科技有限公司产品),2500 r/min离心25 min,吸管提取单个核细胞层,生理盐水稀释后洗细胞2次,1500 r/min离心10 min,弃上清。调整细胞密度至106mL-1。
1.3 G-MDSCs、M-MDSCs及 CD73 表达的检测采用流式细胞术。PE-cy7-CD11b抗体、APC-cy7-CD14抗体、FITC-CD73抗体及相应的同型对照IgG2-PE-cy7抗体、IgG2-APC-cy7抗体、IgG2-FITC抗体购自美国BD公司。将每份标本细胞分离后均分成2份,转至1.5 mL离心管中备用(每个离心管100 μL)。在超净工作台中上述离心管底部分别加入PE-cy7-CD11b抗体、APC-cy7-CD14抗体、FITCCD73抗体及同型对照抗体(对照),充分混匀后至4℃避光孵育15~20 min,后加300 μL PBS缓冲液并混匀悬浮细胞,流式细胞仪检测。以同型对照流式管作为对照管,检测时在前向-侧向散射光(FSCSSC)的二维散射图形上先确定外周血单个核细胞分布,以 CD11b+CD14+细胞为 M-MDSCs,CD11b+CD14-细胞为G-MDSCs,圈选出两群细胞后,再分析CD11b+CD14+细胞中CD73阳性的细胞即为MMDSCs上CD73的表达水平,CD11b+CD14-细胞中CD73阳性的细胞即为G-MDSCs上CD73的表达水平。
1.4 统计学处理 采用SPSS 17.0进行分析。宫颈癌患者与健康者外周血中G-MDSCs、M-MDSCs及其CD73的表达、不同临床特征的宫颈癌患者MDSCs及其CD73表达差异比较采用单因素方差分析或两独立样本t检验。检验水准α=0.05。
2 结果
2.1 2组外周血中G-MDSCs及 M-MDSCs的比例变化及CD73的表达 见表1。
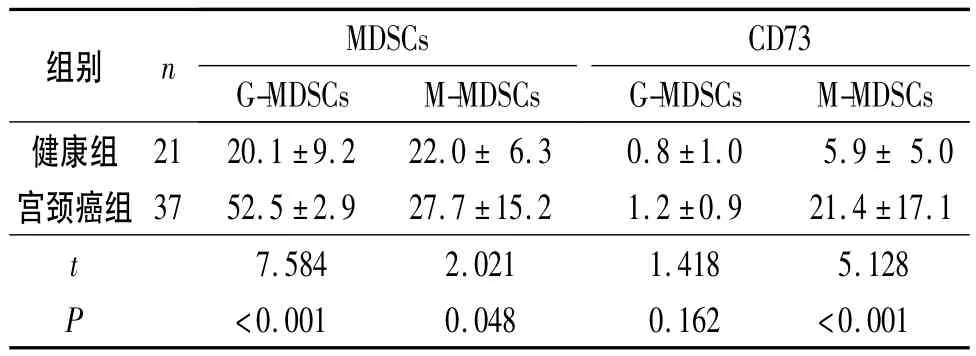
表1 2组外周血中MDSCs的比例变化及CD73的表达 %
2.2 宫颈癌患者外周血MDSCs及CD73的表达与临床特征的关系 宫颈癌组外周血中G-MDSCs的比例及其CD73的表达与病理类型、临床分期、分化程度及淋巴结转移均无关(P>0.05),M-MDSCs比例及其CD73的表达水平与临床分期有关,临床分期越高,M-MDSCs及其CD73表达水平越高(P<0.05);宫颈癌组外周血中M-MDSCs上CD73的表达与淋巴结转移有关(P<0.05)。见表2。
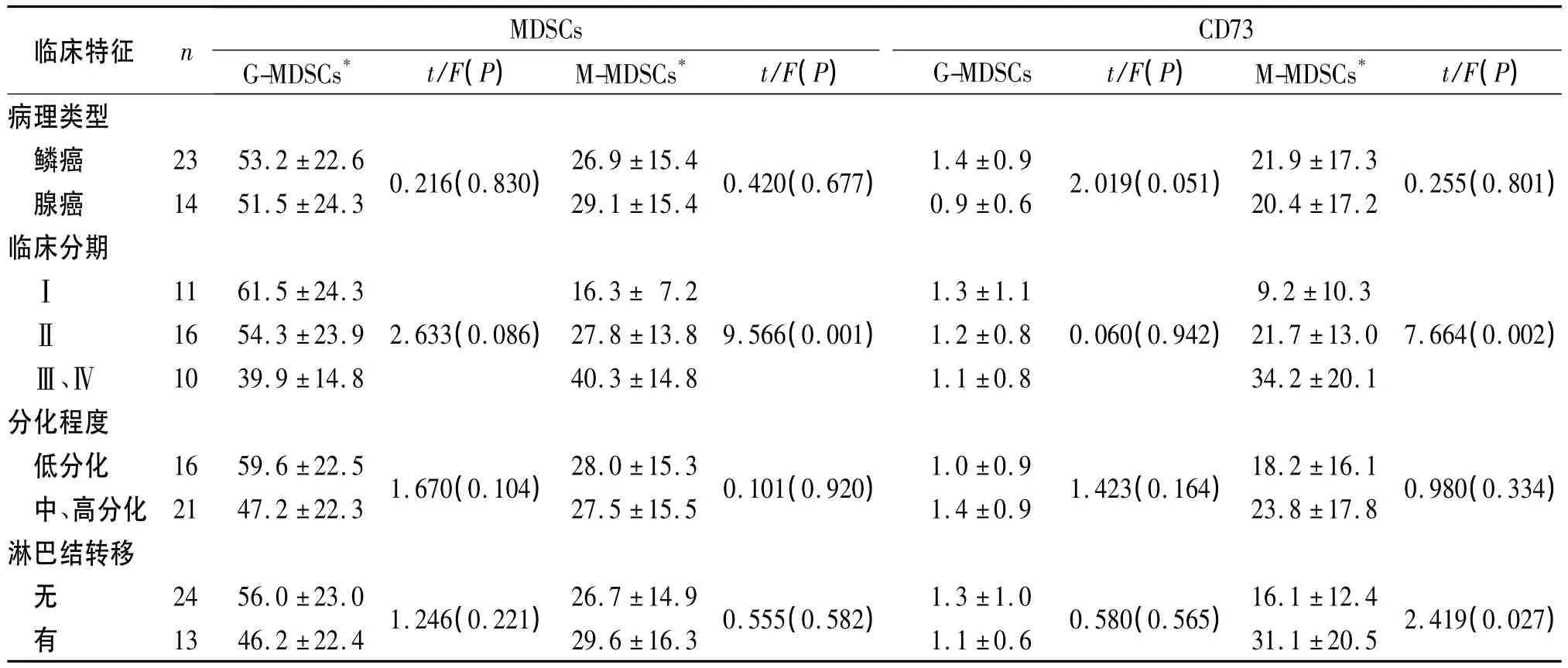
表2 宫颈癌患者外周血中MDSCs比例及其CD73的表达与临床特征的关系 %
3 讨论
MDSCs是一群未成熟的髓系细胞的异质性群体,在外周器官激活后发挥免疫抑制和逃逸的功能,在病理情况下,未成熟髓样细胞分化受阻而大量聚集,即为MDSCs[3]。人类MDSCs缺乏特异性表面标志物[8],不同肿瘤患者体内 MDSCs表型不尽相同[9-10]。Feng等[11]在非小细胞肺癌研究中认为,CD11b+CD14+为M-MDSCs标志物,CD11b+CD14-为G-MDSCs标志物,该研究MDSCs的表型分类亦是基于此原理。
Feng等[11]的研究表明肺癌患者 M-MDSCs和G-MDSCs的比例较正常组都升高,但在患者外周血中M-MDSCs的比例较G-MDSCs高,根据实体瘤的疗效评价,进展期肿瘤中M-MDSCs的比例最高,并且有临床相关性。Diaz-Montero等[12]发现乳癌患者外周血中MDSCs的比例与肿瘤的分级相关。该实验第一步对两群MDSCs在宫颈癌患者中的分布进行研究,结果显示G-MDSCs、M-MDSCs在患者外周血中的分布较健康组增加,M-MDSCs表达与患者的临床分期有关,表明宫颈癌患者体内肿瘤细胞相关因子可诱导其外周血MDSCs比例的上调,MDSCs与宫颈癌的发生关系密切;随着临床分期的增加,宫颈癌患者M-MDSCs的比例也明显升高,宫颈癌患者外周血M-MDSCs水平可能与病情进展有关,与上述研究结果一致;但患者外周血中M-MDSCs比例较GMDSCs低,考虑可能和肿瘤细胞差异性及不同肿瘤体内MDSCs分泌的相关抑制性细胞因子有关。
MDSCs通过多条途径抑制机体细胞免疫功能而发生肿瘤免疫逃逸:可高表达精氨酸酶和诱导性一氧化氮合酶,参与L-精氨酸代谢使T细胞上CD3 ζ链表达减少,抑制T细胞增殖等[4];高表达活性氧族、过氧亚硝酸盐等,通过细胞接触方式诱导T细胞功能下降[13];另外,也可通过分泌多种细胞因子如 TGF-β、IL-10、PGE2 等起抑制作用[14]。CD73 在肺癌、胰腺癌、卵巢癌等多种恶性肿瘤组织中呈高表达[5],在缺氧条件下,促使肿瘤微环境中腺苷聚积,从而发挥免疫抑制效应[15]。MDSCs能够诱导调节性T细胞(Treg)产生,而Tregs上CD73过表达使腺苷聚集而发挥免疫抑制作用。相关动物实验[6-7]表明小鼠MDSCs上CD73表达增高,促进MDSCs发挥免疫抑制功能。
目前发现两群MDSCs能通过不同的作用机制抑制机体免疫功能的正常发挥[14]。实验第二步就两群MDSCs上CD73的表达进行研究,在外周血中G-MDSCs上CD73低表达,且与健康组相比差异无统计学意义;CD73在宫颈癌组M-MDSCs上高表达,且与病理分期和淋巴结转移有关。由于不同病理环境中MDSCs所处的机体微环境不同,可致MDSCs抑制机体免疫功能机制有差异,有研究[3]表明GMDSCs在免疫抑制中也发挥重要作用,但该研究表明G-MDSCs可能不通过诱导CD73的表达而是其他的作用方式抑制机体免疫功能,关于G-MDSCs免疫抑制的具体途径及参与的相关肿瘤细胞因子有待进一步的探讨;宫颈癌患者外周血中M-MDSCs上CD73的高表达且与临床分期相关,提示M-MDSCs与疾病进展密切相关,CD73是其参与抑制机体免疫功能的机制之一。
综上所述,宫颈癌患者外周血中MDSCs比例与肿瘤的发生发展相关,M-MDSCs的水平可能与患者病情进展相关,CD73是M-MDSCs发挥免疫抑制的重要分子之一。以上结果丰富了MDSCs发挥免疫抑制机制的研究,为进一步研究MDSCs在宫颈癌免疫抑制中的机制奠定基础,并为宫颈癌的临床诊断和免疫治疗提供新的思路和方法。
[1]Dunn GP,Bruce AT,Ikeda H,et al.Cancer immunoediting:from immunosurveillance to tumor escape[J].Nat Immunol,2002,3(11):991
[2]Dunn GP,Old LJ,Schreiber RD.The three Es of cancer immunoediting[J].Annu Rev Immunol,2004,22:329
[3]Duffy A,Zhao F,Haile L,et al.Comparative analysis of monocytic and granulocytic myeloid-derived suppressor cell subsets in patients with gastrointestinal malignancies[J].Cancer Immunol Immunother,2013,62(2):299
[4]Ochoa AC,Zea AH,Hernandez C,et al.Arginase,prostaglandins,and myeloid-derived suppressor cells in renal cell carcinoma[J].Clin Cancer Res,2007,13(2 Pt 2):721
[5]Jin D,Fan J,Wang L,et al.CD73 on tumor cells impairs antitumor T-cell responses:a novel mechanism of tumor induced immue suppression[J].Cancer Res,2010,70(6):2245
[6]Kobie JJ,Shah PR,Yang L,et al.T regulatory and primed uncommitted CD4 T cells express CD73,which suppresses effector CD4 T cells by converting 5’-adenosine monophosphate to adenosine[J].J Immunol,2006,177(10):6780
[7]Ryzhov S,Novitskiy SV,Goldstein AE,et al.Adenosinergic regulation of the expansion and immunosuppressive activity of CD11b+Gr1+cells[J].J Immunol,2011,187(11):6120
[8]Peranzoni E,Zilio S,Marigo I,et al.Myeloid-derived suppressor cell heterogeneity and subset definition[J].Curr Opin Immunol,2010,22(2):238
[9]Liu CY,Wang YM,Wang CL,et al.Population alterations of L-arginase and inducible nitric oxide synthase-expressed CD11b+CD14-CD15+CD33+myeloid-derived suppressor cells and CD8+T lymphocytes in patients with advancedstage non-small cell lung cancer[J].J Cancer Res Clin Oncol,2010,136(1):35
[10]Mandruzzato S,Solito S,Falisi E,et al.IL4+Ralpha+myeloid-derived suppressor cell expansion in cancer patients[J].J Immunol,2009,182(10):6562
[11]Feng PH,Lee KY,Chang YL,et al.CD14+S100A9+monocytic myeloid-derived suppressor cells and their clinical relevance in non-small cell lung cancer[J].Am J Respir Crit Care Med,2012,186(10):1025
[12]Diaz-Montero CM,Salem ML,Nishimura MI,et al.Increased circulating myeloid-derived suppressor cells correlate with clinical cancer stage,metastatic tumor burden,and doxorubicin-cyclophosphamide chemotherapy[J].Cancer Immunol Immunother,2009,58(1):49
[13]刘鑫,李杰,刘秋燕.靶向髓系抑制性细胞抗肿瘤治疗策略研究进展[J].肿瘤研究与临床,2010,22(4):283
[14]Ostrand-Rosenberg S,Sinha P.Myeloid-derived suppressor cells:linking inflammation and cancer[J].J Immunol,2009,182(8):4499
[15]Sitkovsky MV,Kjaergaard J,Lukashev D,et al.Hypoxiaadenosinergic immunosuppression:tumor protection by T regulatory cells and cancerous tissue hypoxia[J].Clin Cancer Res,2008,14(19):5947

