“用水萃取乙酸乙酯溶液中的乙酸”实验设计的缺陷分析
李东芳 付 渊 李纯毅 王志平
(1.集宁师范学院化学系,内蒙古 乌兰察布 012000;2.内蒙古化工职业学院,内蒙古 呼和浩特 010010)
1 引言
萃取是分离和提纯有机化合物常用的操作之一,是学生必须掌握的基本实验技能之一。师范院校常用教材中的萃取实验设计为用乙醚萃取醋酸水溶液中的醋酸[1],但在实验教学过程中,教学人员发现作为基本操作技能训练,该实验存在一些缺点[2]。2003年,张力[3]等人对萃取实验进行了研究,分别用正丁醇、乙酸乙酯为溶剂,水为萃取剂来萃取其中的乙酸,最后用NaOH溶液滴定水溶液中的乙酸,以此计算乙酸的萃取率。研究结果表明,在同样条件下,在正丁醇、乙酸乙酯中乙酸的萃取率分别为77﹪和89﹪。
从该实验结果来看,用水萃取乙酸,选用乙酸乙酯作为溶剂,效果优于选用正丁醇。
该实验设计分层快、易操作,且以水为萃取剂经济、环保,符合绿色化学实验的要求,因此该实验作为训练学生的基本操作技能是可行的。但是笔者认为,若以乙酸乙酯为溶剂,在实验设计上有一些缺点,为此,笔者对用水萃取乙酸乙酯溶液中乙酸的实验进行了详细的研究。研究结果表明,该实验设计会造成乙酸的萃取率偏高,同时在一定温度下,乙酸在乙酸乙酯与水中的分配系数逐渐降低,且变化幅度较大。
2 用水萃取乙酸乙酯溶液中乙酸的理论依据
萃取是利用同一种物质在两种互不相溶的溶剂中具有不同溶解度的性质,将其从一种溶剂内转移到另外一种溶剂中,从而实现分离或提纯的一种方法[4]。选择的萃取剂要求:与原溶剂不相混溶且不起化学反应、对被提取物质溶解度大、纯度高、沸点低、毒性小、价格低[5]。

?
从表1原料的主要物理常数来看,乙酸与水混溶,即乙酸在水中的溶解性极好;乙酸乙酯溶于水,但不与水混溶,虽然乙酸乙酯在水中可缓慢地发生水解,但是把乙酸乙酯和乙酸混合配制成混合溶液后,由于掺入了乙酸,可有效抑制乙酸乙酯的水解,即在乙酸存在下,乙酸乙酯不与水发生水解反应。从以上分析可知,用水萃取乙酸乙酯溶液中的乙酸在理论上是可行的。
3 对该萃取实验设计缺陷的详细研究
3.1 实验试剂
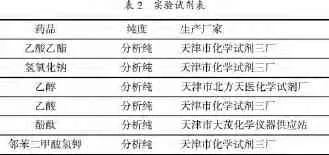
?
3.2 实验方法
用移液管准确量取10ml乙酸与乙酸乙酯的混合液,放入分液漏斗中,用一定量的水萃取。加入水后,上下轻轻振摇分液漏斗,每隔几秒钟将漏斗倒置(活塞朝上),小心打开活塞,以平衡内外压力,重复2-3次,然后再用力振摇相当的时间。将分液漏斗置于铁圈,当溶液分成两层后,小心旋开活塞,放出下层水溶液于50ml锥形瓶内,加入3-4滴酚酞作指示剂,用标准氢氧化钠溶液滴定[6]。
3.3 基本溶液的配制与标定
3.3.1 配制0.2mol/L氢氧化钠溶液
称取4.0g氢氧化钠固体于小烧杯中,向小烧杯中加入蒸馏水50ml。使其全部溶解后,转入500ml试剂瓶中。再加蒸馏水至刻线处,盖上瓶盖,摇匀。
3.3.2 配制酚酞溶液
取0.5g酚酞,用95﹪乙醇稀释至 100ml,制成0.5﹪酚酞乙醇溶液。
3.3.3 配制混合溶液
配制乙酸与乙酸乙酯比例不同的两种混合液,其中混合液A中乙酸与乙酸乙酯的体积比为1:9;混合液B中乙酸与乙酸乙酯的体积比为1:19。
3.3.4 氢氧化钠溶液的标定
称取0.4-0.5g已干燥过的邻苯二甲酸氢钾3份于锥形瓶中,加入20-30ml蒸馏水溶解。在3份溶液各加入1-2滴酚酞。用已配制好的氢氧化钠溶液滴定至微红色,记录实验数据。
3.4 萃取率和分配系数的计算公式
萃取率和分配系数的计算公式分别见公式(1)和公式(2)。


3.5 实验结果
在4只250ml分液漏斗中,分别加入2.0ml、5.0ml、7.0ml、10.0ml蒸馏水,再分别加入 10ml混合溶液。振荡15分钟,静置分层,将下层水样分别放入4只50ml锥形瓶中,然后用氢氧化钠溶液滴定,计算萃取率和分配系数。实验结果见表3和图 1。
从表3可以看出,随萃取剂——水的用量的增加,乙酸的萃取率也在增加,这是正常的实验结果。但是当萃取剂的用量增加到20 ml时,在混合液A与B中,乙酸的萃取率分别高达132.7﹪和126.0﹪。这一反常现象出现的原因,是因为乙酸乙酯可溶于水,且溶解在水中的乙酸乙酯也会和NaOH发生化学反应,当在萃取后的水溶液中滴入NaOH溶液计算乙酸的萃取率时,除了萃取在水中的乙酸外,溶解在水中的乙酸乙酯也会和NaOH发生化学反应,也要消耗NaOH,因此会使消耗的NaOH总量偏高,也就造成萃取在水中的乙酸总量偏高,从而导致乙酸的萃取率偏高。如果萃取剂水的用量较多,溶解在水中的乙酸乙酯越多,就出现了萃取率超过百分之百的反常现象。

?

在一定温度下,若萃取剂与原溶剂不起化学反应,也不互溶,分配系数应该基本上是一常数[7]。从图1可以看出,随萃取剂——水的用量的增加,乙酸在乙酸乙酯与水中的分配系数逐渐降低,且变化幅度较大。这一反常现象还是因为溶解在水中的乙酸乙酯和NaOH发生了化学反应,使消耗的NaOH总量偏高,使得萃取在水中的乙酸量在计算时偏高,从而使乙酸在蒸馏水中的浓度偏高,乙酸在乙酸乙酯中的浓度偏高,最终导致乙酸在乙酸乙酯与水中的分配系数呈下降趋势。
4 结论
综上所述,“用水萃取乙酸乙酯溶液中的乙酸”实验设计存在一定的缺陷,该实验设计会造成乙酸的萃取率偏高,同时在一定温度下,乙酸在乙酸乙酯与水中的分配系数逐渐降低,且变化幅度较大。
[1]曾昭琼 .有机化学实验[M].北京:高等教育出版社,2000,54—57.
[2]王琳,向纪明.萃取实验的一点改进[J].安康师专学报,2000,12(2):78—81.
[3]张力,张应年,白林.化学实验的绿色化研究——萃取[J].甘肃高师学报,2003,8(5):8—9.
[4]熊洪录,周莹,于兵川.有机化学实验[M].北京:化学工业出版社,2011,28.
[5]蔡良珍,虞大红.大学基础化学实验(Ⅱ)[M].北京:化学工业出版社,2012,21.
[6]曾昭琼.有机化学实验[M].北京:高等教育出版社,1987,56.
[7]杨高文.基础化学实验(有机化学部分)[M].南京:南京大学出版社,2010,80.

