两类阴极菌群微生物燃料电池降解硝酸盐研究
程建萍, 孙秋阳, 胡淑恒, 陈少华, 汪家权
(1.合肥工业大学 机械与汽车工程学院,安徽 合肥 230009;2.合肥工业大学 资源与环境工程学院,安徽 合肥 230009;3.安徽建筑大学 材料与化学工程学院,安徽 合肥 230601)
0 引 言
微生物燃料电池(microbial fuel cell,简称MFC)可在降解有机污染物的同时收获电能,为降低污染修复的成本提供了可能,因而近年来受到了广泛关注[1]。MFC通常由阳极室和阴极室组成,两极室之间以质子交换膜(或盐桥)作为间隔。在阳极室,厌氧微生物降解有机物(电子供体)产生电子和质子,电子通过阳极和外电路的传递到达阴极,质子则通过质子交换膜(或盐桥)的内部传递到达阴极,两者在阴极室与电子受体(如氧气)反应生成最终产物。目前,研究大多集中于对阳极有机物的降解,如相同结构的单极室空气阴极型 MFC,分别以纤维素[2]、苯酚废水[3]、啤酒废水[4]和市政污水[5]等为阳极电子受体,MFC在产电的同时使得这些废水中的有机物得以降解。但是,对于阴极的电子受体,除了常见的氧气[6]外,水体污染物硝酸盐也已被证实可用于MFC产电并被降解[7]。可见,尝试利用不同性质的有机物作为阴极的电子受体,可使得MFC的应用范围进一步扩大。无氧环境下,硝酸盐、硫酸盐、铁、锰和二氧化碳等都可为阴极的最终电子受体[8]。相对于贵重金属催化剂昂贵的成本,生物阴极利用自然界广泛存在的微生物作为催化剂,可以大大减少成本,由此研究人员开展了生物阴极的研究。20世纪60年代,反硝化细菌把硝酸盐还原为氮气的发现,促成了生物阴极概念的提出,然而直到最近这一观点才被证实。文献[9]发现MFC阴极中的微生物参与了一些生物反应,如氨氧化和反硝化作用,这表明了阴极有氮循环过程。文献[10]发现硝酸盐在阴极被还原为氮气过程中,硝酸盐及其中间产物亚硝酸盐都可以接受电极提供的电子得到还原,但其还原过程必须有微生物的参与,且有微生物存在时显著增强反硝化作用。文献[11]成功实验了生物阴极反硝化反应,阳极中氧化电子供体产生电子,电子通过外电路到达阴极,硝酸盐在阴极室得到电子被还原,且不需要提供外在的电能反而在与生物阴极构建的MFC实现了能源的回收。文献[12]构建的双室生物阴极MFC在开路和闭合情况下均能降解硝酸盐,且MFC促进硝酸盐反硝化过程的进行。以上研究结果均表明硝酸盐在MFC的阴极得到电子被还原。
但是对于阴极上微生物群落的不同对整个MFC运行过程的影响研究还不多见,本文将2种不同类型的微生物接种于阴极,研究它们对整个反应过程中产电、硝酸盐降解的影响,并解释这2种MFC阴极上微生物与电子之间电子传递的过程与原理,对揭示通过生物阴极降解硝酸盐的电子传递机理有一定的理论意义。
1 材料和方法
1.1 实验装置及材料
微生物燃料电池反应器的示意图如图1所示。它的结构是整体式双室,阴阳两室均为长方体的有机玻璃容器,长、高、宽分别为15、15、13cm,在阴极室和阳极室的上下端均设有进、出样口;多孔筛板式盐桥连接双室,类似一面墙,100个平行的孔道在墙的横截面上均匀分布,孔径均为3mm,长度10mm,注入盐桥的溶液实际体积为190mL;阴、阳极电极材料均为碳布,有效面积为64cm2;阳极与阴极之间采用铜导线连接,外接电阻100Ω,构成回路,并在电阻两端接上电压表,在线连续监测输出电压。
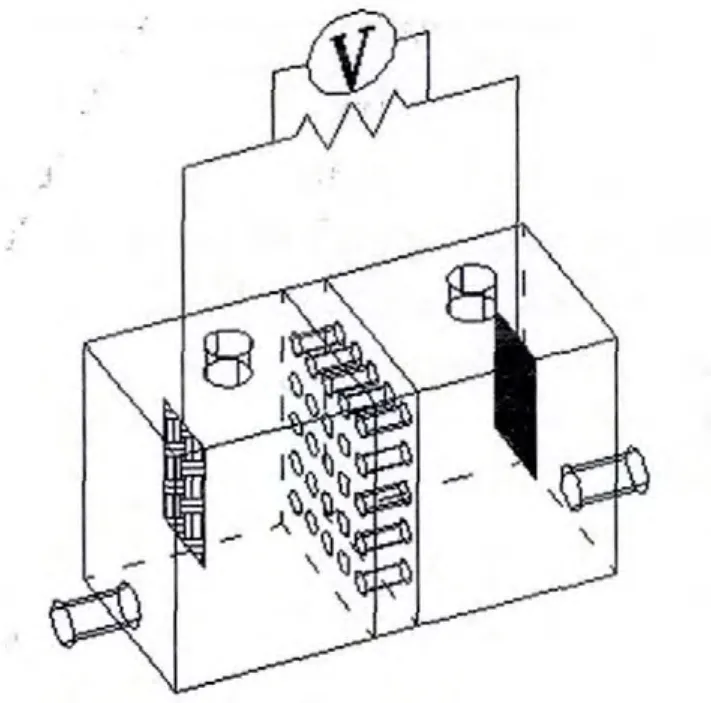
图1 微生物燃料电池反应器的示意图
1.2 MFC的微生物接种与运行
取合肥市某污水处理厂A2/O工艺中的好氧污泥和厌氧污泥等体积混合,以污泥上清液为微生物燃料电池的接种液,投加1000mg/L葡萄糖作为MFC的阳极燃料,并添加磷酸盐缓冲溶液(K2HPO4的质量浓度6.571g/L,KH2PO4的质量浓度2.883g/L)、无机盐(KCl的质量浓度0.13g/L,NH4Cl的质量浓度0.31g/L)、微量元素(质量浓度12.5g/L)和维生素(质量浓度5g/L);MFC启动时阴极采用铁氰化钾作为电子受体,来驯化阳极,经过几个周期的稳定运行后,最大输出电压在500mV以上,将阴极的铁氰化钾溶液替换成硝酸溶液,添加相同质量浓度的磷酸盐缓冲溶液、无机盐、微量元素和维生素,并分别添加2种菌种,待MFC产电及对硝酸盐的去除效率稳定后,即开始记录相关数据;阴极室接种使用的菌群分别来自活性污泥取自朱砖井城市污水处理厂A2/O工艺中的好氧污泥、厌氧污泥和直接购买的反硝化菌(bacillus,Seattle Science and Technology,USA),并根据阴极室菌群不同标记微生物燃料电池为A-MFC和B-MFC。
1.3 分析与测试方法
MFC的输出电压通过数据采集卡(研华PCI1713型,精度大于10mV)连续采集,最终记录的电压信号输出至计算机,由专用软件记录分析,记录频率为400s/min,如无特别提到,MFC运行时外电阻均为1000Ω。
2 结果分析
2.1 MFC的产电性能
以合肥市某污水处理厂A2/O工艺中的好氧污泥、厌氧污泥中的混菌和纯反硝化菌作为MFC生物阴极上的菌群,菌群的A-MFC和B-MFC连续运行4个周期的输出电压如图2所示。

图2 2种阴极微生物MFC的输出电压
由图2可知,A-MFC初始外接电阻1000Ω时,电池最高输出电压达到了280mV,第1个产电周期结束,更换阳极溶液,输出电压迅速升高至265mV,更换外接电阻100Ω,电压迅速下降至100mV左右,随后的周期内,保持外接电阻为100Ω,输出最高电压一般维持在100mV左右,每个周期运行时间平均约为300h,且都存在单一峰值;B-MFC初始外接电阻100Ω,第1个产电周期电压只能达到80mV左右,更换阳极室溶液后,电压上升达到109.9mV,随后的2个周期内输出电压一般维持在100mV左右,每个周期运行时间平均约为200h,且都存在单一峰值,其中第1周期时间运行最长,接近400h,随着时间推移,接下来的周期运行时间越来越短,第4周期仅维持在100h。
2.2 硝酸盐的降解
为了检测MFC对阴极体系中硝酸盐的降解和形态转换效果,实验对水样中的三氮即的质量浓度分别进行了测定。MFC中阴极室中硝酸盐的起始质量浓度为100mg/L,经过一定时间的运行处理,出口处三氮的质量浓度变化如图3所示。
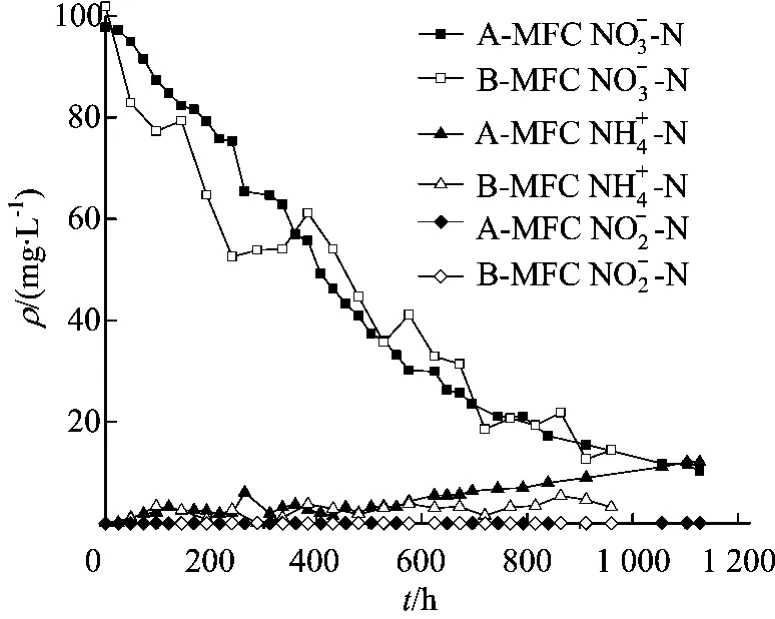
图3 阴极室中和质量浓度变化曲线
由图3可知,硝酸盐在接种2种不同的微生物阴极上均发生了降解。A-MFC经过1128h运行,阴极出口处的质量浓度从起始的97.74mg/L下降到10.2mg/L,平均反硝化速率为1.86mg/(L·d),而 B-MFC阴极出口处的经过960h质量浓度从101.9mg/L下降到 14.43mg/L, 平均反硝化速率为2.19mg/(L·d),B-MFC平均反硝化速率比 AMFC的大 0.33mg/(L·d);A-MFC阴极室在72h累积量值达到最大,即0.49mg/L,200h后基本检测不到,而B-MFC阴极室一直处于波动状态,在528h时达到最大累积量为6.41mg/L;而 AMFC中累积量一直处于上升状态,最大累积量为12.07mg/L,B-MFC中的质量浓度呈波动上升趋势,在864h时累积量达到最大,为5.39mg/L。
2.3 生物阴极表面生物膜的相态分析
为了观察阴极室中活性污泥接种的碳布和反硝化细菌接种的碳布表面形态及菌落生长情况,分别对运行前后的碳布取样,经过适当预处理后进行SEM观察,结果如图4所示。由图4可看出,未运行前碳布的纤维丝表面光滑;A-MFC活性污泥接种的碳布阴极在1个周期运行结束后,纤维丝表面覆盖了一层多孔状结构,细菌多附着在孔状结构上;B-MFC反硝化细菌接种的阴极碳布,纤维丝表面形成了一种片层状结构。

图4 阴极碳布表面的SEM图
2.4 阴极电极的电化学氧化还原性能
研究电极和溶液里的电化学行为,是从微观的角度描述MFC系统中细菌和电极等在MFC运行过程中作用机理的一种方法。以磷酸盐缓冲溶液作为三电极体系中电化学反应的溶液介质,分别对MFC阴极系统中阴极液和阴极电极采用循环伏安法,探讨阴极体系的电化学行为。初始未挂膜的碳布和实验结束后的阴极生物膜碳布作为工作电极,得到的循环伏安曲线图如图5所示。由图5可知,阴极碳布的电化学活性随着反应的时间有很大的变化,对于初始未挂膜的碳布,在电压扫描过程中得到的电流非常低,几乎为0,也没有发现还原峰;而运行结束后的阴极碳布,已经实现了生物挂膜,它的循环伏安曲线中出现了一个很明显的还原峰,其位置在-0.282V,对应的电流为-6.644×10-5A。
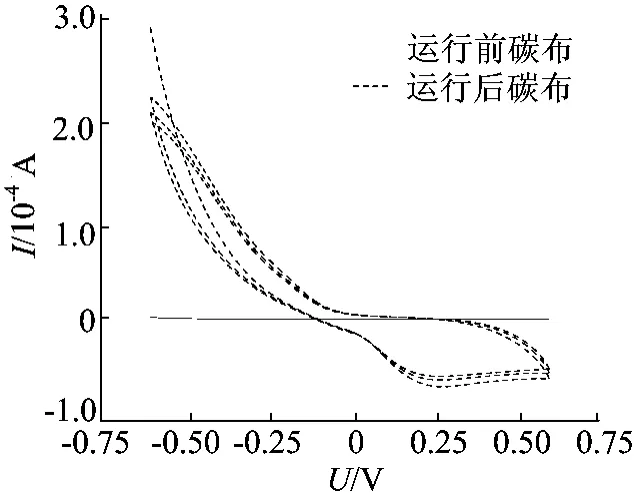
图5 阴极室溶液的循环伏安曲线
以挂膜的碳布作为工作电极,测试了不同时间段阴极溶液的循环伏安曲线如图6所示。
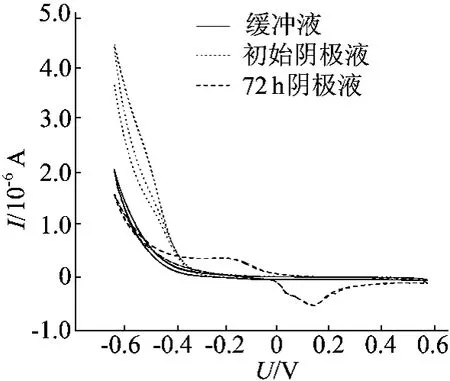
图6 阴极碳布的循环伏安曲线
由图6可知,磷酸盐缓冲溶液和初始阴极液扫描过程中电流均非常低,几乎为0,也没有发现氧化还原峰;而运行了72h后的阴极溶液循环伏安曲线上,有一对明显的氧化还原电对,其氧化峰位置在-0.14V处,还原峰位置在0.167V处,对应的氧化还原响应电流区间为-5.35×10-7~3.46×10-7A。
3 讨 论
以100mg/L的硝酸盐作为MFC阴极的电子受体,分别在阴极室中添加2种不同的混菌和纯反硝化菌,进行厌氧反硝化反应,2种MFC均运行了4个周期,其产电趋势趋于一致,虽然产电时间长短略有不同,但是对阴极碳布上采用活性污泥接种运行的A-MFC,阴极微生物是多样的,而对比阴极采用单一反硝化菌接种运行的BMFC,在相同的外界电阻为100Ω时可以发现,两者的输出电压一般稳定在100mV,阴极单一反硝化菌对MFC的输出电压无明显的抑制影响,这说明阴极微生物菌群的多样性与MFC的输出电压没有直接的关系。
从阴极体系中硝酸盐的降解和形态转换效果来看,硝酸盐在接种2种不同的微生物阴极上均发生了降解和转换。经过4个周期的运行,AMFC中阴极平均反硝化速率比B-MFC小0.33mg/(L·d),可能是B-MFC中接种的纯反硝化细菌对硝酸盐的降解具有较强的针对性;同时A-MFC阴极室在72h累积量值达到最大,200h后基本检测不到亚硝酸盐,B-MFC阴极室一直处于波动状态,在528h时达到最大累积量为6.41mg/L,两者的不同主要是由于实验过程中B-MFC阴极室添加了1g/L的NaHCO3,NaHCO3既可以维持反硝化细菌的生长需要,同时又可以进行传统的反硝化作用,导致累积量较多呈波动状态,但其阴极室中总体上并无累积增加的趋势,主要是由于硝酸盐和亚硝酸盐能够交替作为阴极细菌的电子受体[13];实验还发现,A-MFC中累积量一直处于上升状态,最大累积量值为12.07mg/L,B-MFC中量呈波动上升趋势,在864h时累积量达到最大为5.39mg/L,阴极室中累积量的增加并非由于阳极室中经盐桥泄露而来,这可能是由于阴极室中无有机碳源,微生物进行内源反硝化产生了NH3,NH3溶于水,导致溶液中不断累积增加。
本文采用SEM观察A-MFC和B-MFC中2种细菌接种的碳布表面形态,发现A-MFC中碳布被孔状结构物覆盖了全部的碳布纤维丝,而BMFC形成的片层状结构较稀疏,这可能是两者的微生物菌落不同,且活性污泥接种驯化的阴极碳布运行的时间较长,而反硝化细菌驯化的阴极碳布运行时间较短。
经过MFC运行4周期后的阴极电极碳布,循环伏安曲线图扫描过程中出现了1个很明显的还原峰,其位置在-0.282V处,对应的电流为-6.644×10-5A,这说明附着在阴极生物膜上富集的细菌进行的是一种催化还原反应,该过程与MFC阴极发生的硝酸盐被还原的反应一致;对比阴极溶液经过MFC运行前后的CV曲线可知,阴极溶液在MFC中运行72h后,在循环伏安曲线上有1对明显的氧化还原电对,这说明阴极溶液中也确实存在氧化还原介体,主要是负责在微生物和电极之间进行电子的传递,并且阴极和阳极存在的氧化还原电对是不同的,另外,该MFC体系中并无添加其他氧化还原介体,初始阴极溶液的循环伏安曲线中也并未发现氧化还原电对,说明形成该氧化还原电对的氧化还原介体是由微生物新陈代谢分泌到细胞外的某种物质组成的,证实本实验的MFC体系中确实存在电子穿梭传递机制。
4 结 论
阴极接种活性污泥和反硝化细菌的MFC产电性能均良好,在产电的同时均能有效地去除废水中的硝酸盐。在外接电阻为100Ω的情况下,A-MFC和B-MFC达到的最大输出电压分别为119.6mV和117.2mV,表明阴极微生物菌群的多样性与MFC的输出电压没有直接的关系;同时,B-MFC在阴极室的平均反硝化速率为2.19mg/(L·d)比 A-MFC的平均反硝化速率1.86mg/(L·d)略高,这说明接种的纯反硝化细菌对硝酸盐的降解具有较强的针对性。
对经过运行一段时间后的阴极碳布,通过SEM观察到A-MFC和B-MFC的碳布纤维丝表面形貌存在差异,A-MFC中碳布被孔状结构物覆盖了碳布纤维丝,而B-MFC被形成的片层状结构物所覆盖,这说明在阴极起作用的微生物类型不同。
采用循环伏安曲线法来测定阴极碳布和阴极溶液,结果表明阴极碳布上接种的2种菌群均发生催化还原反应;运行72h的阴极溶液和阳极溶液均发现了氧化还原电对,说明本实验的MFC体系中确实存在电子穿梭体的传递机制,推断电子传递的主要任务是由电极上的电活性微生物完成的。
[1]Logan B E,Rabaey K.Conversion of wastes into bioelectricity and chemicals using microbial electrochemical technologies[J].Science,2012,337:686-690.
[2]Ren Zhiyong,Ward T E,Rfgan J M.Electricity production from cellulose in a microbial fuel cell using a defined binary culture[J].Environmental Science & Technology,2007,41(13):4781-4786.
[3]丁巍巍,汪家权,吕 剑,等.微生物燃料电池处理苯酚废水[J].合肥工业大学学报:自然科学版,2010,33(1):94-96,142.
[4]Wen Qing,Wu Ying,Zhao Lixin,et al.Production of electricity from the treatment of continuous brewery wastewater using a microbial fuel cell[J].Fuel,2010,89(7):1381-1385.
[5]Luo Haiping,Liu Guangli,Zhang Renduo,et al.Phenol degradation in microbial fuel cells[J].Chemical Engineering Journal,2009,147(2/3):259-264.
[6]Hou Bin,Hu Yongyou,Sun Jian.Performance and microbial diversity of microbial fuel cells coupled with different cathode types during simultaneous azo dye decolorization and electricity generation[J].Bioresource Technology,2012,111:105-110.
[7]Park H I,Kim D K,Choi Y J,et al.Nitrate reduction using an electrode as direct electron donor in a biofilm-electrode reactor[J].Process Biochem,2005,40:3383-3388.
[8]Stams A J,De Bok F A,Plugge C M,et al.Exocellular elec-tron transfer in anaerobic microbial communities[J].Environ Microbial,2006,8(3):371-382.
[9]Holmes D E,Bond D R,O’Neill R A,et al.Microbial communities associated with electrodes harvesting electricity from a variety of aquatic sediments[J].Microbial Ecology,2004,48(2):178-190.
[10]Chen G W,Choi S J,Cha J H,et al.Microbial community dynamics and electron transfer of a biocathode in microbial fuel cells[J].Korean J Chem Eng,2010,27(5):1513-1520.
[11]Fang C,Min B,Angelidaki I.Nitrate as an oxidant in the cathode chamber of a microbial fuel cell for both power generation and nutrient removal purposes[J].Appl Biochem Biotechnol,2011,164(4):464-474.
[12]汪家权,夏雪兰,陈少华,等.两类微生物燃料电池治理硝酸盐废水的实验研究[J].环境科学学报,2011,31(2):254-259.
[13]Di Lorenzob M,Scottb K,Curtisa P T,et al.Effect of increasing anode surface area on the performance of a single chamber microbial fuel cell[J].Chemical Engineering Journal,2010,156(1):40-48.

