miRNA 146a对软骨细胞MMP 13表达的影响
张清,曹参,钟航,黄泽宇,杨静
(四川大学华西医院骨科,四川 成都 610000)
实验研究
miRNA 146a对软骨细胞MMP 13表达的影响
张清,曹参,钟航,黄泽宇,杨静*
(四川大学华西医院骨科,四川 成都 610000)
目的研究在正常软骨细胞及中期和晚期骨关节炎(osteoarthritis,OA)软骨细胞中上调或下调miRNA 146a后基质金属蛋白酶13(matrix metallopeptidase 13,MMP 13)的表达变化规律。探索miRNA 146a在骨关节炎发生、发展中的作用。方法收集正常人膝关节软骨4 例,骨关节炎患者膝关节软骨12 例。骨关节炎组又依据Kellgren-Lawrence的放射学诊断标准分为中期和晚期骨关节炎。通过化学转染的方法转染miRNA 146a mimic或miRNA 146a inhibitor于各组软骨细胞,测定上调或下调miRNA 146a后,MMP 13蛋白水平表达的变化。结果正常人软骨细胞中上调miRNA 146a后,MMP 13的蛋白水平较对照组及抑制组均出现明显的上升,结果具有统计学意义;下调miRNA 146a后,MMP 13蛋白水平下降,结果没有统计学意义。中期OA软骨细胞表达MMP 13水平高于晚期OA软骨细胞,差异具有统计学意义。中期OA软骨细胞上调miRNA 146a后,MMP 13的蛋白水平上升,结果具有统计学意义;抑制miRNA 146a后,MMP 13的蛋白水平下降,结果具有统计学意义。晚期OA软骨细胞上调miRNA 146a后,MMP 13的蛋白水平上升,结果具有统计学意义;晚期OA软骨细胞抑制miRNA 146a后,MMP 13的蛋白水平下降,结果具有统计学意义。结论miRNA 146a可调控软骨细胞MMP 13表达,从而参与骨关节炎的发生、发展。
骨关节炎;miRNA 146a;MMP 13;RNA干扰
近年来,生物医学研究发现真核生物普遍存在miRNAs的转录后调控作用,已成为许多学科研究的热点。报道显示[3],miRNA 146a在OA软骨细胞中表达较正常软骨细胞升高,特别是在轻度OA软骨细胞中表达升高尤其明显,然后又逐渐降低。本研究旨在探讨miRNA 146a调控MMP 13在正常软骨细胞及不同阶段OA软骨细胞中的作用及机制,对探寻OA的发病机理及为将来基因治疗提供理论依据。
1 对象与方法
1.1 对象 取因外伤行截肢的膝关节正常股骨髁软骨(4 例),根据病史、X线片、术中肉眼观察、术后镜下病理学排除标本退行性变、肿瘤、结核、感染、类风湿炎症和明显骨质疏松等以及并存免疫系统疾病、糖尿病等全身性疾病。根据美国风湿病学会1995年修订的膝关节骨关节炎诊断标准诊断为膝关节骨关节炎需行全膝关节置换术(total knee arthroplasty,TKA)患者股骨髁软骨(12 例),根据病史、X线片、术中肉眼观察、术后镜下病理学等排除膝关节其他病变以及并存免疫系统疾病、糖尿病等全身性疾病,并且根据Kellgren-Lawrence的放射学诊断标准分为中期(3级)OA组6 例和晚期(4级)OA组6 例。收集患者一般资料,其中正常组男性4 例,29~37 岁,平均32.2 岁,左侧1 例,右侧3 例。OA组12 例,男4 例,女8 例,年龄57~85 岁,平均68.1 岁,左侧8 例,右侧4 例。
1.2 方法
1.2.1 软骨细胞培养 用含青霉素(100 U/mL)、链霉素(100 μg/ mL)的磷酸盐缓冲液(petal bovine serum,PBS)冲洗从关节置换取下的无菌膝关节软骨组织置于无菌培养皿数次后,将软骨修剪至1 mm×1 mm×1 mm大小;将3倍体积的胰蛋白酶加入软骨碎片中,放入恒温箱,37℃消化下振荡40 min,弃去上清液,加双抗的磷酸盐缓冲液冲洗3次;然后添加三倍体积的Ⅱ型胶原酶消化,37℃恒温箱振荡4~6 h后,低温离心(2 800 r/min,5 min),弃去上清液,Dulbecco氏培养基(Dulbecoo′s modified eagle medium,DMEM)F12培养液冲洗3次;加入含10%胎牛血清的DMEM/F12培养基终止消化;将细胞接种于25 cm2培养瓶内(5 mL/瓶),置于37℃恒温,5%CO2培养箱内培养。培养中使用倒置相差显微镜观察细胞贴壁生长情况和形态,待细胞贴壁后再第一次换液,以后每2~3天换液一次。原代培养细胞的覆盖超过瓶子底部面积的80%时传代。
1.2.2 转染 转染前一天,接种适当数量的细胞至细胞培养板中,每孔中加入不含抗生素的培养基,使转染时的细胞密度能够达到30%~50%;在含有细胞的1 500 μL培养基的培养孔中加入miRNA 146a mimic/inhibitor-lipo 2000混合液混匀;培养6 h后,将孔中含mimic/inhibitor-lipo 2000混合液的培养基移去,更换新鲜培养基;将培养板置于37℃的CO2培养箱中培养48~97 h。
各组使用的试剂及剂量:对照组:含10%FBS的DMEM培养基培养;上调组:miRNA 146a mimic 2.5μg+Lipo 2000 5 μg+10%的DMEM(L)2 mL;下调组:miRNA 146a inhibitor 75pmoL+Lipo2000 7.5 μL+10%的DMEM(L)2 mL。
1.2.3 Western-Blot检测MMP 13蛋白表达 每条泳道以40 μg蛋白量上样,行7.5%SDS-聚丙烯酰胺凝胶电泳分离蛋白,湿法转移将蛋白电转到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,用5%脱脂奶粉封闭1 h,加入指定的一抗4℃孵育过夜,杂交反应。以磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GADPH)为内参。
1.2.4 统计学分析 每组实验均重复3次及以上,所有数据均以均数±标准差表示,采用SPSS 17.0统计学软件进行方差分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 正常软骨细胞干扰miRNA 146a后MMP 13的表达变化 正常人类软骨细胞中,上调miRNA 146a后,MMP 13的蛋白水平较正常及抑制组均出现明显的上升,结果具有统计学意义;抑制miRNA 146a后,MMP 13蛋白水平下降,结果没有统计学意义(见图1)。
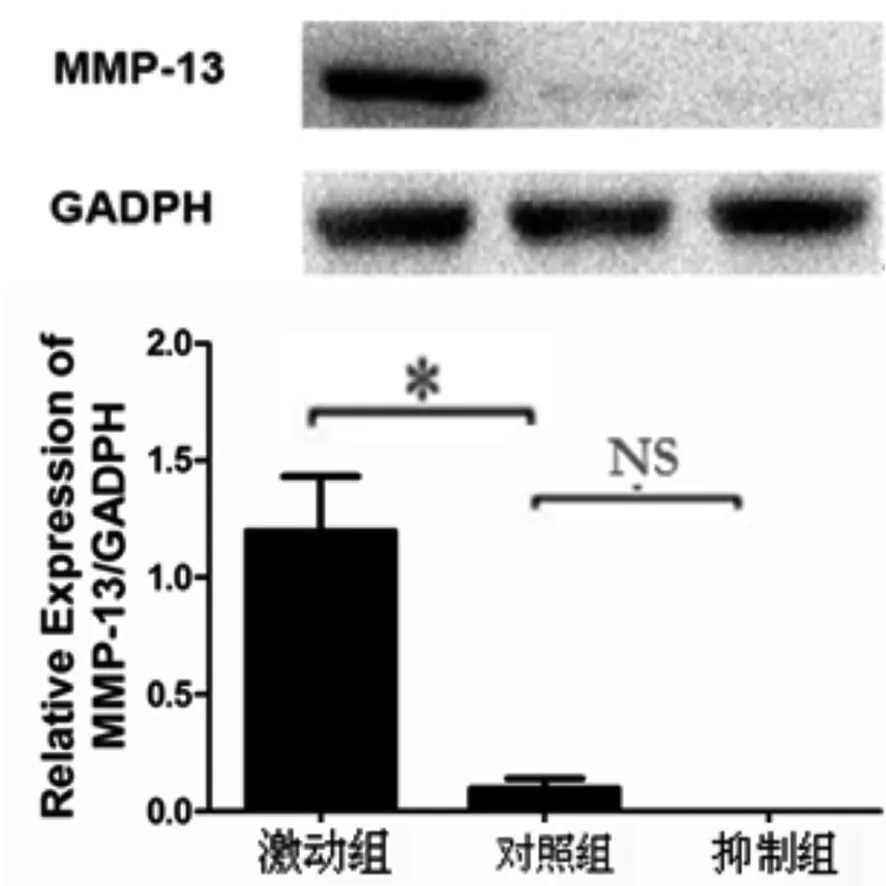
图1 干扰正常软骨细胞miRNA 146a后MMP 13变化
2.2 中期和晚期OA软骨细胞干扰miRNA 146a后MMP 13的表达变化 中期OA软骨细胞表达MMP 13水平高于晚期OA软骨细胞,差异具有统计学意义。中期和晚期OA软骨细胞中,上调miRNA 146a后,MMP 13的蛋白水平出现相应的上升,结果具有统计学意义。中期OA软骨细胞中,抑制miRNA 146a后,MMP 13的蛋白水平出现相应的下降,结果具有统计学意义。晚期OA软骨细胞中,抑制miRNA 146a后,MMP 13的蛋白水平下降,结果具有统计学意义,且中期OA软骨细胞的MMP 13的下降幅度明显大于晚期OA软骨细胞(见图2~3)。
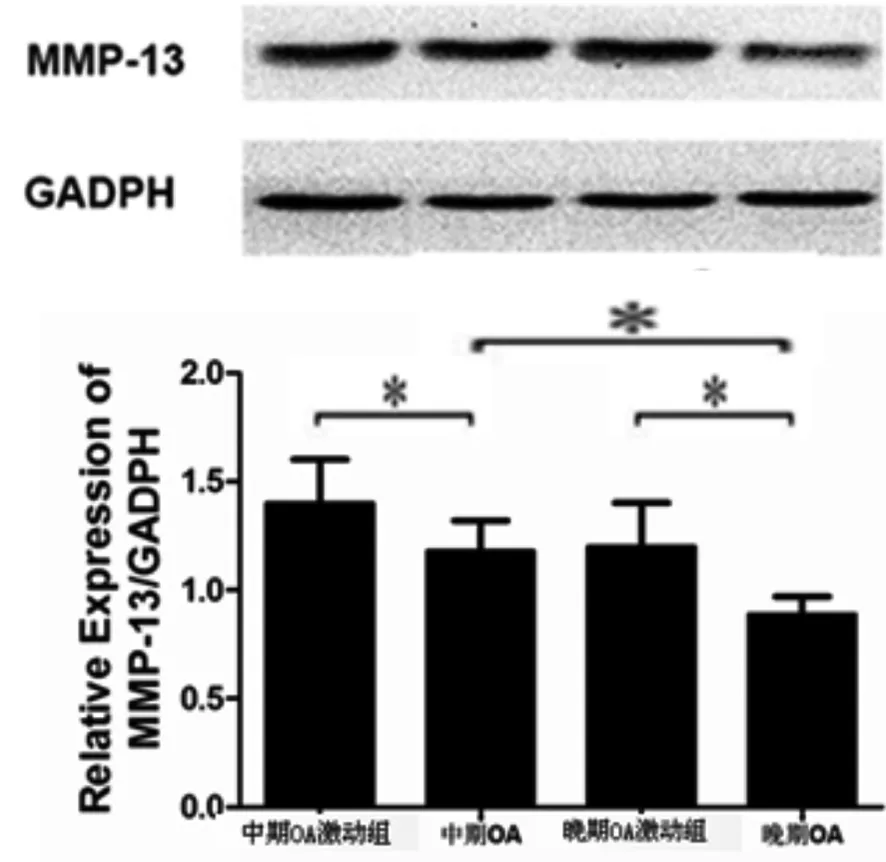
图2 上调中期、晚期OA软骨细胞miRNA 146a后MMP 13变化
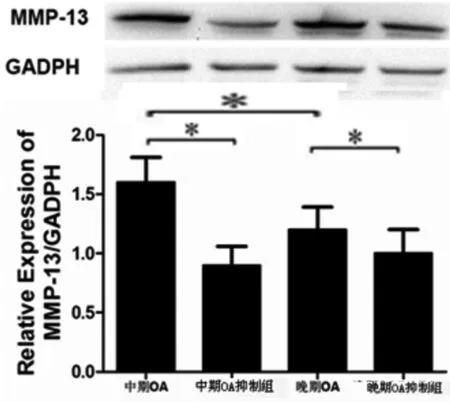
图3 下调中期、晚期OA软骨细胞miRNA 146a后MMP 13变化
3 讨 论
MMPs是一类广泛存在于结缔组织中的结构相似、酶活性依赖于Zn2+的蛋白酶超家族,其主要生物活性是降解细胞外基质中的各种基质蛋白,此外激活的MMPs还可切除MMPs酶原的前肽使其激活而产生正反馈式放大效应。MMPs可以通过直接降解或间接影响其他细胞因子和炎性因子水平参与ECM的生理和病理重建[4]。MMPs在体内的多个层面受到严格的调控,其中组织源性基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinases,TIMPs)是组织局部MMPs活性最重要的调节因素[5]。在正常情况下,局部MMPs与TIMPs的水平处于平衡状态,使软骨保持正常的结构与功能。MMPs与TIMPs在正常关节中的表达量极低,而在OA患者关节软骨和滑膜中MMPs的表达明显升高。OA时MMPs的表达明显升高,造成MMPs与TIMPs之间的平衡失调,导致关节软骨细胞外基质中的蛋白多糖和弹力纤维、Ⅱ型胶原等降解增加,关节软骨破坏,这是关节软骨退变、进而发生OA的基本环节[6]。MMPs在OA发生发展中的作用受到广泛的关注,其中研究最多的是MMP 13,其对Ⅱ型胶原的分解能力最强,是其他胶原酶分解强度的10倍[7],同时还能分解Ⅰ、Ⅲ、Ⅳ、Ⅹ、型胶原和蛋白聚糖,被认为是OA软骨退变的核心因素之一[8]。过表达MMP 13的老鼠关节可出现和OA相同的表现[9]。
Taganov等[10]通过筛查人类单核细胞中表达的200多个miRNAs,得出miRNA 146a/b是内毒素响应性基因,可为微生物基质和前炎症因子等所诱导。Yamasaki等[3]通过对OA患者软骨细胞miRNA 146a的基因表达谱的研究发现,miRNA 146a在患轻度OA的软骨细胞就有很高的表达,并且miRNA 146a的表达受白细胞介素-1(interleukin-1,IL-1)的影响。高表达miRNA146可以减少IL-1β调控的表达产物肿瘤坏死因子(tumor necrosis factor,TNF)的水平。miRNA 146a与OA疼痛亦相关,Li[11]等通过构建大鼠OA模型,发现miRNA 146a与OA引起的慢性疼痛相关,并得出miRNA 146a治疗可有效缓解OA疼痛,同时改善膝关节软骨活性。此外,miRNA 146a也参与了软骨细胞凋亡。Smad4通过抑制软骨细胞肥大化和细胞凋亡而在软骨细胞分化中发挥重要作用,miRNA 146a可通过降低软骨细胞的Smad4水平从而促进软骨细胞凋亡[12]。
miRNA 146a在OA患者的软骨组织合成代谢和分解代谢中扮演着重要角色,但具体作用仍有争论。在IL-1β刺激下,软骨细胞miRNA 146a表达水平升高,同时MMP 13的mRNA水平也升高,二者呈平行上升趋势[3]。另有报道[13]显示IL-1可明显降低蛋白聚糖和Ⅱ型胶原的mRNA水平,同时升高蛋白聚糖酶5与MMP 13水平,而软骨细胞过表达的miRNA 146a可抵消此IL-1引起的效果,从而降低MMP 13水平。说明miRNA 146a对软骨基质的代谢具有重要影响。目前miRNA 146a独立对正常及不同阶段OA软骨细胞MMP 13的影响仍需要进一步研究。为了探索miRNA 146a能否通过影响软骨代谢参与OA进程,本次试验通过化学转染的方法上调或抑制正常软骨细胞及中期和晚期OA软骨细胞miRNA146a后,使用WesternBlot技术检测MMP13水平,以得出miRNA146a能否调控MMP13水平。
首先,本次实验得出,中期OA软骨细胞表达MMP 13的水平明显高于晚期OA软骨细胞,这与既往结果[3]相一致。这可能是因为中期OA软骨重建,分泌大量MMP 13加速基质降解,而到了OA晚期,软骨重建基本完成,细胞外基质已大量破坏、降解,MMP 13水平下降。其次,本次实验结果证实,中期和晚期OA软骨细胞中,上调或抑制miRNA 146a后,MMP 13的蛋白水平出现相应的上升或下降。说明miRNA 146a可通过上调MMP 13的水平参与软骨细胞分解代谢,加速软骨基质降解。最后,抑制miRNA 146a后,中期OA软骨细胞MMP 13下降的幅度明显大于晚期OA软骨细胞,提示及早对OA软骨细胞进行miRNA 146a干预可取得更好的效果。而miRNA 146a通过何种途径影响MMP 13的水平还不清楚,目前已知MMP 13在软骨细胞受各种因子的调节,其中又以IL-1和TNF最重要,有研究显示[10]IL-1受体相关激酶1和TNF受体相关因子6基因是miRNA 146a体内转录后的靶点。miRNA 146a是否通过此途径调节MMP 13尚需进一步研究。
[1]Pelletier JP,Martel-Pelletier J,Abramson SB.Osteoarthritis,an inflammatory disease:potential implication for the selection of new therapeutic targets[J].Arthritis Rheum,2001,44(6):1237-1347.
[2]Roach HI,Yamada N,Cheung KS,etal.Association between the abnormal expression of matrix-degrading enzymes by human osteoarthritic chondrocytes and demethylation of specific CpG sites in the promoter regions[J].Arthritis Rheum,2005,52(10):3110-3112.
[3]Yamasaki K,Nakasa T,Miyaki S,etal.Expression of microRNA‐146a in osteoarthritis cartilage[J].Arthritis & Rheumatism,2009,60(4):1035-1041.
[4]Mott JD,Werb Z.Regulation of matrix biology by matrix metalloproteinases[J].Curr Opin Cell Biol,2004,16(5):558-564.
[5]Pufe T,Lemke A,Kurz B,etal.Mechanical overload induces VEGF in cartilage discs via hypoxia-inducible factor[J].The American journal of pathology,2004,164(1):185-192.
[6]刘江涛,郭雄.骨关节炎软骨细胞凋亡机制的研究进展[J].中国骨质疏松杂志,2010,16(10):776-780.
[7]Knauper V,Lopez-Otin C,Smith B,etal.Biochemical characterization of human collagenase-3[J].J Biol Chem,1996,271(3):1544-1550.
[8]Moldovan F,Pelletier JP,Hambor J,etal.Collagenase-3(matrix metalloprotease 13)is preferentially localized in the deep layer of human arthritic cartilage in situ:in vitro mimicking effect by transforming growth factor beta[J].Arthritis Rheum,1997,40(9):1653-1661.
[9]Neuhold LA,Killar L,Zhao W,etal.Postnatal expression in hyaline cartilage of constitutively active human collagen ase-3(MMP-13)induces osteoarthritis in mice[J].J Clin Invest,2001,107(1):35-44.
[10]Taganov KD,Boldin MP,Chang KJ,etal.NF-kappaB-dependent induction of microRNA miR-146,an inhibitor targeted to signaling proteins of innate immune responses[J].Proc Natl Acad Sci USA,2006,15,103(33):12481-12486.
[11]Li X,Kroin J S,Kc R,etal.Altered Spinal MicroRNA‐146a and the MicroRNA‐183 Cluster Contribute to Osteoarthritic Pain in Knee Joints[J].J Bone Mine Res,2013,28(12):2512-2522.
[12]Li J,Huang J,Dai L,etal.miRNA 146a,an IL-1β responsive miRNA,induces vascular endothelial growth factor and chondrocyte apoptosis by targeting Smad4[J].Arthritis Res Ther,2012,14(2):75.
[13]Li X,Gibson G,Kim JS,etal.MicroRNA-146a is linked to pain-related pathophysiology of osteoarthritis[J].Gene,2011,480(1-2):34-41.
ResearchontheMechanismofmiRNA146aRegulatingMMP13intheDegenerativeProcessofOAChondrocyte
ZHANG Qing,CAO Can,ZHONG Hang,etal
(Department of Orthopedics,West China Hospital,Sichuan University,Chengdu 610000,China)
ObjectiveTo study the changes of the expression of MMP 13 after up-regulated or down-regulated the miRNA 146a in the normal chondrocytes and the middle and late stage of the OA chondrocytes.To explore the role of miRNA 146a in the development and progression of osteoarthritis.MethodsWe collected 4 cases of normal cartilage and 12 cases of arthritic cartilage which were divided into middle stage and late stage by Kellgren-Lawrence imaging protocol.Chemical transfection was used in every group of chondrocyes.And we studied the changes of MMP 13 after up-regulating or down-regulating the miRNA 146a chondrocytes.ResultsThe protein expression level of MMP 13 turned out to be up after up-regulating the miRNA 146a in the normal chondrocytes.The result is stastically significant.The expression of MMP 13 turned out to be down after down-regulating.The result was not statistically significant.The protein expression of MMP 13 was higher in the middle stage OA chondrocytes than the late OA stage chondrocytes,and the result was statistically significant.The protein expression level of MMP 13 turned out to be up after up-regulating the miRNA 146a in late stage of the OA chondrocytes.The result was statistically significant.The protein expression level of MMP 13 turned out to be down after down-regulating the miRNA 146a in late stage of the OA chondrocytes.The result was stastically significant.ConclusionmiRNA 146a has an effect on the chondrocyte through MMP 13.Thus plays a role in pathology of OA.
osteoarthritis;miRNA 146a;matrix metallopeptidase 13;RNA interference
1008-5572(2014)11-0999-04
Q786
:A
四川省科技厅科技支撑项目(2011FZ0040);*本文通讯作者:杨静
2014-07-21
张清(1987- ),男,研究生在读,四川大学华西医院骨科,610000。
骨关节炎(osteoarthritis,OA)是由全身易感因素和局部机械因素相互作用导致的一种以关节软骨退变为主的常见老年性骨与关节退行性疾病。其主要的临床表现为:受累关节的疼痛、肿胀、畸形、活动受限,X线片的主要表现为受累关节的关节间隙变窄、软骨下骨硬化、周围骨赘形成。目前OA的发病机制尚不清楚,比较统一的解释是,机械力学和生物学因素导致软骨细胞、细胞外基质和软骨下骨的退化。基质金属蛋白酶13(matrix metallopeptidase 13,MMP 13)是软骨细胞肥大分化的标志物,是导致OA关节软骨基质降解的重要水解酶之一[1]。当软骨受损后,软骨细胞MMP 13的表达量上升[2],导致了细胞外基质产生与降解之间的平衡被打破,Ⅱ型胶原被大量降解,软骨细胞的内环境和胶原网络遭到了破坏,从而导致了OA的发生。

