敌草隆和伏草隆的高效液相色谱分析方法研究
程传政
(中盐安徽红四方股份有限公司,安徽 合肥 230011)
敌草隆,3-(3,4-二氯苯基)-1,1-二甲基脲(分子式 C9H10Cl2N2O),敌草隆是兼具内吸和触杀作用的除草剂,可被植物的根、茎、叶吸收,主要用于防治甘蔗田杂草,对一年生和多年生禾本科和阔叶杂草均有很好的防效。伏草隆为内吸选择性土壤处理使用除草剂。主要通过杂草根吸收,叶部活性底。对一年生禾本科和阔叶杂草均有效。持效期长、棉田使用1次即能防除整个生育期内的杂草。两者均为选择性的除草剂,作用机理是杂草根部吸收药液之后,叶部活性会变弱。也可以在药液中加入表面活性剂来增加叶部的吸收量。伏草隆的除草机理与敌草隆相似,为抑制杂草的光合作用的电子传递过程,而对杂草种子的萌发无影响。
对于伏草隆测试,最初采用经典的碱水解滴定法,伏草隆均可在碱性溶液中水解出二甲胺,亦可使用蒸馏定胺法,水解产物二甲胺蒸入硼酸溶液中,用标准盐酸滴定二甲胺,计算伏草隆含量。
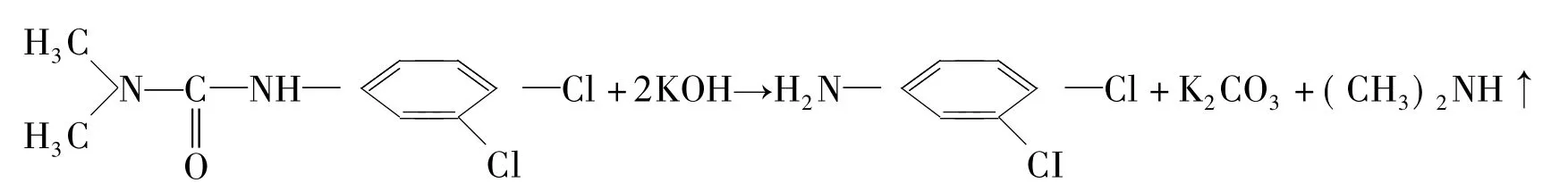
终点指示剂可使用电位法,甘汞电极-玻璃电极对,也可选用指示剂。
敌草隆除了可以用水解后测定二甲胺的滴定法来测试之外,还可以用银量法测定,敌草隆需用金属钠在无水乙醇中回流脱下卤素,测定样本时经薄层分离后,用二甲苯将组分洗入50 m1圆底烧瓶中,加0.5g金属钠后回流,沸腾后由上口分3~4次加入10 mL无水乙醇,回流约30 min,用水、丙酮洗人烧杯中,在这类农药测定前需加入甲醛溶液,以去除-CN基的干扰。脱下的卤素用硝酸银标准溶液滴定,可以采用电位法,通过电位法滴定曲线指示终点。
除了经典的方法之外敌草隆和伏草隆还可以通过荧光法[1]、气相色谱法[2]、高效液相色谱法[3]来测定,敌草隆和伏草隆目前都没有国家标准或行业标准,本文在敌草隆和伏草隆色谱分析中从流动相的配比、检测波长、色谱柱等进行选择和优化,建立了一种可用于敌草隆和伏草隆有效成分同时测定的分析方法。
1 实验部分
1.1 仪器及试剂
Agilent高效液相色谱仪,配G1315C二极管阵列检测器,G1322A在线脱气装置、G1312A泵、G1316A柱温箱、G1329A自动进样器、;超声清洗器,针筒式微孔滤膜过滤器,0.45μm,和经过校准的玻璃仪器。
色谱级甲醇;分析纯冰乙酸,新蒸二次蒸馏水;敌草隆、伏草隆标样:已知含量99.0%。
1.2 敌草隆试验方法
1.2.1 液相色谱分析条件 液相色谱柱:250mm×4.6mm(id)不锈钢柱,内装Eclipse Plus C18填充物,5μm;流动相:以甲醇:水:冰乙酸 =70:29.6:0.4;流速:1.0mL/min;柱温:35℃,进样体积为5μL,检测波长为250nm。
图1为标样和试样高效液相色谱图,保留时间约为6.2min。
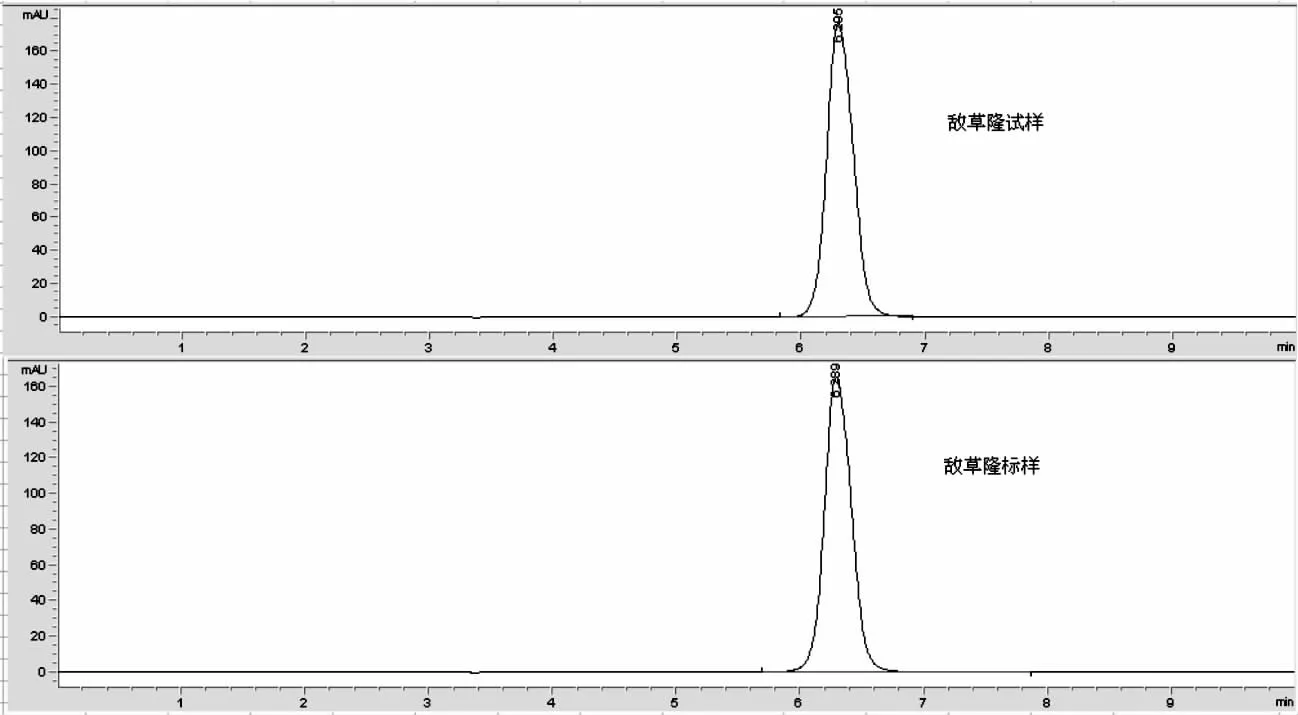
图1 敌草隆试样和敌草隆标样的色谱图Fig.1 Chromatograms of Diuron sample and standard Diuron
1.2.2 标样溶液以及试样溶液的配制 称取0.05g敌草隆标样(精确至0.0002g)加入到100mL容量瓶中,加30mL甲醇溶解后,再用甲醇定容至刻度,在超声波浴槽中震荡15min后,恢复至室温,摇匀;用移液管移取5mL至50mL的容量瓶中,加甲醇稀释至刻度,摇匀;标准溶液现配现用。
称取含敌草隆试样0.05g(精确至0.0002g)于100mL容量瓶中,加入30mL甲醇溶解后,再用甲醇定容至刻度,在超声波浴槽中震荡15min后,恢复至室温,摇匀;;用移液管移取5mL至50mL的容量瓶中,加甲醇稀释至刻度,超声15min后,恢复至室温,摇匀。
1.2.3 测定 在仪器稳定后,以上述操作条件,连续进数针标样,计算相邻两针相对响应值的重复性,在确认相邻两针响应值变化小于1.5%之后,按照标样、试样、试样、标样的顺序进行测定。
1.2.4 方法的添加回收率 配制敌草隆浓度分别为40.0mg/L、30.0mg/L的标液,分别移取10.0mL这两种标准溶液于两支20mL具塞刻度管中,分别向这两个具塞刻度管中分别加入5ml 100mg/L的敌草隆标液,超声混匀后,配成A号、B号添加溶液,在上述色谱条件下连续进样,得到峰面积平均值,计算得到敌草隆添加回收率为99.01%。
1.2.5 检测波长的选择 在测定时,选择在190nm~380nm波长范围内,对敌草隆紫外吸收进行扫描,得到敌草隆得最大吸收波长为250nm,实验结果显示,在此波长下敌草隆吸收峰面积较大、稳定,且能与杂质较好的分离,
1.3 敌草隆和伏草隆复配试验方法
1.3.1 液相色谱分析条件 液相色谱柱:250mm×4.6mm(id)不锈钢柱,内装Eclipse Plus C18填充物,5μm;流动相:以甲醇:水:冰乙酸 =70:29.6:0.4;流速:1.0 mL/min;柱温:35℃,进样体积为 5μL,检测波长为240nm。
图2为标样和试样高效液相色谱图,伏草隆保留时间分别约为4.6min,敌草隆保留时间分别约为5.8min。
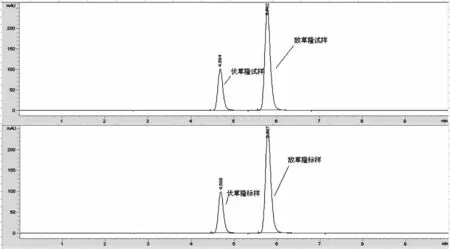
图2 敌草隆-伏草隆试样和敌草隆-伏草隆标样的色谱图Fig.2 Chromatograms of Diuron-Fluometuron sample and standard Diuron-Fluometuron
1.3.2 标样溶液及试样溶液的配制 称取0.05g敌草隆和0.05g伏草隆标样(精确至0.0002g)加入到100mL容量瓶中,加入30mL甲醇溶解后,再用甲醇定容至刻度,在超声波浴槽中震荡15min后,恢复至室温,摇匀;用移液管移取5mL至50mL的容量瓶中,加甲醇定容至刻度,摇匀;标准溶液现配现用。
称取含敌草隆和伏草隆得复配试样0.05g(精确至0.0002g)于100ml容量瓶中,加入30ml甲醇溶解后,再用甲醇定容至刻度,在超声波浴槽中震荡15min后,恢复至室温,摇匀;用移液管移取5ml至50ml的容量瓶中,加甲醇定容至刻度,摇匀。
1.3.3 测定 在仪器稳定后,在上述色谱条件下,连续进数针标液,计算相邻两针相对响应值的重复性,待相邻两针的响应值变化在1.2%以内,按照标样、试样、试样、标样的顺序进样测定。
2 结果与讨论
2.1 色谱柱的选择
在流动相配比和检测波长不变的情况下,依次采用Agilent Eclipse Plus C18(250mm×4.6mm,5μm)、Agilent Zorbax RX C8(250mm×4.6mm,5μm)不锈钢柱,分别对敌草隆和伏草隆标准溶液进行了测定,发现了敌草隆和伏草隆在Eclipse XDB-C18(150mm×4.6mm,5μm)色谱柱上出峰时间比Agilent Eclipse Plus C18(250mm ×4.6mm,5μm)和 Agilent Zorbax RX C8(250mm ×4.6mm,5μm)早,但由于保留时间较接近,敌草隆和伏草隆分离得效果不好。在Agilent Zorbax RX C8(250mm×4.6mm,5μm)色谱柱上,敌草隆和伏草隆分离得效果较好,但与杂质分离得不太理想。在250mm的Agilent Eclipse Plus C18上伏草隆和敌草隆分离得较理想,且两者都与杂质峰间隔得较远,能实现有效分离得分离。
2.2 流动相的选择
在Agilent Eclipse C18(250mm ×4.6mm,5μm)色谱柱上,分别选用①V(甲醇):V(水))=50:50;②V(甲醇:水:冰乙酸 =50:49.6:0.4);③V(甲醇):V(水)=70:30;④(乙腈):V(水)=80:20;⑤V(甲醇:水:冰乙酸=70:29.6:0.4);作为流动相对敌草隆和伏草隆样品溶液进行测定,发现①条件下敌草隆和伏草隆的出峰时间虽然在13min以右,敌草隆峰形不好且与杂质的保留时间有部分重叠;在②条件下敌草隆峰形较①有所改善,但与杂质的分离依然不够理想;③条件下敌草隆和伏草隆的出峰时间缩短但敌草隆的峰形不好,用④为流动相时,分离时间短,色谱峰尖锐但成本较高,且敌草隆和伏草隆得保留时间离得太近;⑤敌草隆和伏草隆能有效分离,峰形较好,且能与杂质的分离结果较好。
2.3 检测波长的选择
在测定时,选择在190nm~380nm波长范围内,对伏草隆紫外吸收进行扫描,得到敌草隆得最大吸收波长为230nm,考虑到本实验需要同时检测敌草隆与伏草隆复配制剂中敌草隆和伏草隆的含量,我们最终选择了240nm做为同时检测的波长。实验结果显示,在240nm波长下敌草隆和伏草隆的响应值均比较理想,相互之间能够分离得开,且能与杂质较好的分离。
2.4 方法的线性关系
2.4.1 敌草隆的线性试验 称取敌草隆标样0.05g(精确至0.0002g)于100mL容量瓶中,加入适量甲醇,超声波振荡溶解后,再加甲醇稀释至刻度,摇匀后分别准确移取 1.0、2.0、3.0、4.0、5.0、6.0、8.0、10.0ml于8个100mL得容量瓶中,加甲醇稀释至刻度,摇匀后按敌草隆和伏草隆复配试验方法的液相色谱条件进行测定,以峰面积为纵坐标,样品浓度为横坐标,得到敌草隆得线性坐标图(下图2),敌草隆的方程为Y=44.33x+12.7,相关系数为 R2=0.9998。
2.4.2 伏草隆的线性试验 称取伏草隆标样0.05g(精确至0.0002g)于100mL容量瓶中,加入适量甲醇,超声波振荡溶解后,再加甲醇稀释至刻度,摇匀后分别准确移取 1.0、2.0、3.0、4.0、5.0、6.0、8.0、10.0ml于8个100ml得容量瓶中,加甲醇稀释至刻度,摇匀后按敌草隆和伏草隆复配试验方法的液相色谱条件进行测定,以峰面积为纵坐标,样品浓度为横坐标,得到敌草隆得线性坐标图(下图3),敌草隆的方程为Y=16.5x -3.4,相关系数为 R2=0.9971。
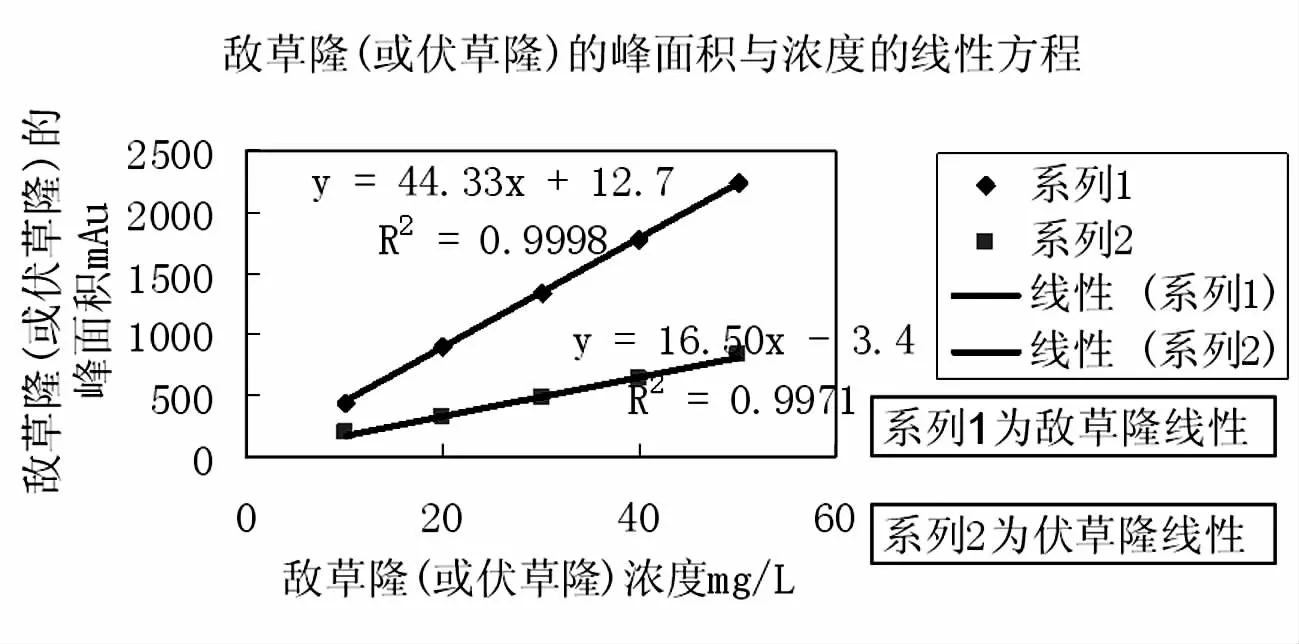
图3 敌草隆(或伏草隆)浓度与峰面积的线性方程Fig.3 The linear equation between concentration and peak area of Diuron(or Fluometuron)
2.5 方法的添加回收率
2.5.1 敌草隆的添加回收率 考虑到正常复配制剂敌草隆的含量为伏草隆的两倍,配制含敌草隆和伏草隆浓度均为40mg/L(A)、20mg/L(B)的两种样品溶液(精确到0.01 mg/L),另外配制含敌草隆浓度为100.0mg/L(C)标准溶液(精确到0.01 mg/L);分别移取10.0mLA、B标准溶液于两支20ml具塞刻度管中,分别移取5mL C标液加入到盛有10.0mLA、B标液的具塞刻度管中,摇匀,配成D号、E号添加溶液,在上述色谱条件下连续进样,用得到其峰面积计算出测定溶液得浓度和实际加标量,再根据理论加标量得到敌草隆的平均添加回收率为99.23%(见下表1)。
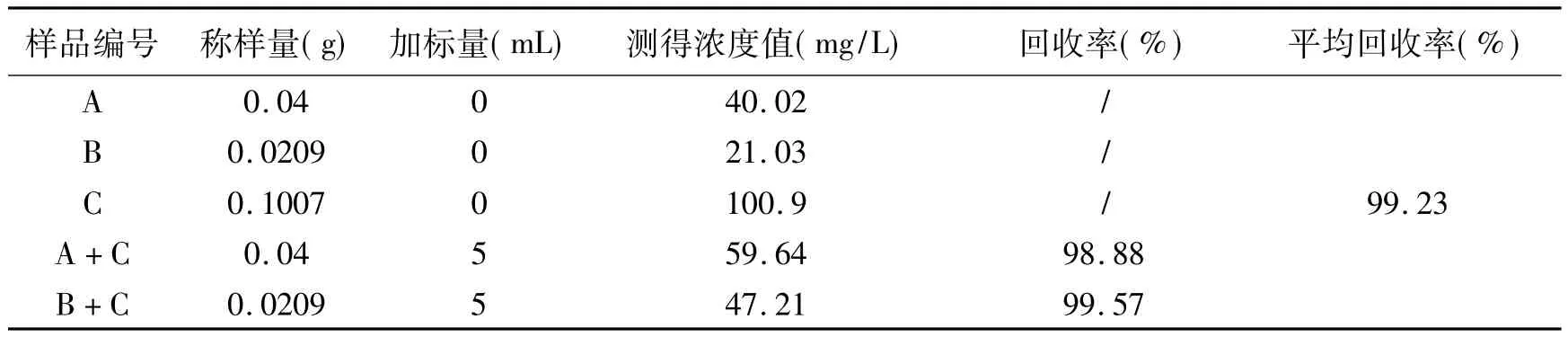
表1 敌草隆的添加回收率Table 1 The adding recovery ratio of Diuron
2.5.2 伏草隆的添加回收率 配制含伏草隆浓度为100.0mg/L(D)标准溶液(精确到0.01 mg/L),分别移取10mL 2.5.1配制的A、B样品溶液于两支20mL具塞刻度管中,分别移取5mLD标液加入到盛有10.0mLA、B标液的具塞刻度管中,摇匀,配成F号、G号添加溶液,在上述色谱条件下连续进样,用2.5.1的方法,计算得到伏草隆的平均添加回收率为100.51%(见下表2)。

表2 伏草隆的添加回收率Table 2 The adding recovery ratio of Fluometuron
2.6 方法的精密度和准确度
配制含敌草隆和伏草隆浓度分别为50mg/L(A)、25mg/L(B)的样品溶液,在选定的敌草隆和伏草隆复配试验方法的液相色谱条件下,重复进样,进行5次平行测定,分别按其峰面积平均值代入计算,得到敌草隆和伏草隆的标准偏差分别为0.39、0.51,变异系数分别为为1.12%、1.79%。
3 结束语
本文采用外标法在同柱同条件下同时测定敌草隆和伏草隆复配制剂中的敌草隆和伏草隆含量,通过对高效液相色谱条件的选择与优化,建立精密度和准确度好的敌草隆和伏草隆同时测定的高效液相色谱分析方法,有操作简单,快速,线性关系良好,能满足敌草隆和伏草隆有效成分同时测定的分析要求。
:
[1]张菊野,周荣仁.除草剂的生物发光测定法[J].植物生理学通讯,1990(5):43-48.
[2]张素娣.敌草隆的气相色谱分析[J].广西化工,1998(4):45-46.
[3]陈樱玉,潘雪峰.高效液相色谱法同时测定莠灭净和敌草隆[J].农药,2011(1):41-42.
[4]寿林飞,金铨,徐静高,等.甘蔗及土壤中敌草隆残留的分析方法[J].浙江农业科学,2007(1):82-83.
[5]倪蓉,杨龙彪,张燕.工作场所空气中敌草隆的高效液相色谱测定方法研究[J].中国卫生检验杂志,2007(9):1549-1551.
[6]张琳,生威,李伶伶,等.酶联免疫法检测水中的伏草隆[J].食品研究与开发,2013(10):83-85.
[7]陈樱玉.敌草隆的液相色谱分析[J].化工技术与开发,2006(6):19-20.
[8]马光树,晁金鸽,马林,等.60%敌草隆·环嗪酮可湿性粉剂的高效液相色谱分析方法[J].农药科学与管理,2004(11):4-6.
[9]裘立群,刘学春.高效液相色谱法测定肉类及肉制品中敌草隆的残留量[J].山东畜牧兽医,2002(3):27-27.
[10]郭永泽,张玉婷,刘磊,等.土壤中噻苯隆和敌草隆及其代谢物的残留量测定方法[J].安徽农业科学,2010(2):856-857.
——一个解释欧姆表刻度不均匀的好方法