浅表神经鞘瘤的声像图特点及常见误诊原因分析
彭雪敏,何燕妮,刘红梅
(南方医科大学第三附属医院超声医学科/广东省骨科研究院,广州 510630)
神经鞘瘤又名许旺细胞瘤,是一种源于神经髓鞘的肿瘤,由Schwann细胞和周围胶原基质组成。高频超声的推广运用对于浅表神经鞘瘤的影像学诊断具有一定的价值。有文献报道其检出率及诊断准确率达100%及86.5%[1]。但是,在临床实际工作中发现其常误诊为其他浅表肿瘤。本文对51例经病理检查确诊病例进行分析,总结浅表神经鞘瘤的超声图像特点和误诊原因,从而提高超声检出率及诊断准确率。
1 资料与方法
1.1 一般资料 回顾性分析2010年1月至2013年12月本院收治的经超声检查并由病理检查证实为浅表神经鞘瘤患者51例,其中,男29例,女22例,年龄17~74岁,平均35.4岁。发生于四肢35例,躯干7例,颈部5例,头面部4例。临床上大部分患者无明显诱因发现体表肿块就诊,有45.1%(23/51)患者出现疼痛、肢体麻木或无力等临床症状,其中大多位于四肢,占87.0%(20/23)。
1.2 方法 使用仪器为飞利浦IU22、迈瑞DC6及DC8超声仪,线阵探头,频率7~10MHz。根据肿块部位选择适当体位,直接扫查法观察肿块的形态、大小、边界、包膜结构、内部回声、后方回声、血流信号,尤其注意肿块与周围神经的关系。其中血流信号丰富度采用血流半定量分级法,分为0~3级。0级:肿块内未见血流信号;1级:肿块内见1~2个点状血流信号;2级:肿块内见3~4个点状血流信号或1条显示清晰的血管;3级:肿块内见4个以上点状血流或2条以上显示清晰的血管[2-4]。
2 结 果
51例病理诊断为浅表神经鞘瘤患者,超声诊断神经鞘瘤40例(其中1例为恶性多发性神经鞘瘤),神经纤维瘤8例,皮脂腺囊肿2例,腱鞘囊肿1例,超声诊断符合率78.4%。
本组病例超声特点(表1):51例中超声检测最小肿物为7 mm×5mm,最大肿物为87mm×64mm;肿块呈圆形或椭圆形,形态规整,边界清楚,后方多数回声增强;其中88.2%包膜完整显示,11.8%包膜不完整显示或无显示;92.2%表现为低回声,少数表现为极低回声(1.9%)或中等回声(5.9%)。肿块内部回声均匀者占72.3%,不均匀者仅27.7%,而其中的7例内部出现液性暗区。80.4%血流分级为0~1级(图1A),15.7%为2级,3.9%为3级。54.9%神经鞘瘤可显示肿物长轴与神经走行一致,两端与神经相连,即“鼠尾征”,并可见神经于肿物后方绕行(图1);27.5%可见周围神经但不能确定肿物与周围神经的关系;17.6%肿物周围未见神经回声。
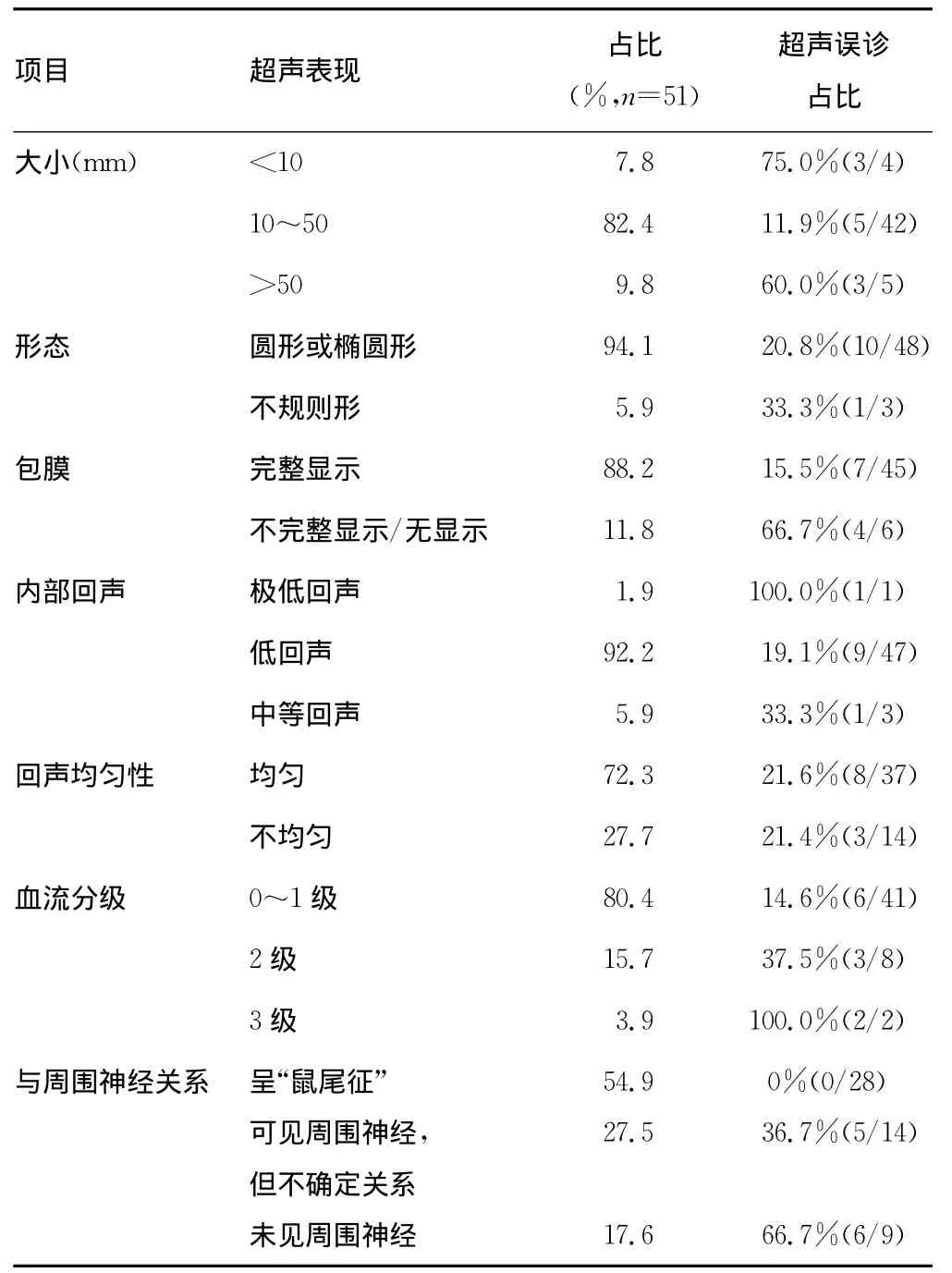
表1 51患者浅表神经鞘瘤的肿块的超声特点
由表1可见,肿物过小(<10mm)或过大(>50mm)、包膜显示不完整、内部回声过低、血流信号越多,误诊率越高。另外,与神经关系越清晰,误诊率就越低,诊断准确率就越高。28例清晰显示肿物与周围神经关系的病例,超声诊断均与病理符合;14例单纯显示周围神经但不能确定肿物与周围神经关系的病例,超声诊断符合9例,其余5例误诊为神经纤维瘤;9例周围未见神经回声的病例,超声诊断符合3例,3例误诊神经纤维瘤,其中1例表现为极低回声,肿物最小,未显示与周围神经关系,超声误诊为腱鞘囊肿,2例内部回声不均匀,血流信号为3级,亦未显示与周围神经关系,超声误诊为皮脂腺囊肿并感染。本组病例中有1例恶性神经鞘瘤(图2),其声像表现为多发椭圆形或不规则形低回声肿物,边界清,其中最大肿物呈椭圆形,包膜显示完整,可见典型“鼠尾征”,其余多个小病灶则沿神经走行排列成串珠状,形态不规则,包膜显示不完整,与周围神经关系辨识不清,血流为少量血流。
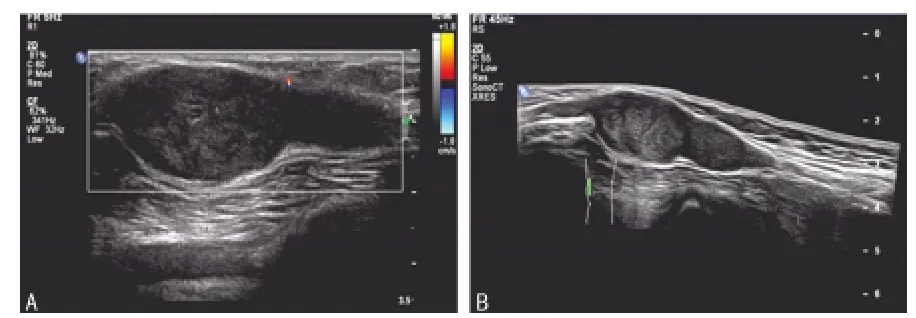
图1 膝部神经鞘瘤超声图
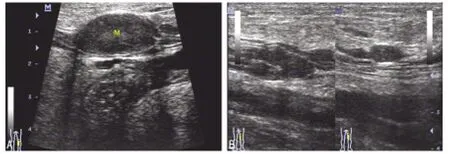
图2 同一患者恶性多发性神经鞘瘤超声图
3 讨 论
神经鞘瘤好发于青中年人,生长缓慢,以单发多见,极少恶变[5-6]。本组病例中仅1例为多发性且为恶性。常发生于四肢,其他如颈、面、头皮等部位也可发生,质地硬,边界清楚,周围被覆一层由神经外膜组成的真包膜[7],肿瘤较大时可囊变。通常无自觉症状,部分患者可有神经压迫症状,本组中23例有相应临床症状。文献报道浅表神经鞘瘤常见于四肢,肿瘤呈椭圆形或梭形,形态规整,边界清楚,良性者均具有包膜,多数为乏血供,长轴与神经走行平行,神经于包膜下穿过,呈偏心性生长[7-8],后方回声增强[9-10]。
本组病例绝大部分神经鞘瘤超声表现为圆形或椭圆形低回声肿块,形态规整,边界清楚,包膜完整,内部回声均匀或不均匀,后方回声增强,其内部未见血流信号或仅见1~2个点状血流信号,肿物长轴与神经走行一致,两端与神经相连,即“鼠尾征”。
由于高频超声可清晰显示较大的神经[11],尤其是四肢的神经,因此,熟悉浅表神经的正常解剖可以提高神经源性肿瘤的诊断。正常外周神经超声上纵切显示为强回声的束状结构,横切为圆形或椭圆形低回声,内见点状强回声,对于四肢及颈部的神经鞘瘤,超声可以观察到肿物与神经的关系[12]。因此,高频超声对于浅表神经鞘瘤的诊断具有重大意义,但是诊断上,高频超声对神经鞘瘤的诊断仍存在一定的误诊。从本组病例中试分析其原因,可能有以下几点:(1)浅表周围神经大多过于细小,超声很难辨别肿物与神经的关系,甚至无法辨认神经结构,易误诊为其他非神经源性的肿瘤,如皮质腺囊肿等;(2)肿物过大或过小,可影响与周围神经的辨认,肿物过小时,内部回声及包膜难以辨识也可导致误诊;(3)神经纤维瘤同是神经源性肿瘤,与神经关系密切,由于周围神经过小,有时无法判断神经是否从肿物中心穿过而误认为神经鞘瘤;其次,神经纤维瘤病理无包膜,但是由于肿瘤压迫周围组织形成“假包膜样”的回声,使其超声图像与神经鞘瘤相似,极容易混淆[3]。其次,本组病例中虽然仅有1例恶性浅表神经鞘瘤,但是,若肿瘤为多发且形态不规整、包膜不完整时,要警惕恶变可能[13]。
治疗上,浅表神经鞘瘤因包膜完整,手术从包膜上剥离即可,不必切除邻近的正常组织,与神经纤维瘤、腱鞘囊肿等手术方式不同[14-15]。因此,术前对肿瘤的部位、性质及肿瘤与周围结构的关系做出准确判断尤为重要。而高频超声对浅表软组织检查具有较高的分辨力,能同时观察血流,能动态观察肿物与周围神经关系,同时浅表神经鞘瘤超声表现具有一定的特点。因此,高频超声是对浅表神经鞘瘤的最佳检查手段之一,诊断上需与神经纤维瘤、皮脂腺囊肿、腱鞘囊肿等鉴别。
[1]周鸿,张振玲,史丽雅,等.高频彩色多普勒超声诊断浅表神经鞘瘤的价值[J].四川医学,2013,29(10):1424-1425.
[2]Adler DD,Carson PL,Rubin JM,et al.Doppler ultrasound color flow imaging in the study of breast cancer preliminary findings[J].Ultrasound Med Biol,1990,16(6):553-559.
[3]温建文,梁崤嵘,梁彤,等.超声鉴别诊断体表孤立性神经鞘瘤及神经纤维瘤的价值[J].实用医学影像杂志,2013,14(3):176-178.
[4]沈若霞,张圆,陈海涛,等.外周神经鞘瘤的超声诊断及误诊分析[J].昆明医学院学报,2011,32(7):83-86.
[5]周春艳.彩色多普勒超声对外周神经鞘瘤的诊断价值[J].中国医学创新,2011,8(12):105-106.
[6]李治安.临床超声影像学[M].北京:人民卫生出版社,2003:1191-1783.
[7]高亮,康斌,熊奡,等.周围神经源性良性肿瘤的超声特性[J].实用医学影像杂志,2013,14(3):188-190.
[8]王萍,戴晴,何澎.肢体神经鞘瘤的超声诊断[J].中国医学影像技术,2006,22(7):1067-1069.
[9]Tsai WC,Chiou HJ,Chou YH,et al.Differentiation between schwannomas and neurofibromas in the extremities and superficial body:the role of high-resolution and color Doppler ultrasonography[J].J Ultrasound Med,2008,27(2):161-166.
[10]Ian Beggs.Sonographic apperances of nerve tumors[J].J Clin Ultrasound,1999,27(7):363-368.
[11]林增坤.高频超声诊断外周神经鞘瘤的探讨[J].华北煤炭医学院学报,2011,13(5):652-653.
[12]刘菊先,彭玉兰,向波,等.神经鞘瘤的超声表现及其诊断价值[J].四川大学学报:医学版,2008,39(5):865-867.
[13]轩维锋,张红环,陈祎.肢体良性神经鞘瘤的超声表现[J].中国临床医学影像杂志,2007,18(5):368-369.
[14]沈建辉,董晓强.颈部神经鞘瘤23例手术治疗分析[J].苏州大学学报:医学版,2009,29(5):995-996.
[15]陈庆,姜凡.超声对神经源性肿瘤的术前诊断[J].安徽医药,2008,12(3):235-237.

