肝素酶和CD44v6在非小细胞肺癌中的表达及意义
邓太兵,黄万秀,唐凤鸣
(1.四川省广安市人民医院呼吸内科 638500;2.四川省宜宾市第一人民医院呼吸内科 644000)
肺癌是世界范围内发病率和病死率最高的恶性肿瘤,其中非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)在肺癌患者中所占比例约为80%;作者既往研究发现在NSCLC组织中CD44的表达率为52.27%[1]。CD44v6是CD44家族的主要成员,在肿瘤的转移过程中促进肿瘤细胞与细胞间质的黏附;而肝素酶是目前发现的惟一能够降解细胞外基质和基底膜的内源性糖苷酶,在肿瘤的转移中具有重要的作用;肿瘤的侵袭和转移是肿瘤致死的主要原因,基于以上分析,本研究拟检测肝素酶及CD44v6在NSCLC组织中的表达,讨论这两种分子在NSCLC中表达的意义及其与预后的相关性。
1 资料与方法
1.1 一般资料 收集本院2009年1月至2011年12月手术切除经病理证实为NSCLC的肿瘤标本117例(肺癌组),取其中62例患者癌旁1cm并且经病理学检查证实为正常的肺组织为阴性对照(癌旁组)。其中男88例,女29例;年龄29~89岁,中位年龄57岁;病理分型为鳞癌36例,腺癌57例,腺鳞癌8例,支气管肺泡癌13例,大细胞癌3例,病理学诊断由两名以上具有10年以上工作经验的病理学专家确诊。NSCLC患者的TNM分期按2009年第7版肺癌TNM分期标准进行,其中Ⅰ期24例,Ⅱ期64例,Ⅲ期29例;其中有淋巴结转移者68例,无淋巴结转移患者49例;随访截止日期为2013年6月,生存期的计算为自手术日期至随访截止日期或死亡日期为止,结尾值为0,术后患者平均生存时间为27.6个月。
1.2 主要试剂 小鼠抗人CD44v6单克隆抗体购于美国RnD公司(Catalog:BBA13)、兔抗人肝素酶单克隆抗体购于美国Santa公司(Catalog:sc-25826);辣根酶标记的山羊抗小鼠二抗(Catalog:ZB-2305)、山羊抗兔(Catalog:ZB-2301)二抗及 DAB显色试剂盒(Catalog:ZLI-9032)购于北京中山金桥生物技术公司。
1.3 方法
1.3.1 免疫组织化学染色 肿瘤组织及癌旁正常组织石蜡切片使用二甲苯脱蜡,采用梯度乙醇水化。将切片放置在终浓度为0.01mol/L、pH值为6.0的柠檬酸盐酸缓冲液中在温度为97~100℃条件下进行微波抗原修复15min,切片置室温冷却30min,用PBS冲洗3次,每次5min;然后分别滴加一抗后于4℃冰箱中孵育过夜,用PBS清洗3次,每次5min;按照一抗来源分别加入二抗并在37℃孵育30min,然后用PBS清洗3次,每次5min;严格按照DAB显色试剂盒进行显色,苏木精复染,PBS代替一抗作为系统阴性对照。
1.3.2 图像分析 使用日本Olympus公司生产的CX21显微镜,放大倍数为400倍观察免疫组织化学切片,并进行半定量评估,判定标准:细胞膜或细胞质染色即判定为阳性;参照Mathew等制定的分级标准,无阳性细胞或者阳性细胞小于5%为阴性(-),染色为黄色的细胞大于0小于50%或细胞染色为棕黄色的细胞小于30%为阳性(+),染色为黄色的细胞大于50%或棕黄色细胞大于30%者为强阳性(++)。
1.4 统计学处理 采用SPSS13.0软件进行统计学分析,CD44v6和肝素酶的表达与临床病理因素关系采用χ2检验,CD44v6和肝素酶的表达相关性分析采用Spearman等级相关因素分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 CD44v6和肝素酶在NSCLC中的表达 CD44v6表达于肿瘤细胞质及胞膜呈黄色或棕色颗粒,CD44v6在癌旁组的阳性表达率为4.8%(3/62),在肺癌组中的阳性表达率为54.7%(64/117),肺癌组 CD44v6的阳性率显著 高于癌旁组 (χ2=42.642,P=0.0001);肝素酶表达于肺癌细胞质,肝素酶在癌旁组的阳性表达率为17.7%(11/62),在肺癌组中肝素酶的阳性表达率为86.3%(101/117),肺癌组肝素酶的阳性率显著高于癌旁组(χ2=81.389,P=0.000 1),见表1、图1。

表1 CD44v6、肝素酶在肺癌及癌旁正常肺组织中的表达(n)
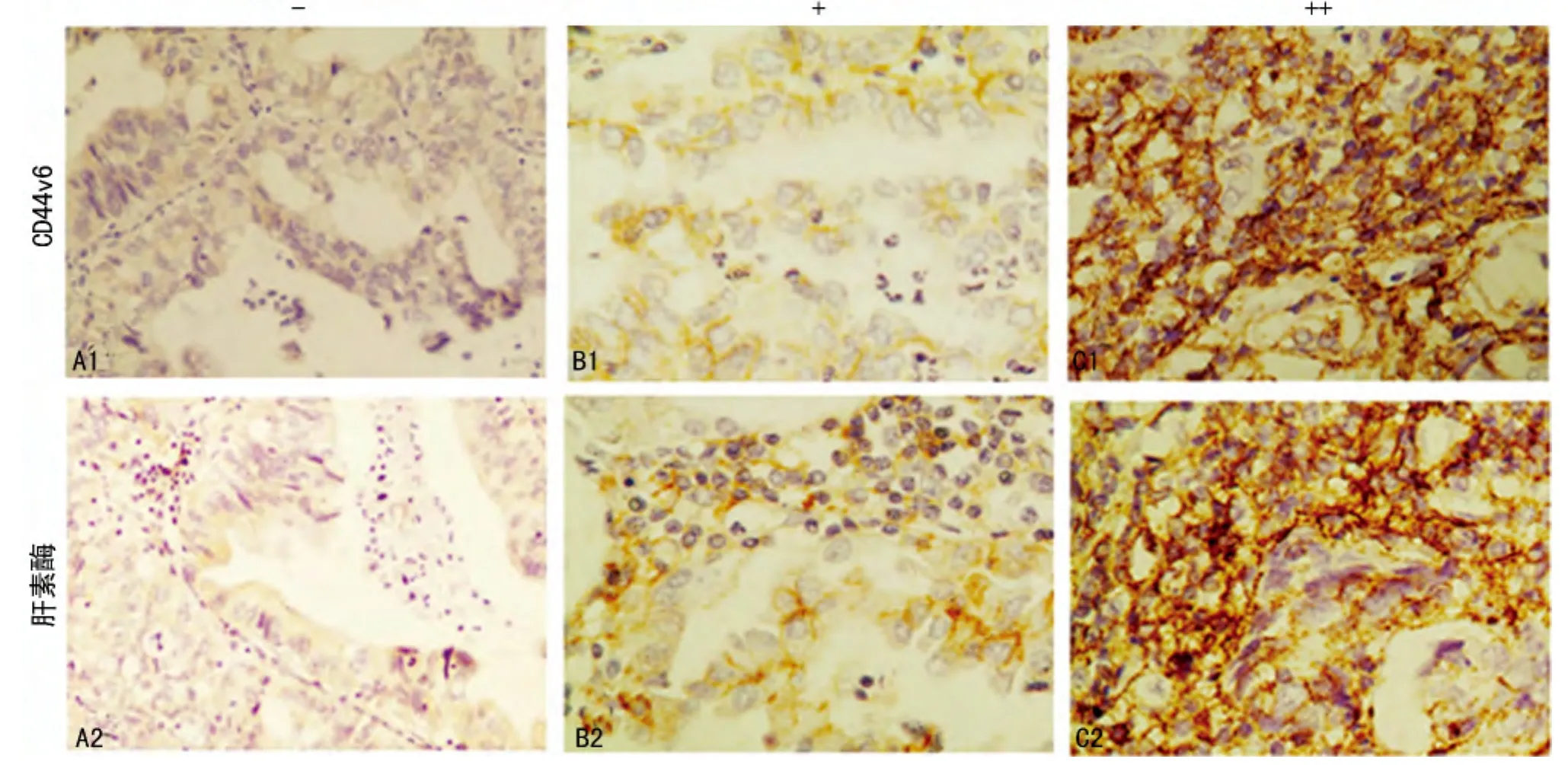
图1 CD44v6、肝素酶在肺癌组织中的表达(免疫组织化学×400)
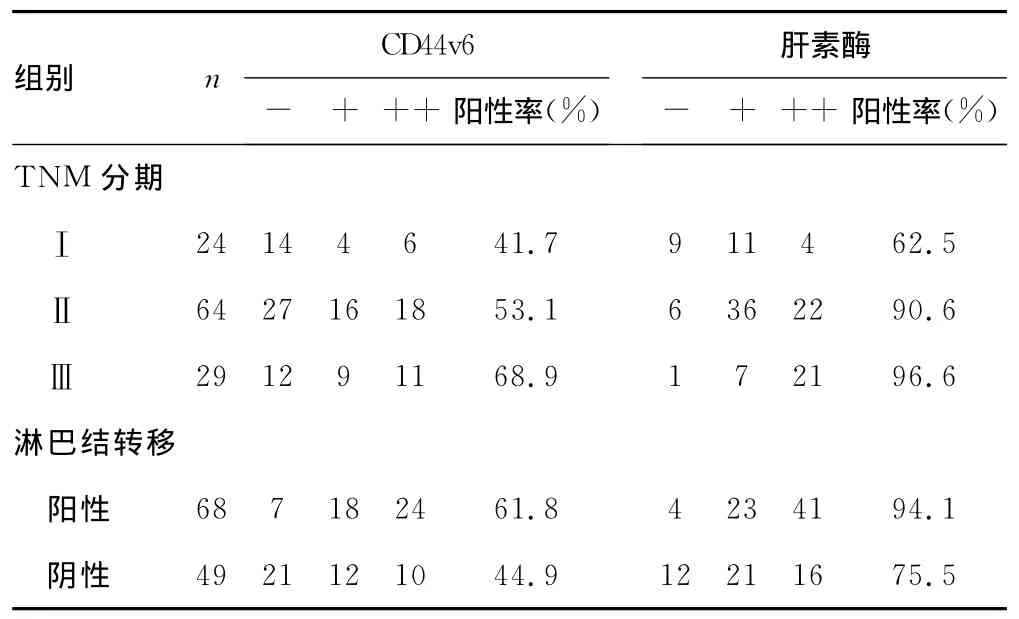
表2 CD44v6与肝素酶在NSCLC TNM分期及淋巴结转移的关系(n)
2.2 CD44v6与肝素酶在NSCLC中的表达与肺癌转移的关系 CD44v6和肝素酶的表达程度与NSCLC的临床分期和淋巴结转移相关,CD44v6在淋巴结转移阳性患者中阳性表达率为61.7%(42/68),在淋巴结转移阴性患者的阳性表达率为44.9%(22/49),两组间比较差异有统计学意义(χ2=27.736,P<0.05);肝素酶在淋巴结转移阳性患者中阳性表达率为94.1%(64/68),在淋巴结转移阴性患者的阳性表达率为75.5%(37/49),两组间比较差异有统计学意义(χ2=8.352,P=0.000 1),见表2。
2.3 CD44v6与肝素酶表达的相关性 通过Spearman相关性分析结果发现CD44v6与肝素酶在NSCLC中的表达存在显著正相关(r=0.894,P<0.05),见表3。

表3 两种蛋白在NSCLC中的表达相关关系(n)
3 讨 论
作者既往的研究表明在非小细胞肺癌患者中,CD44高表达组的生存率明显低于CD44低表达组,这个结果与其他学者的研究报道相接近[2-4]。在本研究中作者采用免疫组织化学检测NSCLC患者肺癌组织及相关的癌旁组织中CD44v6的表达情况,发现CD44v6蛋白在癌旁正常肺组织中的阳性表达率明显低于NSCLC组织,并且CD44v6在淋巴结转移阳性的患者中阳性表达率显著高于淋巴结转移阴性患者的阳性表达率,提示CD44v6可能与NSCLC的转移具有一定的关系,既往文献亦报道了CD44v6还与胃癌、大肠癌、乳腺癌的转移相关[5-9],本研究结果与其他学者的研究结果相似。CD44v6是黏附分子CD44家族的主要成员,在肿瘤的侵袭与转移中,CD44v6主要参与了肿瘤细胞与细胞外基质的黏附,而黏附在肿瘤细胞的侵袭转移过程中具有重要的作用。
既往已有大量的文献表明肝素酶在多种不同组织来源的恶性肿瘤细胞中高水平表达,肝素酶是目前发现的惟一一个能够水解细胞外基质及基底膜的主要成分硫酸乙酰肝素糖蛋白(HSPG)糖链的内源性糖苷酶,而HSPG是细胞外基质及基底膜的主要成分,其主要生物功能是维持细胞外基质的稳定,限制细胞的迁移及黏附,并且HSPG是构成血管壁的主要成分,能够维持血管壁结构完整并支撑增殖迁移的内皮细胞。既往的文献报道肝素酶的表达水平与肺癌、乳腺癌、胃癌、结肠癌、宫颈癌等肿瘤的预后呈负相关[10],抑制肝素酶的活性,可显著改善肿瘤患者的预后[11]。并且,既往的文献报道,肝素酶在裂解细胞外基质及基底膜时,可导致释放多种细胞因子,促进肿瘤新生血管的生成,为肿瘤在转移器官内增殖提供血供[12],抑制肝素酶活性,有效阻止肿瘤细胞的侵袭与转移[13],目前已有学者将肝素酶作为肿瘤免疫治疗的靶点[14-17]。本研究结果发现在肺癌组织中肝素酶的阳性表达率显著高于癌旁正常肺组织,并且肝素酶在淋巴结转移阳性患者中肝素酶的阳性率明显高于淋巴结转移阴性患者,该结果与既往的文献报道相一致,这个结果也说明肝素酶的表达水平越高,NSCLC的肿瘤细胞就越容易出现转移。
侵袭和转移是恶性肿瘤的重要特征,也是肿瘤致死的主要原因,而肿瘤的侵袭、转移过程是多阶段、多步骤、多因素参与的,首先肿瘤通过抑制黏附因子的表达,使得肿瘤细胞容易从原发灶脱离,形成游离细胞并分泌各种多种酶(如金属蛋白酶、肝素酶)破坏细胞外基质及基底膜进入循环系统;然后肿瘤细胞通过增强黏附分子的表达(如CD44v6),促进肿瘤细胞锚定在靶器官的毛细血管壁上,并穿透血管壁进入靶器官,形成新的转移灶。肿瘤的转移过程复杂,包含许多因素,转移过程中有许多相对独立的步骤,只要其中任何一个步骤受限,其转移就不能实现。本研究发现在NSCLC中,CD44v6和肝素酶的表达具有相关性,在肿瘤的转移过程中这两种分子过表达可能在促进肿瘤转移上具有相辅相成的作用,因此在临床上可以将CD44v6及肝素酶的表达作为NSCLC预后的指标,进一步的研究正在进行中。
[1]邓太兵,李为民,莫显明,等.非小细胞肺癌组织中hnRNP B_1和CD44的联合表达及其与预后的关系[J].四川大学学报:医学版,2008,39(5):819-822.
[2]Afify AM,Tate S,Durbin-Johnson B,et al.Expression of CD44sand CD44v6in lung cancer and their correlation with prognostic factors[J].Int J Biol Markers,2011,26(1):50-57.
[3]Situ D,Long H,Lin P,et al.Expression and prognostic relevance of CD44v6in stage I non-small cell lung carcinoma[J].J Cancer Res Clin Oncol,2010,136(8):1213-1219.
[4]Eren B,Sar M,Oz B,et al.MMP-2,TIMP-2and CD44v6 expression in non-small-cell lung carcinomas[J].Ann Acad Med Singapore,2008,37(1):32-39.
[5]Okayama H,Kumamoto K,Saitou K,et al.CD44v6,MMP-7and nuclear Cdx2are significant biomarkers for prediction of lymph node metastasis in primary gastric Cancer[J].Oncol Rep,2009,22(4):745-755.
[6]周东辉,马志敏,陈瑜.CD66v6与可溶性CD44v6在胃癌中的表达及与预后的关系[J].中华肿瘤杂志,2007,29(11):833-837.
[7]Saito S,Okabe H,Watanabe M,et al.CD44v6expression is related to mesenchymal phenotype and poor prognosis in patients with colorectal cancer[J].Oncol Rep,2013,29(4):1570-1578.
[8]Wang X,Chen W,Li X,et al.Heat shock protein 72associated with CD44v6in human colonic adenocarcinoma[J].Cell Biol Int,2008,32(7):860-864.
[9]Yu P,Zhou L,Ke WF,et al.Clinical significance of pAKT and CD44v6overexpression with breast cancer[J].J Cancer Res Clin Oncol,2010,136(8):1283-1292.
[10]Liu H,Chen X,Gao W,et al.The expression of heparanase and microRNA-1258in human non-small cell lung cancer[J].Tumour Biol,2012,33(5):1327-1334.
[11]Nasser NJ,Avivi A,Shafat I,et al.Alternatively spliced Spalax heparanase inhibits extracellular matrix degradation,tumor growth,and metastasis[J].Proc Natl Acad Sci U S A,2009,106(7):2253-2258.
[12]Carmel J,Arish A,Shoshany G,et al.Heparanase accelerates the proliferation of both hepatocytes and endothelial cells early after partial hepatectomy[J].Exp Mol Pathol,2012,92(2):202-209.
[13]Shen B,Chu ES,Zhao G,et al.PPARgamma inhibits hepatocellular carcinoma metastases in vitro and in mice[J].Br J Cancer,2012,106(9):1486-1494.
[14]汤旭东,万瑛,陈婷,等.小鼠肝素酶H-2Kb限制性CTL表位预测及其 MHC-I亲和力分析[J].重庆医学,2007,36(9):820-822.
[15]Tang XD,Liang GP,Li C,et al.Cytotoxic T lymphocyte epitopes from human heparanase can elicit a potent antitumor immune response in mice[J].Cancer Immunol Immunother,2010,59(7):1041-1047.
[16]Tang XD,Wan Y,Chen L,et al.H-2Kb-restricted CTL epitopes from mouse heparanase elicit an antitumor immune response in vivo[J].Cancer Res,2008,68(5):1529-1537.
[17]Tang XD,Wang GZ,Guo J,et al.Multiple antigenic peptides based on H-2K(b)-restricted CTL epitopes from murine heparanase induce a potent antitumor immune response in vivo[J].Mol Cancer Ther,2012,11(5):1183-1192.

