siRNA沉默EZH2表达对人膀胱癌细胞迁移和凋亡的影响*
王海峰,杨 宏,胡礼炳,雷永虹,秦 扬,李 俊,毕城伟,霍 倩
(1.昆明医科大学第二附属医院泌尿外科,昆明 650101;2.昆明医科大学第三附属医院泌尿外科,昆明 650101)
膀胱癌是泌尿系统最常见的恶性肿瘤之一,在国内其发病率和病死率均占泌尿系肿瘤的首位,且近年有增加趋势,男性发病率约为女性的4倍,易发生浸润和转移,且术后复发率高[1]。近年来随着人们对肿瘤发病机制研究和分子生物学技术发展的深入,基因靶向治疗在临床中受到越来越多的关注,因此寻找治疗膀胱癌的分子靶点具有十分重要的意义。果蝇的Enhancer of Zeste基因增强子人类同源物2(ebgabcer of zest homolog,EZH2)是多梳基因家族(polycomb group,PcG)的主要成员,是组蛋白H3第27位赖氨酸特异性的甲基化转移酶,通过沉默与细胞分化、抑制增殖相关基因而导致肿瘤的发生[2]。多项研究显示其过量表达与非小细胞肺癌[3]、结肠癌[4]、急性淋巴细胞白血病[5]、前列腺癌[6]、卵巢癌[7]等多种肿瘤发生、发展和预后相关。本研究以EZH2基因为靶点,设计构建其小干扰RNA(siRNA)的表达载体并转染膀胱癌T24细胞,观察EZH2基因对膀胱癌细胞增殖、侵袭、迁移能力及凋亡的影响,旨在为膀胱癌的基因治疗寻找新的靶点提供理论依据。
1 材料与方法
1.1 材料与试剂 膀胱癌T24细胞株由昆明医科大学重点实验室保存,RPMI 1640培养基、胎牛血清、0.25%胰蛋白酶乙二胺四乙酸(EDTA)、磷酸盐缓冲液(PBS)、LipofectamineTM2000转染试剂、ECL化学发光检测试剂购自美国Invitrogen公司,二甲亚砜(DMSO)购自美国Amersco公司,EZH2抗体购自美国Abcam公司,EZH2siRNA套装购于广州锐博生物公司,聚氟乙烯(PVDF)膜购于美国Millipore公司。
1.2 方法
1.2.1 细胞培养 膀胱癌癌细胞株T24分别在含10%胎牛血清的90%RPMI 1640培养基中,于37℃、5%CO2饱和湿度培养箱中培养。
1.2.2 重组质粒构建及转染 根据GeneBank提供的EZH2基因序列,使用在线设计软件,通过基因序列比对,合成EZH2特异性siRNAs序列5′-GGG AAA GUG UAU GAU AAU TT-3′,阴 性 对 照 siRNAs 序 列 为 5′-UUC UCC GAA CGU GUC ACG UTT-3′。将其合成序列插入到 PGenesil-1.1质粒构建重组体,并转化至大肠埃希菌DH5α感受态细胞中。分别挑取菌落接种于含4mg/mL新霉素的RPMI 1640培养基培养,再使用碱裂解法抽提质粒,并行酶切鉴定和测序分析。转染按照LipofectamineTM2000脂质体转染试剂盒说明书的要求进行,每孔siRNA为4μg,LipofectamineTM2000的用量为10 μL,转染后置入CO2培养箱,6h后换液,继续培养48~72h后收集细胞。实验分为空白对照组(不经任何处理)、阴性对照组和干扰组(分干扰1组、干扰2组、干扰3组)。
1.2.3 转染后RNA提取及实时荧光定量PCR 以NCBI数据库中NM_004456和NM_152998为参考,设计EZH2的siRNA各3条(广州锐博生物合成)。收集转染48h后的T24细胞,按天根DP431试剂使用说明书提取细胞的总RNA,经检测浓度和完整性后,按反转录试剂盒使用说明操作。先逆转录生成cDNA,再以各组cDNA为模板对EZH2基因和内参βactin进行实时荧光定量PCR反应。每一个样品均做3个重复反应。同时设无模板对照。在荧光定量PCR仪上进行检测。反应条件:95℃15s;95℃5s、60℃60s,30个循环;扩增完毕后进行熔解曲线分析:95℃15s,60℃30s,72℃30s。对扩增产物进行琼脂糖凝胶电泳分析特异性。实时定量分析采用2-ΔΔCt方法。β-actin上游引物5′-GGT CTC CTC TGA CTT CAA CA-3′,下游引物 5′-GAG GGT CTC TCT CTT CCT-3′;EZH2 上 游 引 物 5′-GCG CGG GAC GAA GAAT AAT CAT-3′;下游引物5′-TAC ACG CTT CCG CCA ACA AAC T-3′。
1.2.4 MTT法检测细胞增殖情况 将传4~6代的T24细胞用0.25%胰蛋白酶消化后计数,按2×103/孔的浓度接种96孔板,置37℃,5%CO2培养箱中培养18h。更新鲜培养基后培养2h,转染EZH2-siRNA进细胞。24h后开始检测,设置调零孔、对照孔,每组3复孔。置37℃,5%CO2培养箱中培养30min。离心弃去上清,加入含500μg/mL MTT 的DMEM/F12培养基。继续培养4h。离心弃上清,加150μL DMSO待充分溶解后,用酶标仪检测各孔490nm吸光度。每组细胞测3个孔,取平均值,每隔12h检测1次,连续检测72 h,绘制细胞生长曲线。

1.2.5 划痕实验检测细胞迁移能力 用笔在6孔板背后,用直尺比着,均匀地划横线,大约每隔0.5~1.0cm 1道,横穿过孔。每孔至少穿过5条线。每个实验组均设3个平行样本。T24细胞以3×106/孔接种于6孔板中,置于37℃、5%CO2培养箱内培养24h,用EZH2-siRNA转染细胞,再进行培养,24h后更换为无血清培养基培养。当细胞贴壁率为100%时,用比着直尺,垂直画线。用PBS洗细胞3次,去除划下的细胞,加入无血清培养基放入37℃5%CO2培养箱继续培养24h。在光学显微镜下观察划痕修复过程,取12、24h为时间点拍照记录。
1.2.6 Transwell细胞小室检测细胞侵袭能力 收集阴性对照组和干扰2组细胞,用0.25%胰酶消化并制成单细胞悬液。用无血清MEM培养基将 Matrigel配制成10μg/250μL(1∶300)的人工基底膜胶备用。24孔板每孔中铺 Matrigel 3μg/80μL,放于超净台中风干过夜。24孔板每孔加入适量无血清MEM细胞培养液,放置60~90min,洗去多余的胶;取两组细胞以2×105/孔重悬加入上室内,设3个重复孔,放入37℃、5%CO2培养箱中进行培养。细胞小室,弃去培养液,用PBS洗3遍,洗去未黏附细胞。常规固定染色后光学显微镜下计数膜背面侵袭的细胞数量,计数中间和四周共5个视野,每组细胞计数3份,取平均值。
1.2.7 流式细胞术检测细胞凋亡情况 用不含EDTA的胰酶消化收集培养及转染24h后的T24细胞,离心、洗涤后加入500μL的Binding Buffer悬浮细胞,接着先加入5μL荧光标记的膜连蛋白V(Annexin V-FITC)混匀后,加入5μL碘化化丙啶(PI),混匀,室温避光反应5~15min后进行流式细胞仪的检测。
1.3 统计学处理 采用SPSS10.0软件进行统计学处理,计量资料以表示,采用方差分析,组间比较采用S-N-K法(q检验),检验水准α=0.05,以P>0.05为差异有统计学意义。
2 结 果
2.1 EZH2-siRNA对EZH2mRNA表达的影响 转染siRNA下调T24细胞内EZH2mRNA表达,药物筛选后建立的细胞系经实时荧光定量PCR检测EZH2的mRNA相对表达量,RT-PCR结果示:空白对照组1.187±0.052、阴性对照组1.192±0.025、干扰1组0.185±0.012、干扰2组0.027±0.009、干扰3组0.157±0.017;3个干扰组细胞EZH2mRNA相对表达均低于空白、阴性对照组,差异有统计学意义(P<0.05)。阴性对照组与空白对照组相比较,差异无统计学意义(P>0.05)。其中,半定量PCR显示干扰2组效果最好,表达最低,用于后续实验,由于阴性对照组与空白对照组之间比较差异无统计学意义,所以后续试验均采用干扰2组与阴性对照组之间比较。见图1。
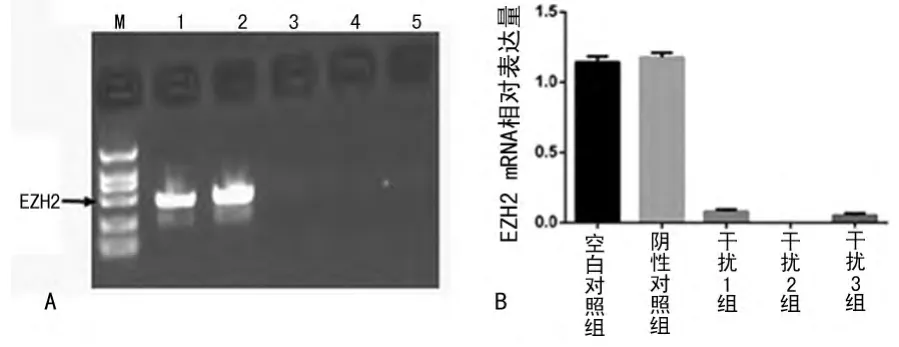
图1 半定量PCR检测EZH2-siRNA对EZH2mRNA达的影响

图2 MTT检测EZH2-siRNA对T24细胞增殖能力的影响
2.2 EZH2表达沉默对T24细胞增殖活性的影响 MTT检测法结果示:干扰2组细胞从转染后24h起,细胞增殖速度开始变得缓慢,其明显慢于阴性对照组,其抑制率分别为36.2%、37.1%、37.9%和30.8%,38.2%,差异均有统计学意义(P<0.01),见图2。
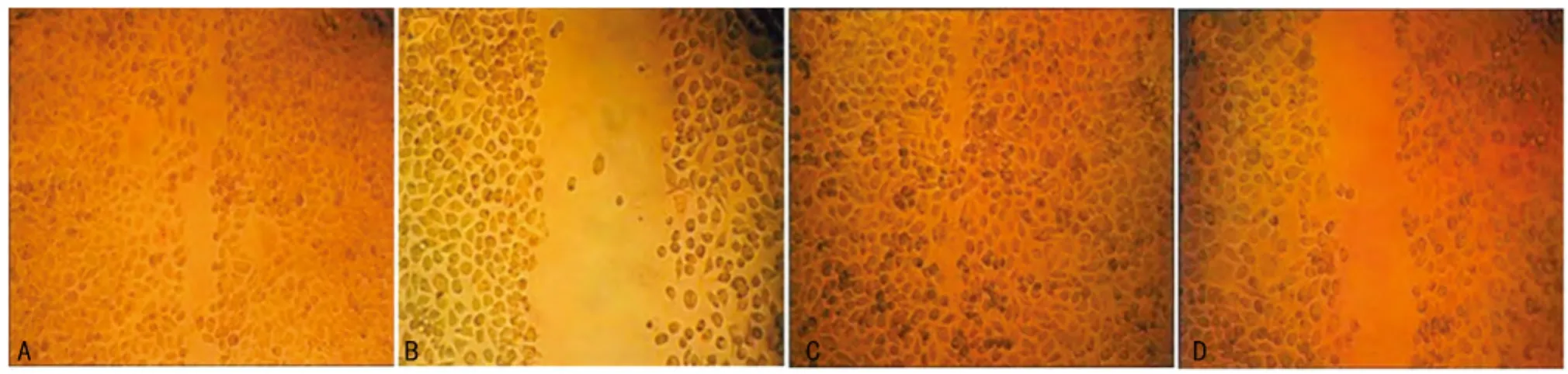
图3 划痕实验检测EZH2-siRNA对T24细胞迁移能力的影响(×200)
2.3 划痕实验检测细胞迁移能力 划痕实验结果显示:划痕处理24h后,阴性对照组和转染2组细胞的迁移距离分别为(1.98±0.07)μm和(1.37±0.12)μm。与阴性对照组比较,干扰2组细胞水平运动距离明显降低,差异有统计学意义(P<0.01),见图3。
2.4 EZH2表达沉默对T24细胞凋亡的影响 Annexin-v/PI双染,转染48h后阴性对照组早、晚期T24细胞凋亡率分别为7.31%和2.49%,而干扰2组为22.8%和3.60%,与阴性对照组比较,干扰2组早期凋亡率差异有统计学意义(P<0.01),提示EHZ2基因的沉默增加了T24细胞早期凋亡,见图4。
2.5 EZH2表达沉默对T24细胞基质侵袭能力的影响 Transwell细胞小室检测细胞侵袭能力结果显示:光学显微镜下观察计数膜背面干扰2组较阴性对照组侵入细胞数量明显减少,差异有统计学意义(P<0.01),见图5。

图4 采用Transwell细胞小室法检测EZH2-siRNA对T24细胞侵袭能力的影响(×200)

图5 流式细胞术检测EZH2-siRNA沉默对T24细胞凋亡的影响
3 讨 论
多梳蛋白抑制性复合物2(polycomb repressor complex 2,PRC2)是组蛋白H3第27位赖氨酸特异性的甲基化转移酶,通过沉默与细胞分化、抑制增殖在内的基因而导致肿瘤的发生,而EZH2是PRC2中起催化作用的核心蛋白,它参与染色质结构的形成、基因表达调节及生长控制,因而具有多潜能性[8-9]。EZH2在PcG和TrxG蛋白复合物的形成、造血细胞发育分化、X染色体灭活、甚至恶性肿瘤形成等过程均具有重要作用。
目前,关于EZH2作为癌基因与恶性肿瘤的发生发展、转移侵袭能力及预后的相关性已逐渐成为研究的热点[10]。Wan等[11]定量分析EZH2表达与肺癌的相关性,发现随着肺癌的发展,EZH2的阳性单位值(PU)逐渐升高,提示在肺癌的发展和转移过程中,EZH2可能发挥了重要的作用。Hang等[12]发现,EZH2在膀胱上皮癌中普遍高表达,并与其恶性程度呈正相关,表明EZH2基因在膀胱上皮癌的发生、发展中可能起重要作用,据此推测EZH2可作为膀胱癌的一个有效的生物标志物,并可能成为其潜在的治疗靶点。
近年来,siRNA沉默基因表达在功能基因组学研究领域中受到越来越多的重视,已被广泛应用于肿瘤相关基因的功能研究。研究发现在膀胱移行细胞癌中,microRNA-101能直接抑制EZH2的表达而改变染色质的结构,进而减弱肿瘤细胞的增殖能力[13]。Bo等[14]研究认为,microRNA-203能抑制Bcl-w的表达而促进膀胱癌细胞的凋亡,从而减弱细胞的增殖。Guo等[15]发现在膀胱癌细胞中 microRNA-144的表达降低,microRNA-144通过EZH2/Nkd1通路调节 Wnt信号从而抑制EZH2的表达。
本研究通过RNA干扰技术沉默EZH2基因,探讨其对膀胱癌T24细胞活性和凋亡的影响。为了明确EZH2表达在T24细胞生物活性过程中的作用,本研究利用基因工程的手段在体外构建人EZH2基因的siRNA的质粒表达载体,并将其转染入T24细胞,实时荧光定量PCR实验检测其对T24细胞EZH2基因表达的沉默效果。检测结果显示,3个干扰组细胞EZH2的mRNA表达均低于其他对照组,EZH2表达水平基本被沉默,可构建EZH2基因功能分析的体外实验细胞模型。
肿瘤细胞的持续分裂与无限增殖能力是肿瘤恶性程度的重要标志。本研究通过细胞增殖实验分析阻断EZH2表达后T24细胞增殖能力的变化,MTT检测结果显示从转染后24h起,其抑制率分别为36.2%、37.1%、37.9%、30.8%、38.2%。干扰2组细胞增殖速度明显慢于阴性对照组,提示EZH2沉默能抑制T24细胞的增殖活性。
肿瘤细胞侵袭力是影响患者预后及生存率的关键因素。本研究通过Transwell细胞小室检测T24细胞侵袭能力的改变。光学显微镜下观察计数膜背面细胞侵入T24细胞的数量,干扰2组较对照组侵入细胞数量明显减少。提示转染入EZH2-siRNA的T24细胞的侵袭能力明显减弱。
迁移在肿瘤细胞转移过程中也必不可少。肿瘤细胞与母体瘤分离,穿过血管壁、侵袭正常组织,需要一定的运动能力。本法借鉴体外细胞致伤愈合实验模型测定肿瘤细胞在细胞外基质上的运动特性,结果显示:划痕处理24h后,阴性对照组和干扰2组细胞的迁移距离分别为(1.98±0.07)μm和(1.37±0.12)μm。与阴性对照组相比,干扰2组细胞水平运动距离明显降低。提示转染入EZH2-siRNA的T24细胞的迁移能力明显减弱。
为了检测EZH2基因沉默对T24细胞凋亡的影响,本研究进行了Annexin-v/PI双染,结果显示:转染48h后干扰2组早、晚期T24细胞凋亡率分别为为22.8%和3.60%,较阴性对照组均增加,以早期尤为明显,表明EHZ2基因沉默能够增加T24细胞凋亡,提示EZH2可能对于膀胱癌T24细胞存在直接的治疗作用新靶点。
综上所述,EZH2与T24膀胱癌细胞的活性及凋亡密切相关,靶向抑制T24膀胱癌细胞内EZH2表达可抑制T24膀胱癌细胞增殖、侵袭和迁移能力,并促进其凋亡。本研究为深入了解EZH2在T24膀胱癌细胞侵袭和转移过程中的分子调控机制研究及为EZH2成为T24膀胱癌细胞的潜在分子标志物和靶向治疗的新靶点鉴定了基础。
[1]Ploeg M,Aben KK,Kiemeney LA.The present and future burden of urinary bladder cancer in the world[J].World J Urol,2009,27(3):289-293.
[2]Chang CJ,Hung MC.The role of EZH2in tumour progression[J].Br J Cancer,2012,106(2):243-247.
[3]Zhang H,Zhao M,Lv Z,et al.MiR-138Inhibits Tumor Growth Through Repression of EZH2in Non-Small Cell Lung Cancer[J].Cell Physiol Biochem,2013,31(1):56-65.
[4]Ferraro A,Mourtzoukou D,Kosmidou V,et al.EZH2is regulated by ERK/AKT and targets integrin alpha2gene to control Epithelial-Mesenchymal Transition and anoikis in colon cancer cells[J].Int J Biochem Cell Biol,2013,45(2):243-254.
[5]Ntziachristos P,Tsirigos A,Van Vlierberghe P,et al.Genetic inactivation of the polycomb repressive complex 2in T cell acute lymphoblastic leukemia[J].Nat Med,2012,18(2):298-301.
[6]Shin YJ,Kim JH.The role of EZH2in the regulation of the activity of matrix metalloproteinases in prostate cancer cells[J].PLoS One,2012,7(1):e30393.
[7]Garipov A,Li H,Bitler BG,et al.NF-YA underlies EZH2 upregulation and is essential for proliferation of human epithelial ovarian cancer cells[J].Mol Cancer Res,2013,20(4):513-520.
[8]Sauvageau M,Sauvageau G.Polycomb group proteins:multi-faceted regulators of somatic stem cells and cancer[J].Cell Stem Cell,2010,7(3):299-313.
[9]Xiao Y.Enhancer of zeste homolog 2:apotential target for tumor therapy[J].Int J Biochem Cell Biol,2011,43(4):474-477.
[10]Takawa M,Masuda K,Kunizaki M,et al.Validation of the histone methyltransferase EZH2as a therapeutic target for various types of human cancer and as a prognostic marker[J].Cancer Sci,2011,102(7):1298-1305.
[11]Wan L,Li X,Shen H,et al.Quantitative analysis of EZH2 expression and its correlations with lung cancer patients′clinical pathological characteristics[J].Clin Transl Oncol,2013,15(2):132-138.
[12]Wang H,Albadine R,Magheli A,et al.Increased EZH2protein expression is associated with invasive urothelial carcinoma of the bladder[J].Urol Oncol,2012,30(4):428-433.
[13]Friedman JM,Liang G,Liu CC,et al.The putative tumor suppressor microRNA-101modulates the cancer epigenome by repressing the polycomb group protein EZH2[J].Cancer Res,2009,69(6):2623-2629.
[14]Bo J,Yang G,Huo K,et al.microRNA-203suppresses bladder cancer development by repressing bcl-w expression[J].FEBS J,2011,278(5):786-792.
[15]Guo Y,Ying L,Tian Y,et al.miR-144downregulation increases bladder cancer cell proliferation by targeting EZH2and regulating Wnt signaling[J].FEBS J,2013,280(18):4531-4538.

