Bcl-6共抑制因子样蛋白及E钙黏蛋白在胃癌中的表达及相关性分析
王金泗,陈晓耕,林孟波
(福建省立医院肿瘤外科,福州 350001)
肿瘤生物学研究显示恶性肿瘤的发生是一个多步骤的过程并涉及许多基因修饰,细胞与细胞之间黏附缺失与肿瘤进展和侵袭转移相关,该过程涉及包括小窝蛋白(caveolin-1)、E钙黏蛋白(E-cadherin)和β连环蛋白(β-catenin)在内的许多细胞膜分子和基因[1-4]。E-cadherin主要参与调节上皮细胞与细胞之间黏附,与肿瘤的侵袭转移能力密切相关,在胃癌和卵巢癌等许多恶性肿瘤中,E-cadherin表达下调或缺失是侵袭性肿瘤的重要特征,并与患者不良预后相关[5]。Bcl-6共抑制因子样蛋白1(BCL6corepressor-like 1,BCORL1)是近期研究证实的一种转录共抑制因子,其与组蛋白脱乙酰基酶(HDAC)活性相关,BCORL1通过与C-末端结合蛋白(CtBP)协同或单独与E-cadherin启动子结合,从而抑制E-cadherin基因转录[6]。本课题拟通过免疫组织化学染色技术检测BCORL1和E-cadhein在胃癌及对应癌旁组织中的表达,分析其与胃癌临床病理参数的相关性及两者表达的相关性,初步探讨BCORL1及E-cadherin在胃癌发生发展、侵袭转移中的作用,为胃癌治疗提供新的思路。
1 资料与方法
1.1 一般资料 58例胃癌及对应癌旁组织来源于2007年1月至2009年10月本院病理科保存的手术切除标本,其中男49例,女9例,年龄29~78岁,平均(59.6±10.4)岁。中分化管状腺癌和黏液癌归为分化型肿瘤,实体低分化腺癌、非实体低分化腺癌及印戒细胞癌归为未分化癌,组织病理学诊断:分化型腺癌14例,低分化腺癌42例,未分化癌2例。TNM分期参考国际抗癌联盟(UICC)分类(6版):Ⅰ期9例,Ⅱ期7例,Ⅲ期17例,Ⅳ期25例。浸润深度分为黏膜、黏膜下、肌层和浆膜下层。所有患者术前均未行放射、化疗及免疫治疗,本研究通过本院伦理委员会审批。
1.2 方法
1.2.1 免疫组织化学染色技术检测组织中BCORL1及E-cadherin表达 采用标准生物素-链霉菌抗生物素蛋白-过氧化物酶(SP)法对4μm石蜡切片进行染色。切片二甲苯脱蜡及梯度乙醇再水化之后,在10mmol/L柠檬酸盐缓冲液(pH 6.0)中煮沸20min进行抗原修复,3%双氧水封闭内源性过氧化物酶,3%牛血清清蛋白封闭1h之后,将1∶100稀释的兔抗人BCORL1多克隆抗体(HPA031775,美国Sigma)和兔抗人E-cadherin单克隆抗体(#3195,美国Cell Signaling)加于标本后,置于湿盒内4℃过夜。滴加生物素标记的二抗工作液,37℃温箱孵育20min。滴加辣根过氧化物酶标记的链霉卵白素工作液,孵育30min。滴加DAB显色,苏木素轻度复染,盐酸乙醇脱色,稀氨水反蓝,梯度乙醇脱水至透明。显微镜下观察、成像系统拍照,统计分析实验结果。
1.2.2 免疫组织化学染色评估 所有切片由两位病理科医生独立进行半定量评分,用染色强度联合阳性细胞百分比进行评分,染色强度分为4等级:阴性0分;弱阳性1分;中度2分;强阳性3分;阳性细胞百分比分级如下:阳性细胞小于或等于5%为0分,6%~25%为1分,26%~50%为2分,51~75%为3分,>75%为4分。染色强度和阳性细胞百分比评分相乘大于或等于1分则认为BCORL1或E-cadherin阳性表达[7]。
1.3 统计学处理 采用SPSS13.0统计软件进行分析,计数资料用s表示,采用χ2检验分析,相关性分析采用Spearman等级相关分析法,以P<0.05为差异有统计学意义。
2 结 果
2.1 胃癌及对应癌旁组织中BCORL1和E-cadherin的表达
对收集的58例胃癌及对应癌旁组织进行BCORL1和E-cadherin免疫组织化学染色,阳性染色为棕黄色或棕褐色,BCROL1表达主要定位在胞质和胞膜,E-cadherin表达主要定位于胞膜,见图1。BCORL1和E-cadherin在胃癌组织中的阳性表达率分别为60.3%(35/58)和27.6%(16/58),而在对应癌旁组织BCORL1和E-cadherin的阳性表达率分别为17.2%(10/58)和63.8%(37/58),两 组 差 异 有 统 计 学 意 义 (χ2=22.692,P=0.000;χ2=15.321,P=0.000)。
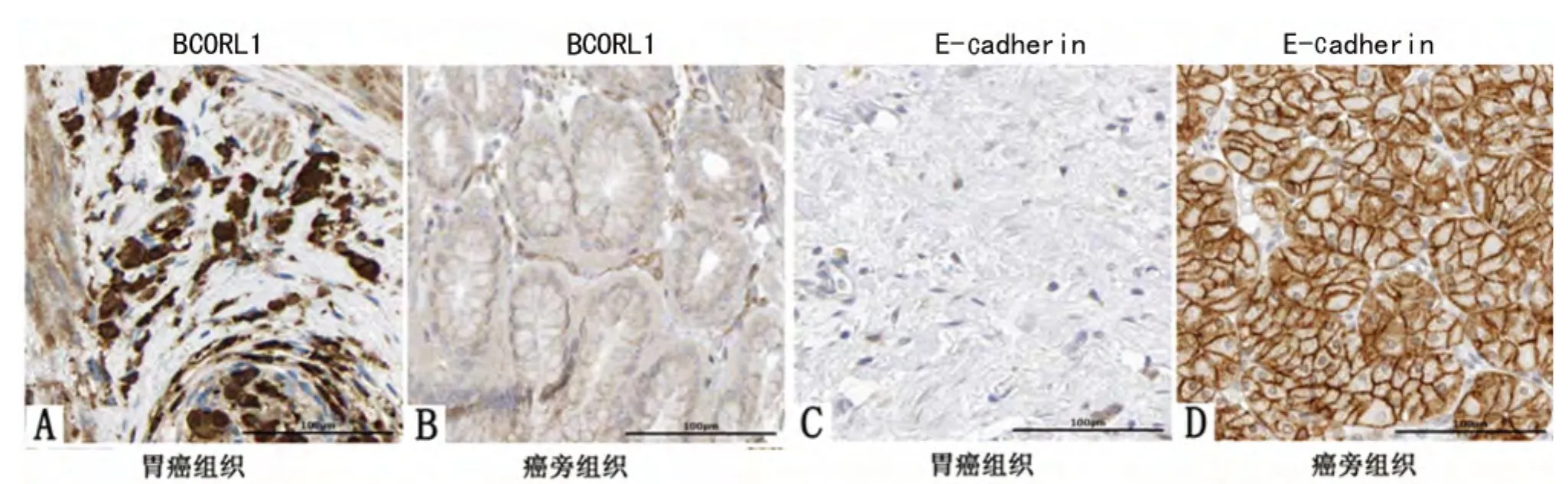
图1 BCORL1和E-cadherin在胃癌及癌旁组织中的表达(SP×400)
2.2 BCORL1和E-cadherin表达与胃癌临床病理参数的关系
BCORL1及E-cadherin表达与胃癌临床病理参数的相关性分析结果见表1。BCORL1和E-cadherin表达与肿瘤组织病理分化、浸润深度、淋巴结转移和TNM分期有关(P<0.05),与性别、年龄和肿瘤大小无关。
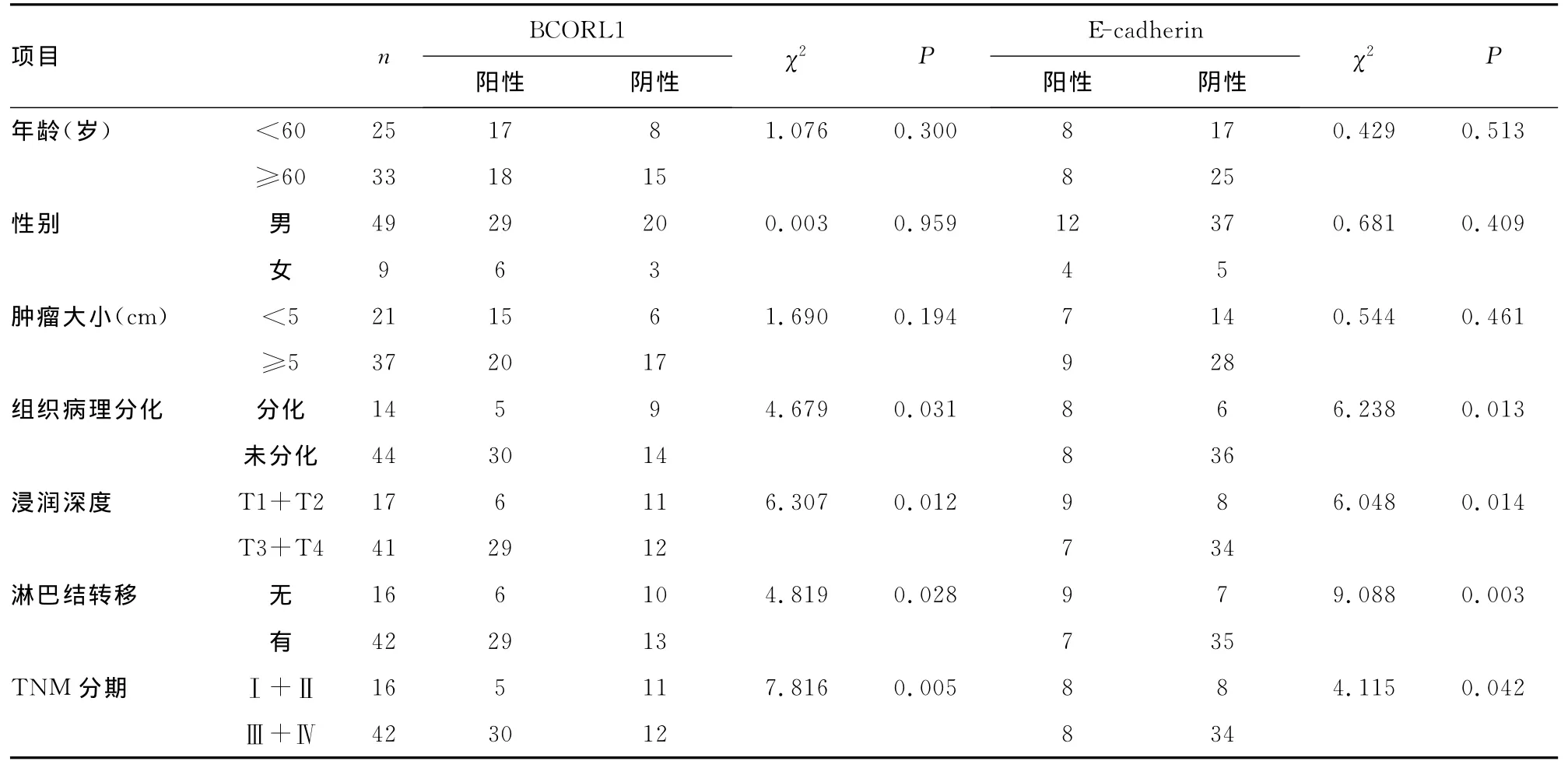
表1 BCORL1和E-cadherin表达水平与胃癌临床病理参数的关系(n)
2.3 胃癌组织中BCORL1与E-cadherin表达的相关性 应用免疫组织化学染色评分半定量BCORL1和E-cadherin表达,Spearman等级相关分析结果显示在胃癌组织中的BCORL1与 E-cadherin表 达 呈 负 相 关 (r= -0.571,P=0.002)。
3 讨 论
BCORL1基因定位于X染色体,是一个转录共抑制因子,功能研究发现其可以与Ⅱ类组蛋白脱乙酰基酶(HDAC4、HDAC5和HDAC7)结合,与CTBP1共抑制因子相互作用抑制E-cadherin表达[8-10]。在多数正常组织中 BCORL1低表达,而在睾丸和前列腺组织中高表达,有研究通过测序分析肝细胞癌的特征,发现在肝细胞癌中BCORL1与EFL1形成融合基因,其mRNA表达水平比正常癌旁组织高出6倍多,提示BCORL1是一个肿瘤相关基因[11]。但是在6%的急性髓性白血病(AML)患者以及21%的AML细胞系中的存在BCORL1基因突变,提示BCORL1是一个新的候选肿瘤促进基因[9]。本研究发现胃癌组织中BCORL1蛋白阳性表达率显著高于对应癌旁组织,其在未分化、浸润较深、淋巴结转移和高TNM分期肿瘤中阳性表达率显著升高,提示BCORL1可能作为癌基因发挥相应功能。E-cadherin低表达或缺失与胃癌侵袭转移密切相关,功能学研究发现下调E-cadherin可减弱细胞与细胞黏附能力,导致肿瘤细胞更容易浸润和转移。本研究发现E-cadherin在胃癌组织中的阳性表达率显著低于对应癌旁组织,其在未分化、浸润较深、淋巴结转移和高TNM分期肿瘤中阳性表达率显著降低,提示E-cadherin表达减少促进胃癌进展。
从基因表达到运输以及细胞表面蛋白质转换,E-cadherin的表达在多个水平被调控,许多转录抑制因子被报道能与E-cadherin启动子区域的E-box序列结合诱导其表达下调,如锌指蛋白Snail/Slug超家族以及 ZEB1和 ZEB2[12-13]。另外一个导致E-cadherin沉默的相关机制是启动子超甲基化[14]。在胃癌形成中E-cadherin是一个标准的肿瘤抑制基因,与散在和遗传类型胃癌的发生发展相关,而E-cadherin遗传种系突变是导致遗传性弥漫型胃癌的重要原因[15]。本研究分析了BCORL1及E-cadherin在胃癌组织中表达的相关性,发现BCORL1与E-cadherin蛋白表达显著负相关,提示BCORL1在胃癌中可能也通过转录抑制E-cadherin表达,从而促进肿瘤侵袭转移。目前BCORL1在恶性肿瘤中的研究相对较少,本研究通过检测其在胃癌及癌旁组织中的表达以及其与经典抑癌基因E-cadherin的相关性,初步推测其在胃癌中可能是一个癌基因,通过转录抑制E-cadherin发挥促癌功能,但具体的功能及精确的分子机制有待进一步研究。
[1]Sun GY,Wu JX,Wu JS,et al.Caveolin-1,E-cadherin and β-catenin in gastric carcinoma,precancerous tissues and chronic non-atrophic gastritis[J].Chin J Cancer Res,2012,24(1):23-28.
[2]Zheng X,Yao Y,Xu Q,et al.Evaluation of glioma-associated oncogene 1expression and its correlation with the expression of sonic hedgehog,E-cadherin and S100a4in human hepatocellular carcinoma[J].Mol Med Rep,2011,3(6):965-970.
[3]李超,涂康生,郑鑫,等.MicroRNA-218在肝细胞癌中的表达及功能[J].南方医科大学学报,2013,33(8):1127-1131.
[4]宋隆明.SOX7对胃癌MKN45细胞株体外迁移侵袭的影响[J].重庆医学,2012,41(24):2504-2505,2509.
[5]陈晓燕,袁瑞.卵巢癌组织中HMGB1和E-cadherin的表达及其意义[J].重庆医科大学学报,2012,37(7):614-617.
[6]Pagan JK,Arnold J,Hanchard KJ,et al.A novel corepressor,BCOR-L1,represses transcription through an interaction with CtBP[J].J Biol Chem,2007,282(20):15248-15257.
[7]靳文剑,张焜和,陈火国,等.EphA2在肝细胞癌中的表达及临床意义[J].重庆医学,2013,42(20):2361-2363.
[8]Tiacci E,Grossmann V,Martelli MP,et al.The corepressors BCOR and BCORL1:two novel players in acute myeloid leukemia[J].Haematologica,2012,97(1):3-5.
[9]Li M,Collins R,Jiao Y,et al.Somatic mutations in the transcriptional corepressor gene BCORL1in adult acute myelogenous leukemia[J].Blood,2011,118(22):5914-5917.
[10]Lose F,Arnold J,Young DB,et al.BCoR-L1variation and breast cancer[J].Breast Cancer Res,2007,9(4):R54.
[11]Totoki Y,Tatsuno K,Yamamoto S,et al.High-resolution characterization of a hepatocellular carcinoma genome[J].Nat Genet,2011,43(5):464-469.
[12]Ohama T,Wang L,Griner EM,et al.Protein Ser/Thr phosphatase-6is required for maintenance of E-cadherin at adherens junctions[J].BMC Cell Biol,2013,14(1):42.
[13]Carneiro P,Fernandes MS,Figueiredo J,et al.E-cadherin dysfunction in gastric cancer--cellular consequences,clinical applications and open questions[J].FEBS Lett,2012,586(18):2981-2989.
[14]Catalano MG,Fortunati N,Pugliese M,et al.Histone deacetylase inhibition modulates E-cadherin expression and suppresses migration and invasion of anaplastic thyroid cancer cells[J].J Clin Endocrinol Metab,2012,97(7):E1150-E1159.
[15]Chen Y,Kingham K,Ford JM,et al.A prospective study of total gastrectomy for CDH1-positive hereditary diffuse gastric cancer[J].Ann Surg Oncol,2011,18(9):2594-2598.

