奶山羊乳房炎灭活疫苗的制备及免疫效果检测
侯伟杰,张立强,高 洋,赵玄多,赵燕清,刘 方,高晶晖,张淼涛,陈德坤
(西北农林科技大学动物医学院,陕西杨凌712100)
奶山羊乳房炎常发生于泌乳期,在产前及干乳期有时也发生此病[1]。调查显示,目前我国奶山羊隐性乳房炎的检出率较高,陕西为45.5%,山东为50.9%,云南为35.6%,全国平均为43%左右[2],与世界平均水平45%~50%[3]相当。乳房炎不仅会降低乳产量和乳质量,造成严重的经济损失,还会直接影响奶山羊的泌乳机能,导致乳腺失去泌乳性能,甚至造成羊只死亡,是对奶山羊养殖业危害最严重的疫病之一。传统的抗生素疗法,不仅造成耐药菌株的大量产生,同时还带来严重的食品安全隐患[4-6]。利用疫苗来控制传染性疾病是一种经典预防手段。利用疫苗防治奶山羊乳房炎不仅有助于降低乳腺感染程度,还可控制亚临床乳房炎。奶山羊隐性乳房炎的主要病原菌是葡萄球菌和大肠埃希菌,其中葡萄球菌又分为金黄色葡萄球菌和凝固酶阴性葡萄球菌,后者包括表皮葡萄球菌和产色葡萄球菌[7]。据此,我们利用本实验室分离保存的隐性乳房炎主要病原菌制备了灭活疫苗,并对疫苗的免疫效果进行了评估。
1 材料与方法
1.1 材料
1.1.1 试验用动物 处于泌乳期20d左右成年莎能奶山羊。
1.1.2 菌株 大肠埃希菌、金黄色葡萄球菌、凝固酶阴性产色葡萄球菌、凝固酶阴性表皮葡萄球菌,均为西北农林科技大学兽医免疫学实验室分离鉴定保存的奶山羊乳房炎病原菌。
1.1.3 主要试剂及培养基 普通琼脂平板,LB液体培养基;辣根过氧化物酶标二抗(兔抗羊IgGHRP)、可溶性单组分TMB底物溶液及蛋白定量试剂盒购自天根生化科技(北京)有限公司;奶山羊隐性乳房炎诊断液由本实验室制备(配方获发明专利,授权号:ZL 200910024340.7);氯化钠,硫酸铝钾,氢氧化钠,EDTA,无水乙醇等。
1.2 方法
1.2.1 细菌悬液制备 将菌株分别接种于LB液体培养基,37℃、200r/min摇床培养12h~16h。取100μL培养菌液用平板菌落计数法计数,分别调整细菌浓度为:产色葡萄球菌和表皮葡萄球菌为5×109CFU/mL;大肠埃希菌、金黄色葡萄球菌终浓度为2.5×109CFU/mL。
1.2.2 细菌灭活 向调整好浓度的菌液中加入终浓度为3mL/L的甲醛溶液。37℃、200r/min振荡,大肠埃希菌灭活48h,葡萄球菌灭活96h后,取适量菌液涂LB平板,37℃培养24h,观察平板有无菌落形成。将灭活的菌液以12 000r/min离心5 min,弃上清、收集菌体沉淀,最后用无菌生理盐水重悬。
1.2.3 疫苗的制备 将灭活的产色葡萄球菌、表皮葡萄球菌、大肠埃希菌和金黄色葡萄球菌按照其在隐性乳房炎乳汁中的比例混合,然后按6∶1(V/V)与本实验室制备的铝胶盐佐剂充分混匀,4℃保存备用。
1.2.4 免疫试验 免疫前,用隐性乳房炎快速诊断试剂对泌乳期20d左右的81只奶山羊进行普查。根据普查结果,将奶山羊进行如下分组:10只乳房炎阴性奶山羊作为对照组,试验中不做任何处理。另外71只奶山羊按照免疫途径不同分成2组,颈部皮下免疫组(35只)和腹股沟免疫组(36只),其中颈部皮下免疫组35只奶山羊有21只乳房炎阴性、14只患隐性乳房炎;腹股沟免疫组的36只奶山羊有26只乳房炎阴性、10只患隐性乳房炎。免疫时,两组的免疫剂量均为2mL/只。首免后间隔14d,以同样的剂量和部位再次进行免疫。
1.2.5 样本采集 在免疫前及第1次免疫后10、24、60、180d采取所有羊的乳汁和血液样本。分离乳清和血清,保存于-20℃用于后续测定。
1.2.6 抗体效价测定 参照文献[8]的方法,制备病原菌的可溶性蛋白,并用蛋白定量试剂盒测定蛋白浓度后包被96孔酶标板,用棋盘滴定法确定ELISA反应的最佳条件,以阳性样本吸光值减去空白对照后,值大于且最接近1.0的为最佳包被浓度。用建立的ELISA法测定乳清、血清中各种病原菌抗体效价。P/N≥2.1判为阳性,否则判为阴性。
1.2.7 隐性乳房炎检测 分别在第1次免疫后的10、24、60、180d用奶山羊乳房炎快速诊断液检测各组隐性乳房炎奶山羊数目。
2 结果
2.1 细菌灭活效果
大肠埃希菌灭活48h,葡萄球菌灭活96h后,取100μL菌液涂LB平板,37℃,培养24h后,观察,平板上无菌落形成,表明细菌灭活完全彻底。
2.2 乳中各病原抗体测定结果
大肠埃希菌、表皮葡萄球菌、产色葡萄球菌可溶性蛋白的最佳包被浓度分别为15、15、20μg/mL;金黄色葡萄球菌则需用全菌进行包被,最佳包被浓度为1×109CFU/mL(50mL/L戊二醛)。
经过两次免疫,在一免后10d~60d范围内,两个免疫组乳中针对各病原菌抗体效价均显著高于对照组(P<0.05),针对各病原菌的抗体效价均在24d达到峰值,约为对照组的16倍左右,在60d时抗体效价约为对照组的8倍左右。此外,检测结果显示,颈部皮下和腹股沟两种免疫途径对乳中抗体效价影响不明显(图1~图4)。
2.3 血中病原菌抗体测定结果
免疫后血中大肠埃希菌、金黄色葡萄球菌及产色葡萄球菌抗体效价在24d达到峰值,约为对照组的100倍,其中颈部皮下免疫组中大肠埃希菌和产色葡萄球菌抗体效价在10d~60d范围内均显著高于对照组(P<0.05)(图5、图6、图8);表皮葡萄球菌血中抗体效价仅经颈部皮下免疫时在首免后24d显著高于对照组(P<0.05)(图7);在其他时间点同对照组相比两免疫组抗体效价有增加,但增加不明显。此外,颈部皮下和腹股沟两种免疫途径对血中抗体效价影响不明显。

图1 乳中大肠埃希菌抗体效价Fig.1 Milk antibody titers against E.coli
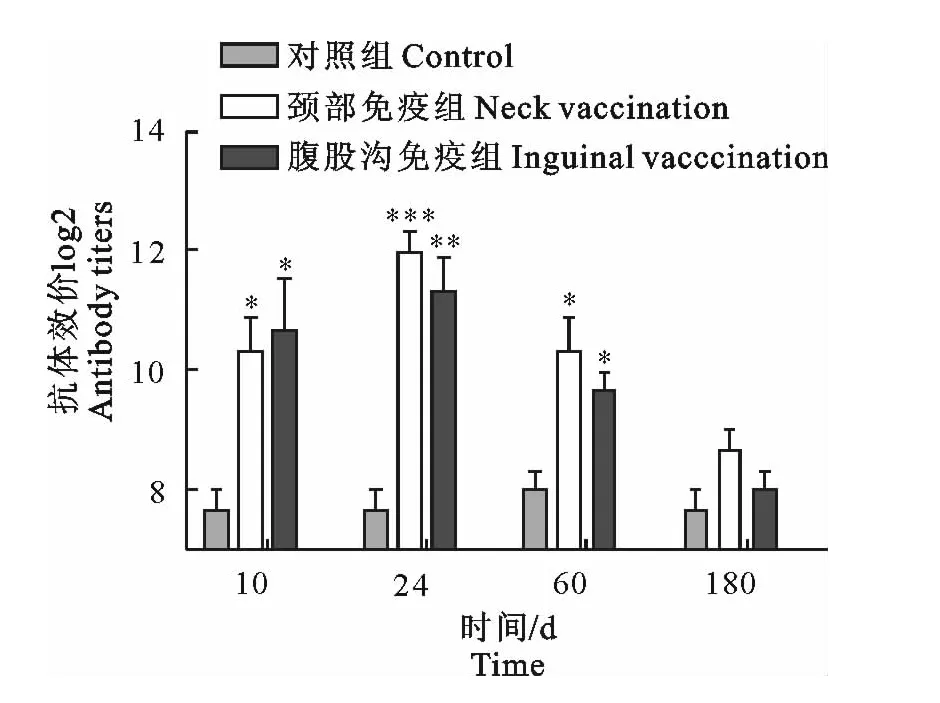
图2 乳中金黄色葡萄球菌抗体效价Fig.2 Milk antibody titers against S.aureus
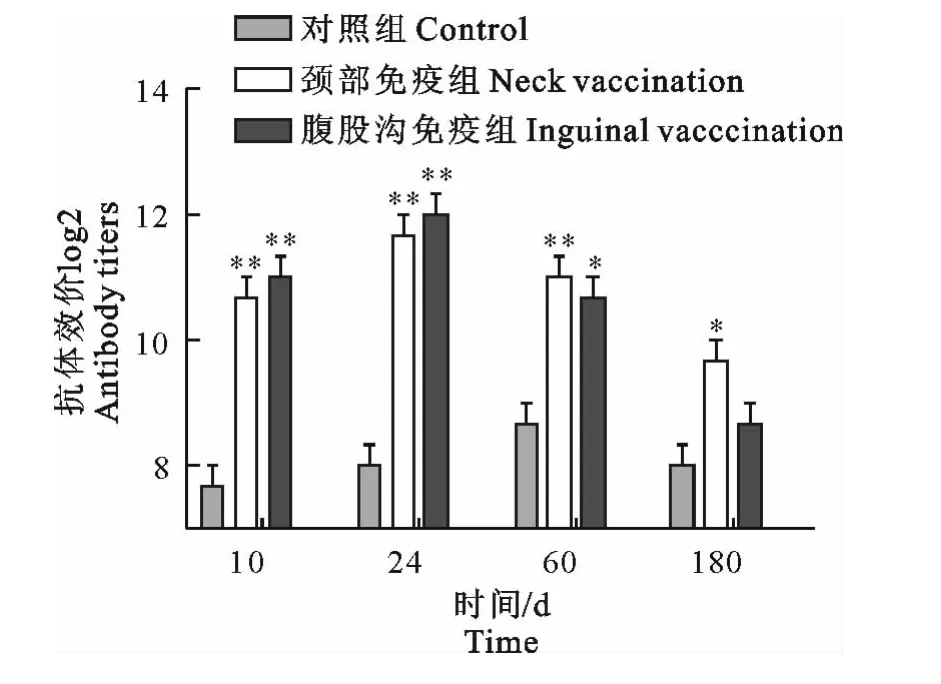
图3 乳中表皮葡萄球菌抗体效价Fig.3 Milk antibody titers aginst S.epidermidis

图5 血中大肠埃希菌抗体效价Fig.5 Serum antibody titers against E.coli

图6 血中金黄色葡萄球菌抗体效价Fig.6 Serum antibody titers against S.aureus
2.4 隐性乳房炎检出结果
在整个试验过程中,对照组的奶山羊隐性羊乳房炎均未检出。在免疫后10d~24d期间,两个免疫组隐性乳房炎奶山羊检出率均迅速下降;但24d后,腹股沟免疫组的隐性乳房炎检出率开始快速回升;60d时,检出率基本与免疫前水平持平。相比之下,颈部皮下免疫组的检出率虽然也从24d后开始回升,但升幅较慢,直到180d,该组的检出率还明显低于免疫前水平(图9)。结果表明,本研究制备的乳房炎疫苗对奶山羊隐性乳房炎有一定的治疗效果,尤其是经颈部皮下免疫时效果更显著。

图7 血中表皮葡萄球菌抗体效价Fig.7 Serum antibody titers against S.epidermidis

图8 血中产色葡萄球菌抗体效价Fig.8 Serum antibody titers against S.chromogenes

图9 不同免疫组隐性乳房炎检出率Fig.9 Subclinical mastitis rate in different immune groups
3 讨论
在泌乳早期,机体由于受到围产期内代谢改变[9-11]、巨噬细胞吞噬功能损伤及中性粒细胞活性下降[12-13]、抗体浓度及亚型变化[14]等的影响,乳腺的免疫保护作用会明显下降。此阶段乳腺更易被病原菌入侵而发生乳房炎。因此本研究选择泌乳20d左右的奶山羊作为试验对象,以更准确地反应疫苗的免疫效果。国内外大量的研究结果表明,乳汁体细胞数(Somatic cell,SC)在乳腺感染病原微生物后呈显著升高的特点,并且感染越严重,SC数量就越高[15]。因此,测定乳汁SC并据此判定山羊隐性乳房炎,是当前国内外普遍采用的方法,也是最常用的方法。相对于奶牛而言,奶山羊乳汁中的体细胞数普遍偏高,并且正常奶山羊乳汁体细胞数量变化范围更大,更容易受到物理性因素的影响[16],因而奶牛体细胞数的检测标准不适用于奶山羊。本实验室研发的奶山羊隐性乳房炎快速诊断液已获发明专利授权,通过大量的试验比对,该诊断液检测准确率高,检测结果可靠,方法简便。因而,本研究中,我们采用自行研制的奶山羊隐性乳房炎诊断液作为判定工具。
我们前期的乳房炎调查结果显示,奶山羊隐性乳房炎的病原菌主要以凝固酶阴性表皮葡萄球菌(占26%)、凝固酶阴性产色葡萄球菌(占20%)、金黄色葡萄球菌(占15%)、大肠埃希菌(占18%)[2]为主。因此,只要奶山羊对这4种病原菌产生较强的抵抗力,即可大大降低乳房炎的发病率。据此,本研究以这4种菌为材料制备灭活疫苗。
为了测定疫苗的有效保护期,本研究进行了为期180d的抗体检测。结果表明,该苗刺激机体产生的抗体持续时间长。通过对颈部皮下和腹股沟皮下两种不同的免疫途径的比较,发现不同免疫部位对机体抗体产生的影响较小,基于此,我们推荐采取颈部皮下免疫,以便于生产实践操作。
疫苗保护效果评估主要包括两个内容,即免疫指标测定和免疫保护试验(又称攻毒试验)。本研究制备的乳房炎疫苗为胞外寄生菌灭活疫苗,抗体在抗胞外菌感染中具有重要作用,因此我们测定的免疫指标是针对细菌的抗体效价。由于人工攻毒试验在攻毒剂量、攻毒途径、时间选择等因素上都无法完全模拟自然感染,故而同居感染试验结果最能够反应疫苗免疫效果。本研究的疫苗免疫试验全部在奶山羊养殖场进行,所用奶山羊在免疫前其隐性乳房炎的平均检出率在30%左右,表明其饲养环境中存在大量乳房炎病原菌。因此,在这种环境中进行疫苗免疫试验,并统计试验期间各组奶山羊乳房炎的检出率,统计结果能够更确切的反应疫苗免疫效果。本研究结果表明,我们制备的乳房炎灭活疫苗,经颈部皮下免疫接种后能够获得较理想的免疫效果。此外,一般的疫苗仅具有预防作用,接种对象也仅限于正常健康个体。而本研究制备的疫苗,还可免疫接种患隐性乳房炎的奶山羊,并且对隐性乳房炎有较好的治疗效果,具有很好的推广价值。
[1] 赵会茹,王正新.奶山羊乳房炎的诊治[J].畜牧兽医杂志2010(4):128-132.
[2] 姚运亮.我国奶山羊主要养殖省份隐性乳房炎的调查及病原菌多重PCR检测方法的建立[D].陕西杨凌:西北农林科技大学,2013.
[3] Bergonier D,Berthelot X.New advances in epizootiology and control of ewe mastitis[J].Livest Produc Sci,2003,79(1):1-16.
[4] 周庆民,薄俊平,冯万宇,等.抗生素在奶牛临床上的使用现状[J].奶牛养殖,2009(6):56-59.
[5] 刘 琴.我国牛奶中抗生素残留现状分析及对策[J].当代畜牧,2005(6):1-2.
[6] 郭 军,刘艳辉,李翠枝.乳及乳制品的抗生素和其他兽药残留问题[J].中国乳品工业,2004,32(9):28-32.
[7] 姚运亮,田婷婷,许君艳,等.关中奶山羊隐性乳房炎病原菌的分离鉴定[J].动物医学进展2013,34(4):116-119.
[8] 牟 珊,李成山,陈德坤.关中奶山羊乳房炎灭活疫苗的制备及其免疫效果测定[J].动物医学进展,2011,32(11):76-80.
[9] Waller K P.Mammary gland immunology around parturition[J].Biol Mammary Gland:Springer,2002(480):231-245.
[10] Preisler M T,Weber P S,Tempelman R J,et al.Glucocorticoid receptor expression profiles in mononuclear leukocytes of periparturient Holstein cows[J].J Dairy Sci,2000(83):38-47.
[11] Kehrli M E,Burton J L,Nonnecke B J,et al.Effects of stress on leukocyte trafficking and immune responses:implications for vaccination[J].Adv Vet Med,1999(41):61-81.
[12] Cai T-Q,Weston P G,Lund L A,et al.Association between neutrophil functions and periparturient disorders in cows[J].Am J Vet Res,1994(55):934-943.
[13] Dosogne H,Vangroenweghe F,Barrio B,et al.Decreased number and bactericidal activity against Staphylococcus aureus of the resident cells in milk of dairy cows during early lactation[J].J Dairy Res,2001(68):539-549.
[14] Mallard B A,Dekkers J C,Ireland M J,et al.Alteration in immune responsiveness during the peripartum period and its ramification on dairy cow and calf health[J].J Dairy Sci,1998(81):585-595.
[15] Poutrel B,De Crémoux R,Ducelliez M,et al.Control of intramammary infections in goats:impact on somatic cell counts[J].J Anim Sci,1997,75(2):566-570.
[16] Bergonier D,De Crémoux R,Rupp R,et al.Mastitis of dairy small ruminants[J].Vet Res,2003,34(5):689-716.

