山羊支原体山羊肺炎亚种和多杀性巴氏杆菌双重PCR 检测方法的建立
亢宁宁,刀筱芳,冯旭飞,虎 啸,马晓楠,杨发龙
(西南民族大学生命科学与技术学院,四川成都610041)
呼吸道疾病是影响山羊养殖业的重要疾病之一,主要引起山羊群体性发病、死亡或生产性能下降,给山羊养殖户造成了严重的经济损失。其中,山羊支原体山羊肺炎亚种(Mycoplasma capricolum subsp.capripneumoniae,Mccp)可引起山羊传染性胸膜肺炎,该病以严重的纤维素性胸膜肺炎为主要特性,是一种高度传染性、致死性的山羊呼吸道传染病,发病率可达到100%[1-2],该病在我国青海、甘肃等地发生并广泛流行[3-5],近年报道其可引起藏羚羊的胸膜肺炎[6]。多杀性巴氏杆菌(Pasteurella multocida)是存在于羊上呼吸道的条件致病菌,在长途运输、营养不良、过度拥挤以及其他支原体或病毒感染等条件作用下,迅速增殖而引起山羊肺炎的发生[7]。山羊支原体山羊肺炎亚种和多杀性巴氏杆菌可混合感染亦可继发感染[8-9],给疾病的诊断和治疗造成困难。
传统的细菌分离培养及鉴定费时费力,此外,支原体在体外培养较为困难,且生长周期相对较长,一般需要1周~2周,因此不常作为常规手段用于病原的鉴定、疾病的诊断及流行病学调查。而PCR技术以其快速、灵敏等优点,已逐渐成为病原鉴定和疾病诊断的常规方法。针对山羊支原体山羊肺炎亚种和多杀性巴氏杆菌,Woubit S[10]分别建立了特异性PCR方法,并已广泛用于这两种病原的检测及其感染的诊断[6,11]。由于山羊支原体山羊肺炎亚种和多杀性巴氏杆菌均可引起山羊肺炎,且可以混合感染,因此有必要建立一种能够同时检测该两种病原的双重PCR方法,从而为生产中快速、准确检测这两种病原及其感染的鉴别诊断和流行病学调查提供一种新手段。
1 材料与方法
1.1 材料
1.1.1 菌株及临床样品 丝状支原体山羊亚种Y-goat株、丝状支原体山羊亚种PG3株、无乳支原体PG2株、山羊支原体山羊肺炎亚种C87-1株及绵羊肺炎支原体Y-98株均购自中国兽医药品监察所;金黄色葡萄球菌SW07株、大肠埃希菌013株、沙门菌、多杀性巴氏杆菌及溶血性曼氏杆菌均为西南民族大学动物医学四川省高校重点实验室分离鉴定并保存。用于临床检测的26份山羊鼻腔棉拭子均采集于四川省成都市青白江区某山羊场。用于样品采集的山羊均有不同程度的呼吸道症状。
1.1.2 主要试剂 Taq DNA 聚合酶、MgCl2、dNTP及10×PCR buffer均为TaKaRa公司产品;蛋白酶K为美国Sigma公司产品;琼脂糖为英国OXOID公司产品;DNA分子量标准 Marker I和Goldview核酸染料为天根生化科技有限公司产品。
1.2 方法
1.2.1 引物信息 本研究中用于双重PCR建立的引物直接采用 Woubit S[10]和 Townsend K M 等[11]所设计的山羊支原体山羊肺炎亚种特异性引物Mccp-F/Mccp-R和多杀性巴氏杆菌特异性引物KMT1/KMT2,具体信息如表1。引物由上海生工生物工程技术服务有限公司合成。
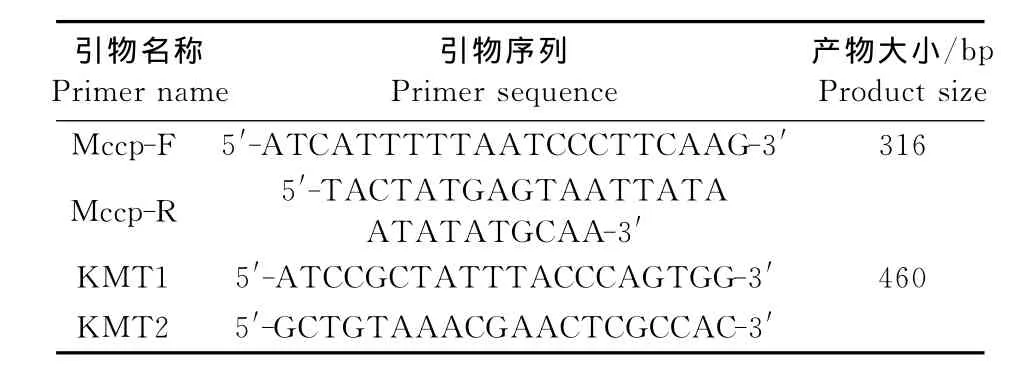
表1 引物信息Table 1 Primers used in this study
1.2.2 DNA的提取 在提取DNA前,对不同的样品进行了相应的前处理:对于鼻腔棉拭子,浸入1mL无菌水中并反复挤压,将悬液经12 000r/min离心30min,弃上清,收沉淀;对于支原体培养物,12 000r/min离心30min,收集沉淀;对于其他细菌培养物,则10 000r/min离心3min后收集沉淀。随后,采用常规酚-氯仿法提取基因组DNA,并置于-20℃保存。
1.2.3 双重PCR反应体系及反应条件优化 将两对引物分别按不同比例混合进行引物浓度比例的优化,然后分别以46 、48 、50、52 、54 、56 、58 和60℃为退火温度进行优化,所有PCR均采用下列反应体系和条件进行扩增:10×PCR buffer 2.5μL,2.5mmol/L dNTP 2μL,25mmol/L MgCl21.5 μL,10pmol/μL上、下游引物(以不同的引物比),5 U/μLTaq酶0.2μL,DNA模板2μL,灭菌去离子水补足25μL。反应条件为:95℃5min;94℃30s,退火(按上述温度梯度)30s,72℃45s,共进行35个循环;72℃10min。以扩增产物电泳条带亮度大、无非特异性扩增条带和引物二聚体少为标准选择最佳引物比例和退火温度。
1.2.4 双重PCR的特异性评价 采用上述优化反应体系和反应条件,分别以山羊支原体山羊肺炎亚种C87-1株、多杀性巴氏杆菌、丝状支原体山羊亚种Y-goat株、丝状支原体山羊亚种PG3株、无乳支原体PG2株、绵羊肺炎支原体Y-98株、金黄色葡萄球菌SW07株、大肠埃希菌013株、沙门菌和溶血性曼氏杆菌DNA为模板进行PCR扩增。
1.2.5 双重PCR的敏感性评价 从山羊支原体山羊肺炎亚种C87-1和多杀性巴氏杆菌的纯培养物中分别提取全基因组DNA。采用核酸蛋白检测仪测定其浓度,并进行10倍系列稀释,将以每个稀释度的两种细菌DNA等量混合作为模板进行PCR扩增。同时,将上述不同稀释度的模板分别进行单独PCR检测。
1.2.6 双重PCR对临床样品的检测 提取临床所采集的26份鼻拭子的全基因组DNA,同时应用所建立的双重PCR方法和单独PCR方法分别进行检测,比较两者的检出率。
2 结果
2.1 双重PCR条件优化结果
经优化,最终获得双重PCR反应的最佳退火温度为52℃,山羊支原体山羊肺炎亚种和多杀性巴氏杆菌引物的最佳浓度为10pmol/μL和10pmol/μL。
2.2 双重PCR的特异性
分别以山羊支原体山羊肺炎亚种和多杀性巴氏杆菌的基因组DNA单独或以两者等量混合后作为模板进行双重PCR扩增。同时以其他多种常见非目的病原菌DNA为模板,进行双重PCR扩增。结果表明,以单一病原DNA为模板时,分别得到316 bp或460bp的单一条带;将2种病原DNA混合后作为模板,能得到预期大小的2个条带。而对丝状支原体山羊亚种、无乳支原体、绵羊肺炎支原体、大肠埃希菌、沙门菌及金黄色葡萄球菌等均无扩增(图1)。经3次重复试验,此结果稳定。

图1 双重PCR特异性试验Fig.1 Specificity test of duplex PCR
2.3 双重PCR的敏感性
分别对山羊支原体山羊肺炎亚种和多杀性巴氏杆菌的基因组DNA进行10倍系列稀释,将各稀释度的两种DNA分别进行等量混合后作为模板,并进行双重PCR和单独PCR检测。结果表明,双重PCR对山羊支原体山羊肺炎亚种DNA的最低检测限为32 pg,对多杀性巴氏杆菌的最低检测限为50pg,其敏感性与采用一对引物的单独PCR相同(图2)。
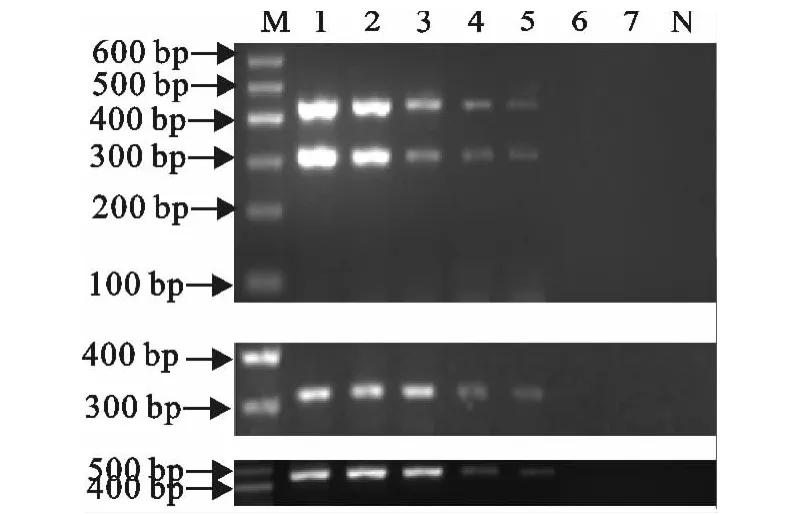
图2 双重PCR的敏感性Fig.2 Sensitivity of the duplex PCR
2.4 临床样品的检测
从患病山羊采集的26份鼻拭子中提取总DNA,然后分别用所建立的双重PCR和现有的单独PCR进行检测。结果表明,采用双重PCR方法,26份样品中山羊支原体山羊肺炎亚种和多杀性巴氏杆菌的检出率分别为23.1%(6/26)和26.9%(9/26),其中有3份鼻拭子中同时检测出山羊支原体山羊肺炎亚种和多杀性巴氏杆菌。用单独PCR检测所得到结果与双重PCR检测结果完全一致。
3 讨论
相对于单独PCR方法,多重PCR可实现一次同时检测多种病原,对一些可引起混合感染的多个病原进行检测时十分有用。针对山羊的某些其他病原,已建立了一些双重PCR方法[12-14]。山羊支原体山羊肺炎亚种和多杀性巴氏杆菌是引起山羊呼吸道传染病的重要病原[15],并且常存在两者混合感染或山羊支原体山羊肺炎亚种继发多杀性巴氏杆菌感染的现象。因此,本研究建立的可同时检测这两种病原的双重PCR技术,为其感染的快速诊断和流行病学调查提供了有用的手段。
特异性是PCR检测的关键,是对病原进行准确检测的基础。在建立双重PCR方法时,由于要同时应用两对引物,从而增加了对非目的病原产生非特异扩增的可能性。为了获得特异性较好的双重PCR方法,本研究根据国内外学者此前所建立的针对上述两种病原的PCR技术的多对引物,首先对各引物用于双重PCR的可行性进行了分析,包括对各引物间形成引物二聚体的可能性,以及产生非特异性扩增的可能性等。选择已经反复验证的具有很好特异性、理论上形成最小引物二聚体和不产生非特异扩增的引物用于本研究。本研究中对引物的特异性评价结果表明其仅对山羊支原体山羊肺炎亚种和多杀性巴氏杆菌产生阳性扩增,且获得预期大小片段,而对其他常见的羊呼吸道病原无扩增。说明本研究建立的双重PCR具有良好的特异性,这有利于对两种病原感染的准确诊断。
本研究对该双重PCR的敏感性进行了评价,并与单独PCR方法进行了比较。结果显示,所建立的双重PCR对两种病原的检测敏感性与单独PCR相同。这说明,经过反应条件和体系的优化后,将两对引物按优化的比例混合不会降低检测的敏感性。
在无需进行分离及培养的情况下,直接从临床样品中对病原DNA进行检测是PCR的优势之一。为了评价所建立的双重PCR从临床样品进行直接检测的可行性,对共计26份来自于患病山羊的鼻腔拭子进行了检测。结果显示,其中山羊支原体山羊肺炎亚种的检出率为23.1%,而多杀性巴氏杆菌的检测出率为26.9%,并且有3份样品中同时包括上述两种病原。这说明本研究建立的PCR方法可以用于临床样品的检测,不仅可以检测出感染单一病原的动物,而且对混合感染2种病原的动物同样可以进行有效检测。另一方面,检测结果也表明,由山羊支原体山羊肺炎亚种和多杀性巴氏杆菌与其他呼吸道细菌混合感染的情况普通存在,因此在预防和用药时应给予足够的重视。但本研究中对临床样品的检测旨在评价该方法对临床样品中两种病原的检测能力,由于样品数量有限,无法全面反映两种病原感染的流行病学特征。
[1] Nicholas R,Churchward C.Contagious caprine pleuropneumonia:new aspects of an old disease[J].Transbound Emerg Dis,2012,59(3):189-196.
[2] Chu Y,Gao P,Zhao P,et al.Genome sequence ofMycoplasmacapricolumsubsp.capripneumoniaeStrain M1601[J].J Bacteriol,2011,193(21):6098-6099.
[3] 郭 晗,储岳峰,赵 萍,等.山羊支原体山羊肺炎亚种甘肃株的分离及鉴定[J].中国兽医学报,2011,31(3):352-356.
[4] 赵 萍,贺 英,储岳峰,等.青海省山羊支原体山羊肺炎亚种抗体检测[J].农业科学与技术,2010,38(35):20096-20107.
[5] 赵 萍,郭 晗,贺 英,等.山羊支原体山羊肺炎亚种湖北株的鉴定及其外膜蛋白的免疫原性研究[J].畜牧兽医学报,2011,42(4):593-399.
[6] Wang Y Z,Sun T,Xia H Z,et al.Contagious caprine pleuropneumonia in endangered Tibetan antelope,China,2012[J].Emerg Infect Dis,2013,19(12):2051-2053.
[7] Wilson B A,Ho M.Pasteurella multocida:from zoonosis to cellular microbiology[J].Clin Microbiol Rev,2013,26(3):631-655.
[8] Wesonga H O,Blske G,Thiaucourt F,et al.Experimental contagious caprine pleuropneumonia:a long term study on the course of infection and pathology in a flock of goats infected with Mycoplasma capricolum subsp.capripneumoniae[J].Acta Vet Scand,2004,45(3-4):167-79.
[9] Rosário G,Isabel M,Alejandro N,et al.Atypical non-progressive pneumonia in goats[J].Vet J,2010,83(2):219-221.
[10] Woubit S,Lorenzon S,Peyraud A,et al.A specific PCR for the identification of Mycoplasma capricolumsubsp.capripneumoniae,the causative agent of contagious caprine pleuropneumonia(CCPP)[J].Vet Microbiol,2004,104(1-2):125-132.
[11] Townsend K M,Frost A J,Lee C W,et al.Development of PCR Assays for species-and type-specific identification of Pasteurella multocidaisolates[J].J Clin Microbiol,1998,36(4):1096-1100.
[12] 向智龙,程振涛,卓建华,等.山羊痘病毒和羊口疮病毒双重PCR检测方法的建立与初步应用[J].中国畜牧兽医,2011,30(1):88-91.
[13] 冯旭飞,刘 霜,张贤宇,等.绵羊肺炎支原体和多杀性巴氏杆菌双重PCR检测方法的建立及应用[J].中国兽医科学,2013,43(12):1257-1261.
[14] 杨发龙,王 华,岳 华,等.丝状支原体簇及绵羊肺炎支原体双重PCR方法的建立及应用[J].黑龙江畜牧兽医,2011,9(5):92-94.
[15] Hussain R,Auon M,Khan A,et al.Caprine pleuropneumonia in Beetal goats[J].Trop Anim Health Prod,2012,44(3):477-481.
——和田盘羊

