微生物制剂在幼龄反刍动物营养与饲料中的应用
刁其玉
(中国农业科学院饲料研究所,奶牛营养学北京市重点实验室,北京 100081)
微生态制剂(mcrobiolecological agents)的概念,1998年由Guarner和Schaafsma确定为,在微生态学理论指导下,调整微生态平衡失调,保持微生态平衡,提高宿主健康水平的正常菌群及其代谢产物和选择性促进宿主正常菌群生长的物质制剂总称[1]。它涵盖益生菌活菌及其代谢产物和灭活菌。目前世界上已有不少的国家颁布法令,禁止在动物饲料中添加抗生素,对抗生素在畜牧业中的使用控制得更加严格。微生物制剂作为绿色饲料添加剂克服了抗生素所带来的负面影响,越来越受到重视,其开发和应用对养殖业的发展起到了积极的作用,光辉的抗生素时代之后,将是一个崭新的微生态时代。幼畜阶段是动物一个重要的生理时期,这个阶段的生长发育关系到其一生中的健康与生产性能,初生动物的消化道基本是微生物的空白,引入微生物制剂促进幼畜消化系统发育和机体健康,无疑是从起点抓起,微生物制剂对幼畜的效果会从不同的方面得以体现,本文就本团队近年来的部分工作作一综述。
1 幼龄反刍动物应用微生物制剂的特殊性
关于微生物制剂在反刍动物营养与饲料中的应用一直存在争议。有观点认为,反刍动物具有庞大的瘤胃微生物区系,微生物种类和数量巨多,额外添加微生物制剂作用不明显。也有观点认为,尽管反刍动物的瘤胃功能强大,但通过优化瘤胃内的主导菌群结构,补充缺少的微生物,可以对瘤胃内环境起到积极作用。
新生动物要经历营养、环境和心理三大方面的应激,从胚胎期胎儿的生存环境温度的稳定到出生后的变温环境;无菌羊水的胎盘到有菌的圈舍;胎儿养分从由脐带供给到出生后由消化道主动吸收,出生是新生动物的第1个应激[2]。幼龄动物适应了母乳之后,快速生长发育,随后又迎来第2个应激,即断奶应激,断奶时经历与母亲的分开,完成从采食液体母乳到固体配合饲粮的转变,营养成分也从母乳中富含的脂肪、乳糖和酪蛋白转变为固体饲料中含有的植物蛋白质、碳水化合物、脂肪等营养素,这一系列的生理应激发生在猪的3~4周、反刍动物的8周之内,可以说动物的幼龄生长发育充满了机遇与风险,是幼畜必须闯过的关口。
普遍认为,微生物制剂在动物体内的主要功能有:维持肠道正常微生物菌群;改善新陈代谢,提高营养物质的消化和吸收[3-4]。因此,应用微生物制剂可以提高动物生长率,降低死亡率,改善饲料转化率[5],提高动物免疫力,增强抗病力,刺激免疫系统细胞产生不同类型细胞因子,在诱导和调节免疫系统起重要作用[6]。这些效果是否会在幼龄反刍动物的生长发育中发挥作用,受不同环境和饲料条件的影响,目前微生物制剂在反刍动物,特别是幼龄反刍动物的应用研究成为热点。幼龄反刍动物处于胃肠道快速发育的阶段,此时的营养和调节剂供给更需要关注对幼畜胃肠道健康、瘤胃微生物区系建立、免疫机能建立的作用效果,最大程度地降低生理应激,保障幼畜的健康发育。
2 微生物制剂在幼龄反刍动物上的应用效果
幼龄反刍动物饲粮中添加微生物制剂的作用一直也模棱两可,有些研究证实其可以提高生长性能,而有些研究则反映没有影响。Frizzo等[7]和Signorini等[8]采用 Meta 分析法统计了 1980—2010年发表的66篇文献,这些研究都是针对饲喂牛奶或代乳品的未断奶犊牛的,结果发现,饲喂的微生物制剂主要集中于乳酸杆菌、双歧杆菌、芽孢杆菌、屎肠球菌,且提高了饲喂代乳粉犊牛的饲料转化率和生长率,因此微生物制剂可作为抗生素的替代品用于促进犊牛生长;添加乳酸杆菌可降低饲喂全奶犊牛的腹泻发生率和改变粪便中乳酸杆菌∶大肠杆菌,但对饲喂代乳粉的犊牛没有影响。添加纳豆芽孢杆菌可促进断奶后犊牛瘤胃及肠道中主要的纤维分解菌(如琥珀酸丝状杆菌、黄色瘤胃球菌、白色瘤胃球菌、溶纤维丁酸弧菌和脂解厌氧弧杆菌)在消化道中的定植和生长[9]。地衣芽孢杆菌培养物增加了瘤胃内中性洗涤纤维、酸性洗涤纤维和有机物质的表观消化率[10]。
2.1 微生物制剂对哺乳期犊牛瘤胃微生物区系的影响
新生反刍动物的消化道几乎是无菌状态,胃肠道pH接近中性,有利于肠道病原菌的生长。饲喂微生物制剂可以促进其瘤胃发育和调节瘤胃pH,并能促进犊牛提前断奶。本团队成员符运勤[11]以地衣芽孢杆菌(B组)、地衣芽孢杆菌和枯草芽孢杆菌复合菌(C组)、地衣芽孢杆菌及枯草芽孢杆菌和植物乳酸杆菌三者复合菌(D组)饲喂0~8周龄哺乳期犊牛,与不添加微生物制剂的对照组(A组)进行比较。结果表明,饲粮中添加地衣芽孢杆菌单菌显著提高了犊牛平均日增重(ADG)和体躯指数;各试验组粪便评分有降低的趋势,血清生化指标差异不显著。通过对瘤胃发酵参数和瘤胃液细菌变性梯度凝胶电泳(DGGE)及PCR定量分析发现,饲粮中添加地衣芽孢杆菌及其复合菌可以提高犊牛瘤胃发酵参数的稳定性,提高了8周龄犊牛瘤胃液细菌种类数目和优势条带数,促进了瘤胃纤维分解菌的定植和繁衍(表1)。从而可推断,地衣芽孢杆菌及其复合菌具有调节瘤胃内环境、提高机体抵御饲养条件变化所带来的应激等的能力,促进犊牛健康生长。
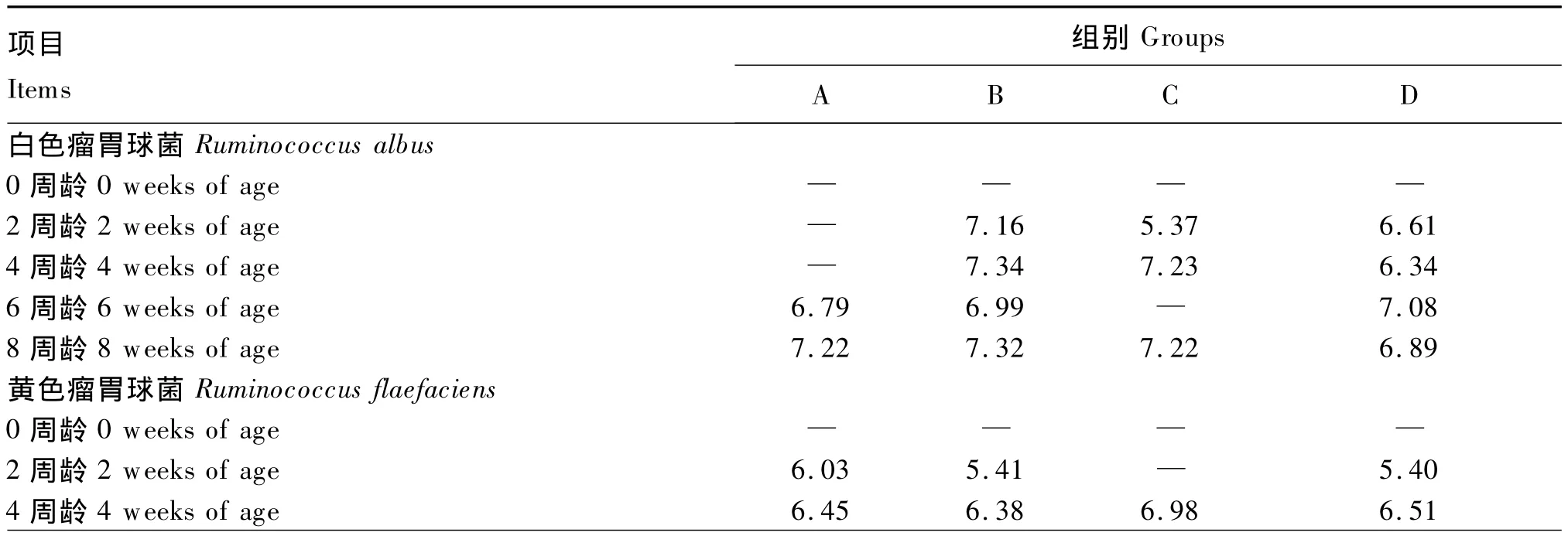
表1 地衣芽孢杆菌及其复合菌对0~8周龄犊牛瘤胃纤维分解菌的影响(灰度值的对数)Table 1 Effects of Bacillus licheniformis and its compound bacteria on rumen cellulytic bacteria in calves aged 0 to 8 weeks(data was transformed by natural logarithm of grayscale)
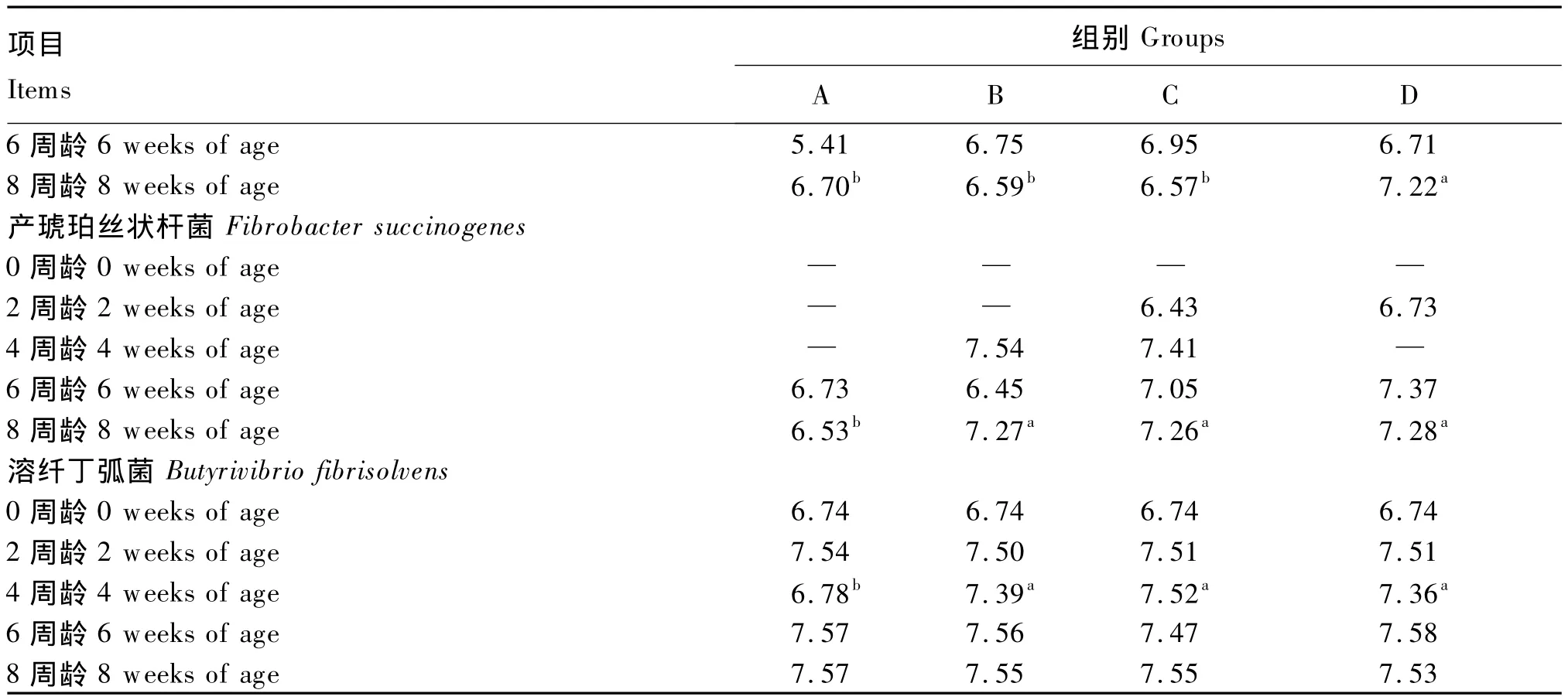
续表1
地衣芽孢杆菌与枯草芽孢杆菌、植物乳酸杆菌复合情况下对哺乳期犊牛具有积极作用,而地衣芽孢杆菌与枯草芽孢杆菌组合则效果略差,益生菌之间存在组合效应。
本团队成员董晓丽[12]以枯草芽孢杆菌和植物乳酸杆菌为研究对象,分别给哺乳期犊牛饲喂基础饲粮(CT组)、基础饲粮+植物乳杆菌[1.7×1010CFU/(h·d),LB组]、基础饲粮 +植物乳杆菌[8.6×109CFU/(h·d)]+枯草芽孢杆菌[2.0×108CFU/(h·d)](LBS组)。哺乳期犊牛饲喂微生物制剂后瘤胃内微生物区系DGGE图谱如图1。从图中可以看出,添加的植物乳杆菌(泳道1)和枯草芽孢杆菌(泳道14)的条带均未出现在其他泳道中,说明瘤胃中未检测到试验添加的益生菌。哺乳期犊牛瘤胃微生物的条带位于图谱的中下部,不同处理的犊牛瘤胃内出现相同的微生物,如标有箭头序号2、14、18、21的条带;不同处理间出现很多特异性条带,如标有箭头的 1、4、5、10、12、16。
表2表示的是饲喂微生物制剂对犊牛瘤胃微生物多样性指数的影响。从表中可以看出,不同处理的多样性指数香侬-威纳多样性指数(Shannon-Weiner diversity index)、辛普森多样性指数(Simpson’s diversity index)、均匀度(evenness index)及丰度(richness)均无显著性差异。
表3为植物乳酸杆菌和枯草芽孢杆菌对断奶后犊牛瘤胃常见细菌数量的影响,犊牛饲喂植物乳杆菌及其与枯草芽孢杆菌的复合物后,相同处理的犊牛瘤胃微生物未聚合在一起,且微生物多样性指数无显著性差异。代乳品中添加植物乳杆菌及植物乳杆菌与枯草芽孢杆菌的复合菌对犊牛常见瘤胃细菌数量未发生变化,这验证了不同菌种、不同菌种组合在反刍动物营养中的作用效果是有差异的[12]。
而继续饲喂犊牛上述微生物制剂,在断奶后0~2周,饲喂植物乳酸杆菌和枯草芽孢杆菌条件下的犊牛的瘤胃微生物区系受到影响,饲喂同样微生物制剂的犊牛,其瘤胃微生物在DGGE分析中聚合在一起,同时瘤胃黄色球菌和白色瘤胃球菌均显著降低[12]。
2.2 微生物制剂对哺乳期犊牛生长性能的影响
添加微生物制剂对哺乳期犊牛的生长性能有一定的影响。董晓丽[12]研究证实,在整个试验期及试验各阶段0~2周龄、3~4周龄、5~6周龄和7~8周龄,各组犊牛的平均日增重、总干物质采食均差异不显著。然而添加微生物制剂具有增加平均日增重的趋势,即整个试验期平均日增重:LB组>LBS组>CT组。试验2~4周龄、4~6周龄和6~8周龄,犊牛的饲料转化率无显著性差异;0~2周龄LB组的犊牛饲料转化率得到显著改善,整个试验期饲料转化率具有改善的趋势,植物乳杆菌组优于复合菌组优于对照组(表4)。

图1 断奶前犊牛瘤胃细菌16S rRNA基因V3区的PCR-DGGE图谱Fig.1 DGGE of PCR products of V3 regions of 16S rRNA gene of bacterium in rumen of pre-weaned calves
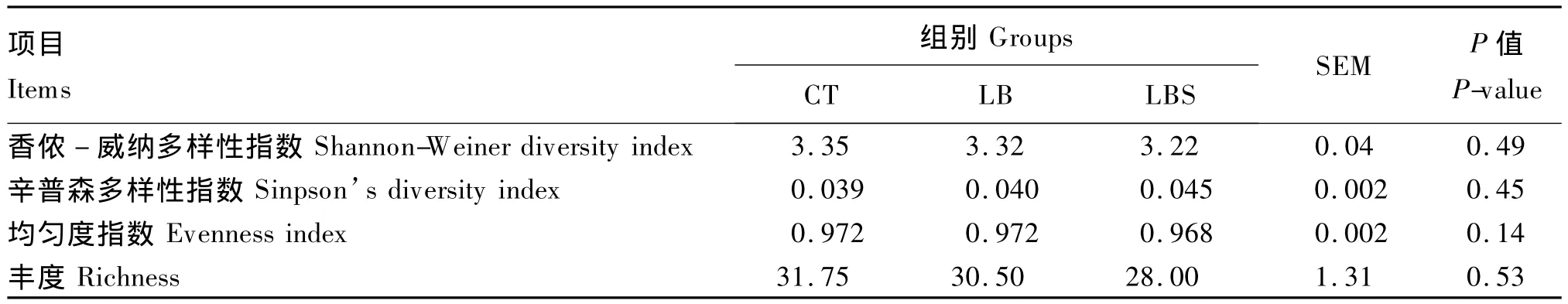
表2 参试微生物制剂对8周龄犊牛瘤胃细菌多样性指数的影响Table 2 Effects of test probiotics on diversity indices of ruminal bacterium in calves aged 8 weeks
本团队成员周盟[13]使用董晓丽[12]相同的试验设计,测定微生物制剂对营养素消化率的影响,结果表明,饲喂植物乳酸杆菌及其与枯草芽孢杆菌组合菌的犊牛,营养物质表观消化率提高,特别是磷的表观消化率显著提高,与对照组相比,氮的表观消化率提高了5.95%和7.35%,氮利用率(存留氮/摄入氮)提高了11.87%和13.99%,氮表观生物学价值(存留氮/吸收氮)提高了5.70%和6.34%(表5)。
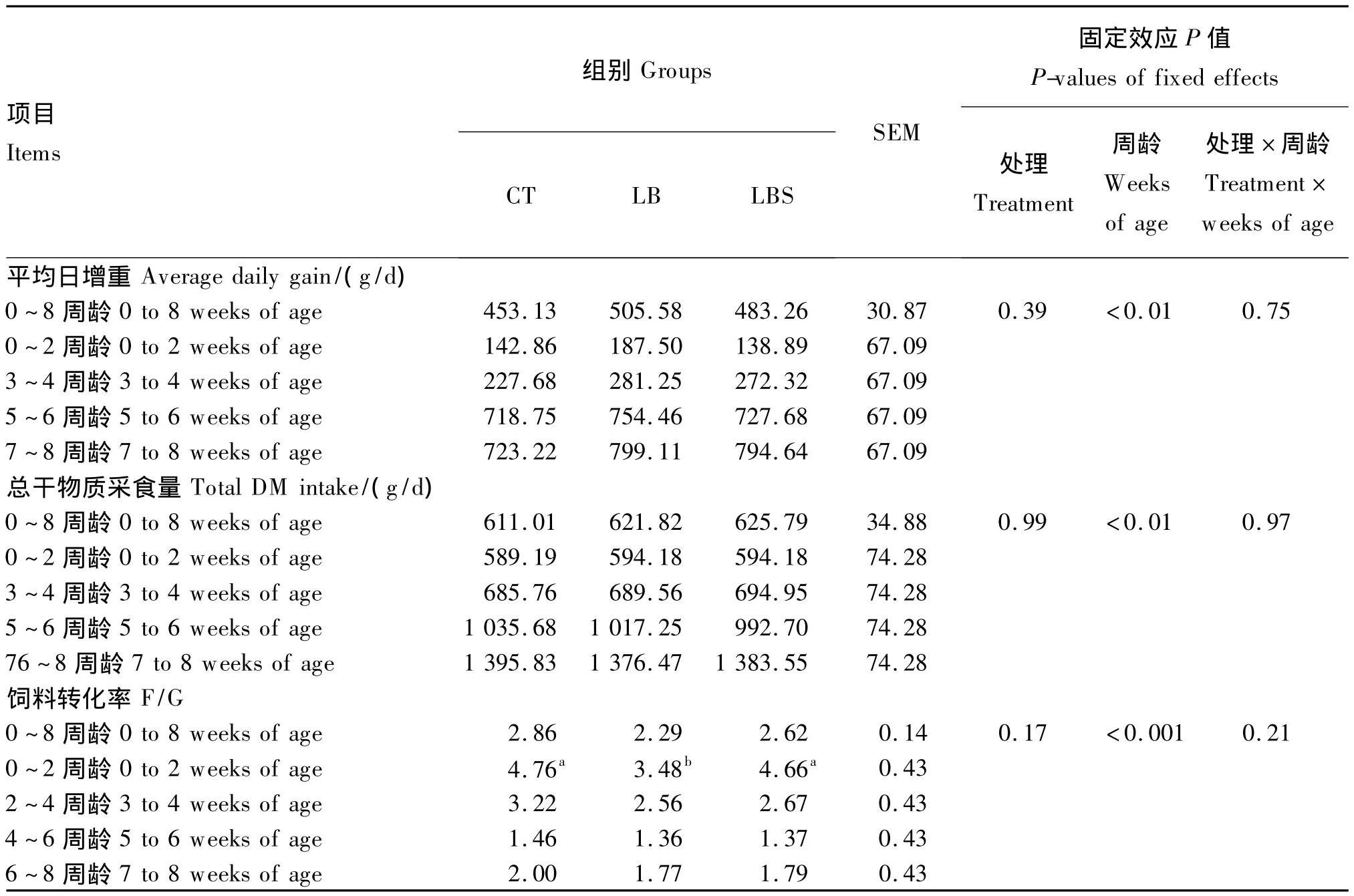
表4 微生物制剂对哺乳期犊牛生长性能的影响Table 4 Effects of probiotics on growth performance of pre-weaned calves

表5 植物乳酸杆菌和枯草芽孢杆菌对断奶后犊牛营养物质消化代谢的影响Table 5 Effects of Lactobacillus and Bacillus subtilis on nutrient digestion and metabolism of post-weaned calves
符运勤[11]给犊牛饲喂前述微生物制剂,在0~2周龄、5~6周龄和7~8周龄,各组平均日增重均无显著差异(表6),而在3~4周龄,地衣芽孢杆菌(B)组平均日增重显著高于对照(A)组和地衣芽孢杆菌+枯草芽孢杆菌(C)组,地衣芽孢杆菌+枯草芽孢杆菌+植物乳酸杆菌(D)组在数值上高于C组(366.89 vs.232.00 g/d,P=0.08)和 A 组(366.89 vs.278 g/d,P=0.50),在整个试验期,B组的平均日增重显著高于A组,C组和D组在数值上高于A组,但差异不显著。

表6 微生物制剂对犊牛平均日增重的影响Table 6 Effects of probiotics on average daily gain of calves g/d
微生物制剂对8~52周龄后备牛生长性能也具有影响。付运勤[11]在前期(0~8周龄)试验的基础上,给断奶后犊牛饲喂地衣芽孢杆菌、地衣芽孢杆菌+枯草芽孢杆菌、地衣芽孢杆菌+枯草芽孢杆菌 +植物乳酸杆菌,直至52周龄,荷斯坦后备牛体重和体长均有提高的趋势(表7),添加地衣芽孢杆菌对提高后备牛的体重有一定的作用,而地衣芽孢杆菌与其他菌的复合菌作用不稳定,不同菌种复合作用效果有一定的变异。

表7 参试微生物制剂对后备牛体重和体况的影响Table 7 Effects of test probioics on body weight and dementionen of replacement cattle
2.3 地衣芽孢杆菌在幼龄动物体内的定植观察
上文所描述的结果证明了地衣芽孢杆菌对后备牛生长性能的提高及瘤胃内环境的稳定作用明显,但是地衣芽孢杆菌在动物胃肠道中是否可以定植是一个值得关注的事情。芽孢杆菌在其生长发育后期,在细胞内形成一个圆形或椭圆形、厚壁、含水量极低、抗逆性极强的休眠体,即为芽孢。前人的研究表明,芽孢杆菌芽孢能在单胃动物消化的过程中被消化道环境激活,并以活性形式存在,在消化道内萌发甚至繁殖,最终在粪便中排出[14-15]。地衣芽孢杆菌和枯草芽孢杆菌的芽孢可以在猪的胃肠道中萌发,但只有很少的营养细胞能够生长,停喂后粪便中的芽孢数逐渐降低,在停喂10~11 d后,粪便中的芽孢数与对照组相近,都在1×104CFU/g左右,说明地衣芽孢杆菌和枯草芽孢杆菌不能在猪消化道内定植[14]。将纳豆芽孢杆菌投入到奶牛瘤胃后,其粪便中的芽孢数逐渐降低,48 h后芽孢数已经低于1×103CFU/g[16]。本研究团队符运勤[11]选取从出生一直饲喂地衣芽孢杆菌到52周龄后备牛,与出生后一直未曾饲喂芽孢杆菌的后备牛进行比较。前者在停喂地衣芽孢杆菌后,在第 1、3、5、7、14 天当天晨饲前直肠采集粪便测定芽孢数。结果表明,随着停喂天数的增加,后备牛粪便芽孢数在显著降低,在停喂1和3 d时,芽孢数显著高于后者,但是停喂5 d及以后,2组牛粪便芽孢数相当,均低于1×107CFU/g,见表8。说明地衣芽孢杆菌也不能在后备牛肠道中大量繁殖,需要在饲粮中持续添加。

表8 地衣芽孢杆菌停喂后不同时间点粪便中芽孢数Table 8 Spore counts in faeces at different sampling time after no feeding Bacillus licheniformis lg(CFU/g)
3 小结与展望
毋容置疑,微生物制剂在动物营养与饲料中的应用将越来越得到重视,微生态制剂也将成为饲料工业投入品的核心之一。对于反刍动物,瘤胃是一个复杂的微生态环境,不仅有细菌,还有真菌和原虫等,而且这些微生物之间是相互作用的,将构成一个完整的微生物区系,这个区系直接关系到动物的健康和生产性能。牛羊等反刍动物出生时消化系统类似于单胃动物,几天之后瘤胃内就有微生物活动,几周后动物就有反刍行为,几个月后就具有利用粗饲料的能力。这个特殊的时期的微生物发生与发展是一个值得开展深入的试验和研究,建立平衡健康的微生态环境和微生物区系无疑是对动物健康的一个基本保障,建立更加完善的瘤胃内环境将有利于动物的生产性能发挥和机体发育。
目前主要用动物的生长性能、瘤胃细菌数量、瘤胃内环境因素评价微生物制剂的作用,均属于表观上分析微生物制剂的作用。如果将判断指标向瘤胃微生物的总量和结构、向不同的目标基因及其表达量方面进展,将更有利于解释外来益生菌对瘤胃微生物的影响作用;同时微生物制剂和其他益生素如天然物、低聚糖等的配伍也将是今后的一个研究热点。
致谢:本团队成员董晓丽、周盟和符运勤等同学围绕益生菌在幼龄反刍动物的生理营养项目,开展了大量研究工作,获得了第一手资料,本文的主要数据来自她们的论文,特此致谢。
[1]蓝景刚,胡宏.双歧杆菌的免疫调节作用研究进展(上)[J].中国微生态学杂志,2002,14(2):122-124,封三.
[2]米文正.早期断奶仔猪的生长发育特点及其营养调控[J].当代畜禽养殖业,2002(10):38-40.
[3]DIERICK N A.Biotechnology aids to improve feed and feed digestion:enzymes and fermentation[J].Archiv für Tierernährung,1989,39(3):241-261.
[4]YEO J,KIM K I.Effect of feeding diets containing an antibiotic,a probiotic,or yucca extract on growth and intestinal urease activity in broiler chicks[J].Poultry Science,1997,76(2):381-385.
[5]YORUK M A,GUL M,HAYIRLI A,et al.The effects of supplementation of humate and probiotic on egg production and quality parameters during the late laying period in hens[J].Poultry Science,2004,83(1):84-88.
[6]CHRISTENSEN H R,FRØKIÆR H,PESTKA J J.Lactobacilli differentially modulate expression of cytokines and maturation surface markers in murine dendritic cells[J].The Journal of Immunology,2002,168(1):171-178.
[7]FRIZZO L S,ZBRUN M V,SOTO L P,et al.Effects of probiotics on growth performance in young calves:a meta-analysis of randomized controlled trials[J].Animal Feed Science and Technology,2011,169(3/4):147-156.
[8]SIGNORINI M L,SOTO L P,ZBRUN M V,et al.Impact of probiotic administration on the health and fecal microbiota of young calves:a meta-analysis of randomized controlled trials of lactic acid bacteria[J].Research in Veterinary Science,2012,93(1):250-258.
[9]于萍,王加启,卜登攀,等.日粮添加纳豆芽孢杆菌对断奶后犊牛胃肠道纤维分解菌的影响[J].中国农业大学学报,2009,14(1):111-116.
[10]QIAO G H,SHAN A S,MA N,et al.Effect of supplemental Bacillus cultures on rumen fermentation and milk yield in Chinese Holstein cows[J].Journal of Animal Physiology and Animal Nutrition,2010,94(4):429-436.
[11]符运勤.地衣芽孢杆菌及其复合菌对后备牛生长性能和瘤胃内环境的影响[D].硕士学位论文.北京:中国农业科学院,2012.
[12]董晓丽.益生菌的筛选鉴定及其对断奶仔猪、犊牛生长和消化道微生物的影响[D].博士学位论文.北京:中国农业科学院,2013.
[13]周盟.植物乳杆菌和枯草芽孢杆菌及其复合菌在断奶仔猪和犊牛日粮中的应用研究[D].硕士学位论文.乌鲁木齐:新疆农业大学,2013.
[14]LESER T D,KNARREBORG A,WORM J.Germination and outgrowth of Bacillus subtilis and Bacillus licheniformis spores in the gastrointestinal tract of pigs[J].Journal of Applied Microbiology,2008,104(4):1025-1033.
[15]CARTMAN S T,LARAGIONE R M,WOODWARD M J.Bacillus subtilis spores germinate in the chicken gastrointestinal tract[J].Applied and Environmental Microbiology,2008,74(16):5254-5258.
[16]彭华.纳豆枯草芽孢杆菌对奶牛生产性能、瘤胃发酵和血液指标的影响[D].硕士学位论文.北京:中国农业科学院,2011:21-22.

