姬松茸粗多糖提高脑老化小鼠学习记忆能力的作用及其机制
黄清松,李红枝,郑 敏,陈爱葵
(1.广东药学院基础学院生物学教研室,广东 广州 510006;2.广东教育学院生物系,广东 广州 510303)
姬松茸(Agaricus Blazei Murill)为蘑菇科蘑菇属真菌,富含蛋白质和糖类。姬松茸多糖是从姬松茸子实体中提取的有效活性成分,具有螺旋状的三维立体结构,是一种β型的葡聚糖。据相关研究[1-3]报道:姬松茸多糖具有降血糖、提高免疫力、抗病毒和抗肿瘤等作用。关于姬松茸多糖提高脑老化小鼠学习记忆能力的作用及其机制的研究国内外尚未见报道。D-半乳糖(D-gal)致动物衰老模型由徐黻本首次提出,在国内已被广泛应用。许多学者在大鼠和小鼠上都证实该模型表现出几种与人类自然衰老相类似的机能改变,包括出现脑老化[4-6]。本研究以颈背部皮下注射D-gal制备脑老化小鼠模型,采用水迷宫、避暗仪、流式细胞术等实验方法,观察姬松茸粗多糖对D-gal致脑老化模型小鼠行为学、海马神经细胞线粒体膜电位及凋亡的影响,探讨其提高脑老化小鼠学习记忆能力的作用及可能机制,为更好地开发利用姬松茸资源提供实验依据。
1 材料与方法
1.1 动 物 雄性昆明种小鼠40只,体质量20~25g,由广东省医学实验动物中心提供,生产许可证号:SCXK(粤)2008-0002。
1.2 药品制备 姬松茸粗多糖由本研究组自制:取姬松茸原菌体1 000g,加约5倍蒸馏水浸泡12h,文火煮沸1h,收集煎液,再加等体积的蒸馏水文火煮沸30min,收集煎液。合并2次煎液,静置12h,过滤,浓缩至一定体积后,加入80%的乙醇沉淀12h,离心,收集醇沉物。醇沉物于恒温干燥箱(75℃~80℃)至相对干燥,获得姬松茸多糖粗制品,每克浸膏相当于生药3.0g。
1.3 主要试剂与仪器 Annexin V-FITC &PI试剂盒为美国Pharmingen公司产品,JC-1试剂盒为美国Cell Technology(细胞工程)公司产品;Morris水迷宫(中国医学科学院药物研究所,型号:DMS-2),小鼠避暗仪(成都泰盟公司,型号:BA-200),流式细胞分析仪(美国贝克曼库尔特公司,型号:FC 500)。
1.4 动物模型制备与分组 小鼠随机分为4组,每组10只:正常组,D-gal脑老化模型组,姬松茸粗多糖低、高剂量组。除正常组小鼠颈背部皮下注射生理盐水外,其他各组小鼠颈背部皮下注射D-gal 120mg·kg-1,每天1次,连续42d,制备小鼠亚衰老模型。在制备动物模型的同时,正常组和模型组小鼠灌胃生理盐水,姬松茸粗多糖低、高剂量组小鼠分别灌胃姬松茸粗多糖60和120mg·kg-1,每天1次。42d后进行行为学、海马神经细胞线粒体膜电位及凋亡的检测。行为学检测期间正常饲养小鼠。
1.5 空间探索测试[7]测试设备为 Morris水迷宫。迷宫水池壁上标明4个等距离点,等分成4个象限。在位于池壁和圆心中间的第4象限放置一平台,平台没于水下1cm,水中倒入牛奶,使小鼠视觉无法辨别平台。设定平台为中心,中心区域为半径5cm环内,中环为向外25cm内,外环为再向外40cm。通过迷宫上方与计算机相连接摄像机全程跟踪小鼠活动轨迹。实验在安静环境进行,水池水温(25.0±1.0)℃。正式测试前先对各组小鼠进行适应性训练:从水迷宫池壁第2象限(远离目标象限)处放下小鼠,记录小鼠从入水到爬上平台所需的时间。如果小鼠在3min内未找到平台,由实验者将其引导至平台,待小鼠爬上平台并停留20s。每天训练1次,连续5d。第6天撤去平台,随机选下水点进行正式测试,以3min内小鼠分别在中心区、中环、外环的游泳距离占总距离的百分比及第4象限(目标象限)游泳路程表示小鼠学习记忆能力。
1.6 被动回避测试 避暗仪由明暗两室组成,大小相同,底部为不锈钢栅。明室上方装置15W日光灯一只,暗室通36V电压。首先进行记忆获得性训练:将小鼠放入明室,因天生具有嗜暗习性,小鼠钻入暗箱即遭受电击,迅速逃离暗室,从而获得暗箱遭受电击记忆,为期1d。24h后,将小鼠放入明室,记录300s内小鼠放入明室到进入暗室的时间(潜伏期)和进入暗室的次数(错误次数),以此表示小鼠的学习记忆能力。
1.7 海马神经细胞线粒体膜电位测定 小鼠颈椎脱臼处死,迅速取出全脑,冰盘上分离海马,投入液氮冷冻后取出,放入冰箱(-80℃)保存备用。检测时,海马置于盛生理盐水的培养皿,用2张处理洁净的载玻片轻研组织至匀浆状,过300目筛网制备成单细胞悬液,悬液于室温下5 000r·min-1离心2min,弃上清,加入10mg·L-1的JC-1,避光静置15min后,以激发波长488nm行流式细胞分析。采用Cell Quest数据处理软件,获取1×104个细胞。以测量JC-1的荧光强度(反映线粒体膜电位的高低)来了解小鼠海马神经细胞线粒体膜电位的变化。
1.8 海马神经细胞凋亡检测 制备单细胞悬液(方法同1.7),冰预PBS洗细胞2次,以1×结合缓冲液重悬细胞,并调整细胞浓度至1×106mL-1,取细胞悬液100μL至5mL管,再加入Annexin-V-FITC 5μL、PI 10μL,混匀。于避光室温下孵育15min,然后每管加入1×结合缓冲液400μL,1h内激发波长488nm行流式细胞分析。计数1×104个细胞,所有资料均经Cell Qust软件收集处理,以细胞凋亡百分率表示小鼠海马神经细胞凋亡情况。
1.9 统计学分析 采用SPSS 14.0软件包进行统计分析,各组小鼠空间探索测试指标、潜伏期、错误次数、线粒体膜电位和细胞凋亡百分率以±s表示,组间比较采用单因素方差分析。
2 结 果
2.1 各组小鼠空间探索测试结果 与正常组比较,模型组小鼠在外环区域的游泳距离占总游泳距离百分比显著增多(P<0.01),中环和中心区域的游泳距离占总游泳距离百分比显著减少(P<0.01),第4象限游泳路程显著减少(P<0.01)。与模型组比较,姬松茸粗多糖组小鼠中心区域游泳距离占其总距离百分比明显提高(P<0.05或P<0.01),第4象限游泳路程明显增多(P<0.05)。姬松茸粗多糖高、低剂量组间比较差异无统计学意义(P>0.05)。见表1。
表1 各组小鼠空间探索测试指标Tab.1 Experimental indicators of space exploration of mice in vanous groups (n=10,±s)

表1 各组小鼠空间探索测试指标Tab.1 Experimental indicators of space exploration of mice in vanous groups (n=10,±s)
* P<0.01compared with normal group;△P<0.05,△△P<0.01compared with model group.
Group Dosage(mg·kg-1)Outer ring(η/%)Middle ring(η/%) Centre(η/%) Swimming course(l/cm)Normal — 52.47±7.26 42.51±7.15 5.82±1.46 317.25±85.62 Model — 63.75±9.34* 34.15±6.32* 2.64±1.05* 216.42±67.35*Agaricus blazei polysaccharide 285.72±78.15△120 57.36±8.14 38.24±6.75 4.76±1.35△△ 294.28±82.76 60 61.84±8.92 35.16±6.27 3.72±1.28△△
2.2 各组小鼠被动回避测试结果 与正常组比较,模型组小鼠的逃避电击潜伏期显著缩短(P<0.01),错误次数显著增多(P<0.01)。与模型组比较,姬松茸粗多糖组小鼠潜伏期明显延长(P<0.05),错误次数明显减少(P<0.01)。姬松茸粗多糖高、低剂量组间比较差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠被动回避测试结果Tab.2 Results of passive avoidance response of mice in various groups (n=10,±s)
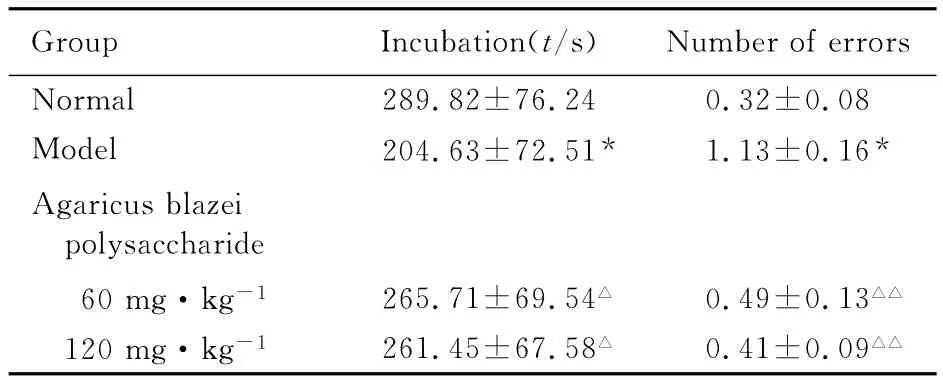
表2 各组小鼠被动回避测试结果Tab.2 Results of passive avoidance response of mice in various groups (n=10,±s)
* P<0.01compared with normal group;△P<0.05,△△P<0.01compared with model group.
Group Incubation(t/s)Number of errors Normal 289.82±76.24 0.32±0.08 Model 204.63±72.51* 1.13±0.16*Agaricus blazei polysaccharide 60mg·kg-1 265.71±69.54△ 0.49±0.13△△120mg·kg-1 261.45±67.58△ 0.41±0.09△△
2.3 各组小鼠海马神经细胞线粒体膜电位和细胞凋亡率 与正常组比较,模型组小鼠海马神经细胞线粒体膜电位显著下降(P<0.01),细胞凋亡率显著提高(P<0.01);与模型组比较,姬松茸粗多糖组小鼠线粒体膜电位显著升高(P<0.01),细胞凋亡率明显下降(P<0.05或P<0.01)。姬松茸粗多糖高、低剂量组间比较差异无统计学意义(P>0.05)。见表3。
表3 各组小鼠海马神经细胞线粒体膜电位和细胞凋亡率Tab.3 Mitochondrial membrane potential and apoptotic rates of mouse hippocamal neuron in various groups(n=10,±s)

表3 各组小鼠海马神经细胞线粒体膜电位和细胞凋亡率Tab.3 Mitochondrial membrane potential and apoptotic rates of mouse hippocamal neuron in various groups(n=10,±s)
* P<0.01compared with normal group;△P<0.05,△△P<0.01compared with model group.
Group Mitochondrial membrane potential(fluorescence intensity relative value)Apoptotic rate(η/%)Normal 179.47±21.56 3.65±0.86 Model 126.35±13.71* 7.14±1.35*Agaricus blazei polysaccharide 60mg·kg-1 148.36±15.27△△ 5.82±1.17△120mg·kg-1 165.81±19.34△△ 5.16±1.03△△
3 讨 论
本研究分别采用Morris水迷宫和避暗仪测试小鼠的学习记忆能力[8-9]:以小鼠分别在水迷宫中心区、中环、外环的游泳距离占总游泳距离的百分比和第4象限游泳路程作为参数,记录小鼠的探索平台的过程,其关键在于小鼠在围绕平台的中心区域时间和路程;以被动回避法记录小鼠自放入明室到进入暗室的时间和进入暗室的次数,凡300s仍不进入暗室者,反映记忆功能良好。本研究结果显示:与正常组比较,模型组小鼠在外环区的游泳距离占其总距离百分比显著增多,中环和中心区域的游泳距离占总游泳距离的百分比显著减少,第4象限游泳路程明显减少,躲避电击潜伏期显著缩短,进入暗箱的错误次数显著增多,提示D-gal致衰小鼠出现明显的记忆巩固和再现障碍等脑老化迹象;给予姬松茸粗多糖后,衰老小鼠在中心区域游泳距离占其总距离百分比明显提高,衰老小鼠在第四象限游泳路程增加,躲避电击潜伏期明显延长,进入暗箱的错误次数明显减少,提示姬松茸粗多糖可提高衰老小鼠学习记忆和回避遭受电击的能力,发挥延缓脑老化进程的作用。
线粒体是真核细胞中由双层高度特化的单位膜围成的细胞器,其主要功能是通过氧化磷酸化作用合成ATP,为细胞各种生理活动提供能量。线粒体由两层膜包被,外膜平滑,内膜向内折叠形成嵴。线粒体中央由内膜包绕为内室,两层膜之间为外室。内膜存在有质子泵,质子泵将质子从内室泵出,进入外室,从而形成内室为负、外室为正的横跨线粒体内膜的线粒体膜电位,该电位对维持线粒体正常功能极为重要[10-11]。近年来,有关研究逐渐认识到线粒体可能是调控细胞凋亡的中心[12]。有研究[13]报道:在多种诱导因素下均观察到线粒体膜电位的下降,如:肿瘤坏死因子、化疗药物、糖皮质激素等诱导的细胞凋亡过程中。线粒体膜电位的降低是细胞发生凋亡早期的一个不可逆变化[14]。稳定线粒体膜电位成为抑制细胞凋亡的重要机制之一[15]。本研究采用流式细胞技术观察姬松茸粗多糖对脑老化小鼠海马神经细胞线粒体膜电位及凋亡发生率的影响,结果显示:与正常组比较,模型组小鼠海马神经细胞线粒体膜电位显著下降,细胞凋亡率显著提高,提示D-gal致衰老小鼠海马神经细胞存在线粒体膜电位的异常,可能是小鼠海马神经细胞发生凋亡的早期原因之一;给予姬松茸粗多糖后,小鼠海马神经细胞线粒体膜电位则显著升高,细胞凋亡率则明显下降,提示姬松茸粗多糖可提高衰老小鼠海马神经细胞线粒体膜电位,抑制海马神经细胞凋亡,发挥神经细胞保护作用,该作用与姬松茸粗多糖改善小鼠学习记忆能力有关。
[1]Mizuno M, Minato K, Ito H, et al. Antitumor polysaccharide from the mycelium of liquid cultured agaricus blazei murill [J].Biochem Mol Biol Int,1999,47(4):707-714.
[2]李师鹏,安利国.真菌多糖免疫活性的研究进展 [J].菌物系统,2001,20(4):581-587.
[3]刘常金,谷文英.巴西蘑菇胞外多糖的分离及抗肿瘤活性研究 [J].食品与发酵工业,2001,27(11):27-29.
[4]崔 旭,李文彬,张炳烈,等.D-半乳糖脑老化模型的脂质过氧化机理 [J].中国老年学杂志,1998,18(1):38-40.
[5]熊爱华,郑 浩,吕俊华.D-半乳糖诱导大鼠脑损伤的糖基化机制 [J].中国实验动物学报,2008,16(3):197-200.
[6]赵君玫,詹向红,杨 雪,等.愤怒对D-gal致脑老化大鼠学习记忆功能的影响 [J].实用预防医学,2010,17(10):2036-2038.
[7]徐叔云,卞如濂,陈 修.药理实验方法学 [M].3版.北京:人民 卫生出版社,2002:828-829.
[8]谢日青,陶 涛,陈民利.D-半乳糖致衰老模型大鼠的学习记忆和行为学观察及中药干预作用 [J].中国比较医学杂志,2010,20(5):32-36.
[9]蔡琳琳,李 浩,刘剑刚,等.还脑益聪方组分对B淀粉样前体蛋白转基因痴呆小鼠行为学及胆碱能系统的早期干预作用 [J].中西医结合学报,2011,9(3):292-298.
[10]Kroemer G,Zamzami N,Susin SA.Mitochondrial control of apoptosis [J].Immunol Today,1997,18(1):44-51.
[11]翟 科,陈丽倩,潘 达,等.褪黑素干预大鼠胰腺炎线粒体膜电位及caspase 3的变化研究 [J].医学研究杂志,2011,40(4):55-58.
[12]李 翎,方永奇,邹衍衍,等.醒神喷鼻液对脑出血大鼠脑组织的钙离子浓度及线粒体膜电位的影响研究 [J].时珍国医国药,2012,23(8):1959-1960.
[13]Guideo K,Patrice P,Naoufal Z,et al.The biochemistry of programmed cell death [J].FASEB J,1995,9(6):1277-1287.
[14]Zamarn N,Marehetti P,Castedo M,et al.Reduetion in mltoehondrial potential constitutes an early irreversible step of programmed lymphocyte deathinvivo[J].J Exp Med,1995,181(10):1661-1672.
[15]张冬梅,曾翔俊,王红霞,等.缺氧后处理大鼠心肌细胞线粒体膜电位和细胞凋亡的变化及MS-PPOH对其的影响 [J].微循环学杂志,2010,20(4):7-10.

